| 邬麟,湖南省肿瘤医院(中南大学湘雅医学院附属肿瘤医院)胸部内二科主任,中南大学肿瘤学博士生导师。担任中国南方肿瘤临床研究协会(CSWOG)常务理事,CSWOG肺癌专业委员会副主任委员兼秘书长,中华医学会肿瘤学分会肿瘤内科专家委员会委员,中国临床肿瘤学会(CSCO)理事,中国抗癌协会临床化疗专业委员会常务委员,中国抗癌协会肺癌专业委员会委员,中国抗癌协会多原发和不明原发肿瘤专业委员会常务委员,中国老年保健协会肺癌专业委员会副主任委员,湖南省抗癌协会肿瘤化疗专业委员会主任委员,湖南省健康服务业协会肿瘤防治分会理事长,湖南省医师协会肿瘤医师分会副会长,湖南省抗癌协会靶向治疗专业委员会副主任委员,湖南省抗癌协会肿瘤精准医学专业委员会副主任委员。邬麟教授团队主要开展胸部恶性肿瘤内科治疗、转化研究及临床试验,主持省部级科研课题10余项,其中省科技厅重点项目1项,重大新药创制项目子课题2项,作为分中心PI主持国际和国内多中心临床试验90余项,获得湖南省医学科技奖三等奖2项,发表学术论文60余篇。 |
Paik PK, Felip E, Veillon R, et al. Tepotinib in non-small-cell lung cancer with MET exon 14 skipping mutations[J]. N Engl J Med, 2020, 383(10):931-943.
2b。
约3%~4%非小细胞肺癌(non-small-cell lung cancer, NSCLC)患者具有MET 14外显子跳读突变。Tepotinib是高选择性口服MET抑制剂, 既往研究表明, tepotinib在MET驱动的肿瘤患者中已显示出令人鼓舞的临床活性。
评估MET抑制剂tepotinib对MET14外显子跳读突变的晚期NSCLC患者的疗效与安全性。
• 研究条件:包含美国、法国等11个国家超过130个中心参与的VISION研究(NCT02864992)。
• 研究起止时间:2016年9月13日至2020年1月1日。
• 研究方法:多中心、开放标签、Ⅱ 期临床试验。
• 研究对象:MET14外显子跳读的局部晚期或转移性NSCLC患者。入组标准:≥ 18岁; 有可测量病灶; PS 0~1分; 神经系统症状稳定且糖皮质激素逐步减量的脑转移患者, 最长径≤ 1 cm的无症状的初治脑转移患者。排除标准:EGFR突变或ALK重排患者。
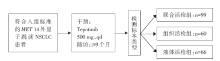
• 干预措施:患者接受tepotinib 500 mg, qd。运用液体活检进行循环游离DNA(circulating free DNA, cfDNA)或新鲜组织或石蜡包埋组织进行RNA评估前瞻性检测MET 14外显子跳读突变情况。入组总病例数152例, 其中, 联合活检组99例, 液体活检组66例, 组织活检组60例。研究设计及分组见图1。
• 评价指标:客观缓解率(objective response rate, ORR), 缓解持续时间, 无进展生存期(progression-free survival, PFS), 安全性。
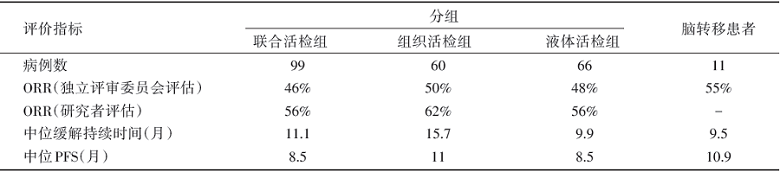
共152例MET 14外显子跳读突变的晚期NSCLC患者接受了tepotinib治疗, 99例患者随访时间超过9个月。接受tepotinib治疗的MET 14外显子跳读突变晚期NSCLC患者疗效及生存分析见表1。
| 表1 VISION研究主要结果 |
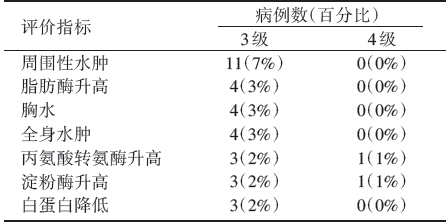
152例接受tepotinib治疗的MET 14外显子跳读突变患者的安全性分析及主要的≥ 3级不良事件见表2及表3。
| 表2 VISION研究安全性 (%) |
| 表3 VISION研究主要≥ 3级不良事件 |
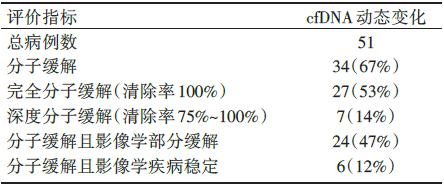
cfDNA作为检测免疫治疗疗效的生物标志物的相关分析见表4。
| 表4 VISION研究cfDNA标志物 |
34例患者达到cfDNA分子缓解, 其中影像学评估24例部分缓解, 6例稳定, 客观缓解率和疾病控制率分别为71%、88%。
对于MET14外显子跳读突变晚期NSCLC患者, 使用tepotinib治疗大约一半患者可达到部分缓解, 最常见的≥ 3级不良事件是周围性水肿。
靶向治疗在晚期NSCLC的应用已成为抗肿瘤精准治疗的范例, 随着更多驱动基因及可用药靶点的开发, NSCLC的靶向治疗日益全面。MET原癌基因编码受体酪氨酸激酶, 通过与配体(肝细胞生长因子, hepatocyte growth factor, HGF)结合, 经过RAS-RAF和磷酸肌醇3-激酶(PI3K)通路诱导下游信号传导。MET激活后通过增加细胞增殖异常驱动肿瘤生长, 存活, 浸润和转移。MET基因的点突变、插入、缺失或大片段的全外显子缺失可引起剪接位点改变, 继而发生MET 14号外显子转录缺失, 驱动肿瘤发生发展[1]。MET14号外显子剪切位点致癌驱动变异(MET 14外显子跳读突变)发生在3%~4%的NSCLC患者, 患者发病年龄大多为70岁及以上[2, 3, 4], 且携带该突变的患者预后较差。近年来不断有研究在评估ATP竞争的小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)治疗MET14外显子跳读NSCLC患者的疗效, 这些药物包括非选择性1型抑制剂(例如克唑替尼)和选择性1b型抑制剂(如tepotinib, savolitinib, capmatinib)[5, 6], 并显示出有前景的MET抑制临床活性, 成为了NSCLC分子靶向治疗研究的新热点。
在无驱动突变或者无靶向药物的驱动基因阳性的NSCLC患者中, 一线免疫治疗联合/不联合化疗为标准疗法。针对MET 14外显子跳读突变NSCLC患者与免疫治疗疗效的相关性, 回顾性数据表明无论程序性死亡配体1(programmed death ligand-1, PD-L1)表达水平如何, 免疫检查点抑制剂在该类患者中的临床活性不佳(响应率为16%~17%)[7, 8]。因此, 携带MET 14号外显子跳读突变的NSCLC治疗亟待改善。此前, 在PROFILE 1001研究中克唑替尼入组了65例MET14外显子跳读突变的NSCLC患者, 研究者评价的ORR是32%, 中位PFS为7.3个月[9], 疗效不尽如人意。同样是针对MET 14外显子跳读突变的NSCLC患者, Ⅱ 期GEOMETRY mono-1研究结果显示, 经capmatinib治疗后由独立评审委员会(independent review committee, IRC)评估复治患者和初治患者的ORR分别为41%和68%, 由IRC评估复治患者和初治患者的中位PFS分别为5.4个月和12.4个月[10], 疗效有一定程度的提高。此外, 基于另一项国内Ⅱ 期研究(NCT02897479)的结果, 沃利替尼(savolitinib)被中国食品药品监督管理局纳入优先审批治疗MET14外显子跳读突变的NSCLC, 在该项研究中, 沃利替尼的ORR达到了47.5%, 中位PFS为6.8个月[11], 值得注意的是这项研究同时纳入了MET 14外显子跳读突变的NSCLC和肺肉瘤样癌患者。本项VISION研究涉及的药物tepotinib是另一种高选择性、ATP竞争性、可逆、强效的MET-TKI, 研究结果显示tepotinib在MET 14外显子跳读突变晚期NSCLC患者中具有持续的抗肿瘤活性, 经IRC及研究者评估的缓解率分别达46%~50%和56%~62%, 患者大多在初始治疗后6周后开始出现缓解, 中位缓解持续时间(duration of response, DoR)为11.1个月。由此可见, 关于MET 14外显子跳读突变NSCLC治疗的研究数据日趋完善, 可选择的药物日趋增多, 高选择性的MET抑制剂正不断加入NSCLC靶向治疗的大阵营, 成为肺癌精准治疗的新贵。
本研究的亮点之一是纳入了症状稳定的脑转移患者, 并报道了tepotinib在11例脑转移患者经IRC评估的ORR为55%, 中位DoR为9.5个月, 中位PFS为10.9个月的结果, 显示了较好的疗效。另外有案例报道提示tepotinib在一例软脑膜案例中的颅内渗透率(脑脊液浓度比血浆浓度)为1.83%[12], 提示tepotinib有潜在的颅内病灶活性。研究另外的亮点之一在于设计了组织及液体活检的辅助标志物探索, 同时动态监测循环游离DNA(cfDNA)中MET14外显子跳读突变状态动态变化与疗效的相关性。患者入组时既可接受肿瘤组织标本检测, 也可接受液体活检, 研究结果显示, 无论基于液体活检, 还是组织活检, tepotinib对MET14外显子跳读突变的进展期NSCLC患者均有良好的ORR和较长的DoR, 且药物的安全性可控。基于晚期NSCLC患者肿瘤组织标本获取困难及肿瘤组织量有限性的考虑, 这在很大程度上给予患者更多接受精准治疗的机会。从动态液体活检结果可以看到, cfDNA分子缓解的34例患者中24例(71%)有影像学缓解, 总体疾病控制率为88%; 而10例cfDNA无分子缓解甚至治疗后比基线增加的患者中, 其中仅1例(10%)对治疗有反应, 提示分子学缓解与临床缓解的高度一致性。耐药机制方面, 研究观察到tepotinib治疗原发耐药的机制可能涉及RAS-RAF及PI3K-AKT通路, 但目前获得性耐药的相关数据有所不足。与其他同类研究一样, 目前关于MET 14外显子跳跃突变NSCLC患者TKI治疗的数据都是单臂的Ⅰ ~Ⅱ 期研究的结果, 尚缺乏与标准化疗的前瞻性头对头比较的证据。
总而言之, 基于VISION研究的结果, MET 14外显子跳读在NSCLC已然成为了一个有药可用的全新靶点, 而针对组织活检或液体活检的MET检测应当作为常规并有望为NSCLC患者带来潜在的临床获益, tepotinib作为高效的MET-TKI, 为MET基因异常NSCLC患者的治疗提供了更为精准的选择。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|