| 崔久嵬,吉林大学白求恩第一医院肿瘤中心肿瘤科主任,教授,博士生导师。中国抗癌协会青年理事会副理事长,中国研究型医院生物治疗委员会副主任委员,中国医药质量管理协会细胞治疗质量控制与研究专业委员会副主任委员,CTONG成员。曾赴美国西奈山医院、美国Emory大学、美国MD Anderson肿瘤中心、美国杜克大学肿瘤中心进修学习。曾获中国肿瘤青年科学家奖、吉林省青年科技奖特别奖等。主要研究方向为肿瘤发病机制及精准治疗研究。 作为项目负责人主持科技部重大慢病项目、国家自然科学基金面上项目、卫健委临床重点项目等多项课题。曾在《Genome Biol》、《Clin Cancer Res》、《Nucleic Acids Res》等期刊发表多篇文章。 |
Wolf J, Seto T, Han J Y, et al. Capmatinib in MET exon 14-mutated or MET-amplified non-small-cell lung cancer[J]. N Engl J Med, 2020, 383(10):944-957.
1a。
在非小细胞肺癌(non-small cell lung cancer, NSCLC)中, MET 14外显子跳跃突变(跳读)发生率在3%~ 4%, 而MET扩增发生率为1%~ 6%。Capmatinib(INC280, 卡马替尼)是MET受体的选择性抑制剂, 在MET激活的各种癌症模型中显示出抗肿瘤活性。
研究capmatinib在经治和初治的晚期MET 14跳读或MET扩增NSCLC患者的活性。
• 研究条件:全球包括德国、日本等共156个中心参加的GEOMETRY mono-1临床研究(NCT02414139)。
• 研究类型:前瞻性、国际、开放标签、多队列、Ⅱ 期临床试验。
• 研究时间:2015年至2023年(仍在进行中)。
• 研究对象:≥ 18岁的Ⅲ B~Ⅳ 期NSCLC患者; EGFR(L858R、19del)突变、ALK融合阴性; ECOG PS评分 0或1分; 实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)1.1版至少一个可测量靶病灶; MET14跳读突变或MET扩增; 无症状或神经系统稳定的脑转移。
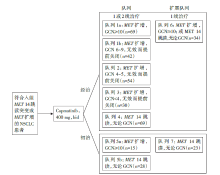
• 干预措施:入组患者根据既往是否接受过治疗、MET扩增基因拷贝数(gene copy number, GCN)以及MET 14跳读分为7个队列, 受试者接受capmatinib 400 mg, bid治疗, 研究设计见图1。
• 评价指标:主要研究终点指标包括总反应率(overall response rate, ORR):完全缓解(complete response, CR)或部分缓解(partial response, PR); 次要研究终点指标包括反应持续时间(duration of response, DoR)、疾病控制率(disease control rate, DCR)、疾病稳定(stable disease, SD)、疾病进展(progression disease, PD)、无进展生存期(progression-free survival, PFS)、药物安全性及药物代谢动力学等。
共入组晚期NSCLC患者364例。队列1~5中, 共有97例MET 14跳读和210例MET扩增。队列1~4患者既往接受1或2线的治疗, 而队列5a和5b患者为初治。队列6包含34例患者:3例MET扩增(GCN≥ 10)、31例MET 14跳读。截至数据截止点(2020-01-06), 共有23例MET14跳读初治患者纳进队列7, 该队列无有效性数据可行分析。在有效性分析数据截止点(2020-01-06), MET基因拷贝数小于10的3个队列(队列1b、2和3)因无效而提前关闭(截止日期2019-04-15)。所有队列的安全分析的截止日期是2020-01-06。
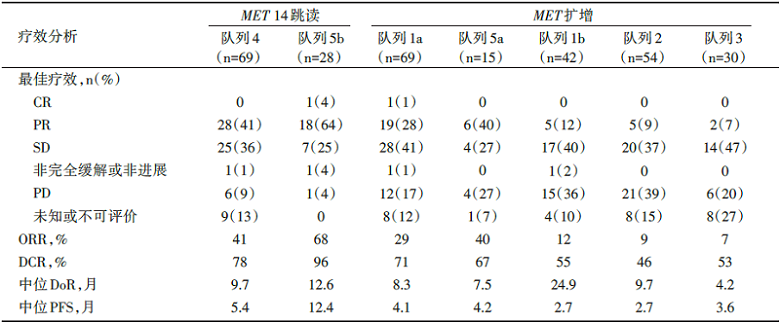
在97例MET 14跳读的NSCLC患者中, 既往已经接受1~2线治疗(队列4, n=69)和初治(队列5, n=28)患者, ORR分别为41%[95%可信区间(confidence interval, CI)29~53]和68%(95%CI 48~84); DoR分别为9.7个月(95%CI 5.6~13.0)和12.6个月(95%CI 5.6~无法估计)。在经治的基因拷贝数< 10(队列1b、2、3)的MET扩增患者中观察到有限的疗效(ORR 7%~12%)。在基因拷贝数≥ 10的MET扩增患者中, 经治组(队列1a)和初治组(队列5a)的ORR分别为29%(95%CI 19~41)和40%(95%CI 16~68), 见表1。最常见的不良事件是周围性水肿(51%)和恶心(45%), 这类不良事件大多为1级或2级。
| 表1 各队列疗效情况 |
Capmatinib在晚期MET 14跳读NSCLC患者中表现出抗肿瘤活性, 尤其是在初治患者中。在MET扩增患者中, MET基因拷贝数高比基因拷贝数低能获得更好的疗效。低级别的周围性水肿和恶心是主要的毒性不良反应。
MET原癌基因位于人类7号染色体(7q21-31), 包括21个外显子, 其编码蛋白为跨细胞膜的酪氨酸激酶受体c-MET, 与肝细胞生长因子(hepatocyte growth factor, HGF)结合激活c-MET下游信号通路, 发挥促细胞增殖、生长、迁移及血管生成的作用。MET基因异常时会促进肿瘤增殖与转移, 是近年来备受关注的恶性肿瘤驱动基因。在非小细胞肺癌患者(NSCLC)中, MET基因原发异常主要包括第14外显子(ex14)跳跃(skipping)突变和扩增, 此部分患者的治疗一直存在困境, 患者预后差, 对现有的标准治疗不敏感。近年来, 随着基因诊断技术及药物研发的快速发展, 靶向MET异常的精准治疗呈现快速发展。整体而言, 传统单抗疗效有限, 抗体偶联(antibody-drug conjugate, ADC)类药物初显疗效, 小分子激酶抑制剂治疗地位日益明确。GEOMETRY mono-1研究[1]结果确定了capmatinib(卡马替尼)在MET基因异常患者治疗中的地位, 也为针对MET精准治疗提出新的思考:
(1)MET ex14跳跃突变肺癌患者治疗迎来新的突破:MET ex14跳跃突变, 使得含有E3泛素连接酶c-Cbl结合位点的近膜结构域缺失, 进而导致c-MET蛋白泛素化障碍、c-MET稳定性增加, 降解率降低, 引起下游信号的持续激活, 成为肿瘤的驱动基因。在NSCLC中, METex14跳跃突变的总体发生率为3%~4%, 并且不与EGFR、ALK等NSCLC的其他驱动基因共存, 提示其代表一种独立的肿瘤驱动基因。GEOMETRY mono-1研究结果显示METex14跳跃突变经治患者ORR为41%, 初治患者为68%, 中位反应持续时间分别为9.7个月和12.6个月。卡马替尼带来的疾病缓解往往比较迅速, 两组分别有82%和68%的患者在首次疗效评估时即达到最大疗效, 而在AcSé 研究中2周期克唑替尼治疗后ORR仅为10.7%。在队列6扩展研究中, 经治患者ORR为48%, 验证了队列4研究结果。MET ex14跳跃突变可以与MET基因扩增并存, 该研究显示对于并存扩增的患者同样有效, 显示了MET ex14跳跃突变的驱动作用。
该研究数据确定了卡马替尼成为MET ex14跳跃突变的晚期NSCLC患者新的治疗选择, 无论在几线应用, 都具有深度和持久的疗效。同时, Ⅱ 期VISION研究[2]结果, tepotinib(特泊替尼)无论是一线治疗还是后线治疗METex14跳读突变患者, ORR均超过了40%。基于这两项单臂Ⅱ 期研究卡马替尼和特泊替尼于2020年分别在美国、日本批准上市用于MET ex14跳读突变肺癌患者的治疗。国产savolitinib(沃利替尼)治疗MET ex14跳跃突变的肺肉瘤样癌及其他NSCLC患者ORR达47.5%, 中位PFS为9.7个月, 也再次证明此类药物对METex14跳读突变肺癌患者治疗的效果, 并已向中国国家药品监督管理局提交上市申请。GEOMETRY mono-1研究也显示卡马替尼对合并脑转移的METex14跳跃突变患者有良好的治疗效果, 与VISION研究数据相近(ORR 54.5%)。以上高选择性的MET酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)药物显示出优于多靶点非选择性药物克唑替尼的疗效。密集的高选择性MET-TKI药物的审批、获批标志着靶向NSCLC的MET驱动基因的更精准治疗新时代的到来。
(2)MET高扩增预示着使用MET抑制剂可能会有更好的疗效:原发MET基因扩增占NSCLC的1%~6%。GEOMETRY mono-1对发生MET扩增的晚期NSCLC患者依据基因拷贝数(GCN)的区间设立了多个队列以观察MET基因扩增的拷贝数对于卡马替尼治疗敏感性的影响。结果发现, 在GCN< 10的队列中, ORR在12%及以下; 而在GCN≥ 10的队列中, 经治患者ORR 29%, 初治患者(15例)ORR达到40%。数据显示在高水平MET扩增NSCLC中, 卡马替尼显示出抗肿瘤活性, 在初治患者中的缓解率更高, 但总体不及MET ex14跳读突变患者的疗效, 其受益人群有待于在未来临床研究中进一步明确。
继发MET基因扩增也是靶向治疗耐药[3]的重要机制之一, 例如, 在接受一到三代EGFR-TKI靶向治疗后的NSCLC患者中大约5%~20%的比例会出现MET扩增。特泊替尼的INSIGHT和INSIGHT2研究, 沃利替尼的TATTON研究均显示MET-TKI联合EGFR-TKI在MET高扩增耐药患者的受益。目前研究结果提示MET抑制剂将成为原发或继发MET基因高扩增经治患者新的选择。
(3)不同作用机制的MET抑制剂使MET靶向治疗策略愈加丰富:靶向MET信号通路的抑制剂在十几年前就已经开始了临床研究, 但整体的研发之路可谓一波三折。可将MET抑制剂分为3大类:抗HGF单克隆抗体、抗c-MET单克隆抗体和小分子TKI。前两者分别在细胞外与HGF和c-MET结合, 从而阻止HGF与c-MET的结合及受体磷酸化, 阻止信号传导; 此类药物包括rilotumumab、ficlatuzumab和onartuzumab等。遗憾的是, 目前尚无成功的抗HGF/c-MET单克隆抗体药物上市。近年来, 新型针对MET的抗体药物包括复合单克隆抗体(Sym015), MET× MET双特异性抗体(REGN5093), EGFR-MET双特异性抗体(JNJ-61186372)以及MET抗体偶联药物(telisotuzumab)临床试验结果初见曙光。针对MET小分子激酶区抑制剂主要分为三类:Ⅰ 型抑制剂, 主要结合ATP口袋中活性构象激酶区, 又分为Ⅰ a型抑制剂包括克唑替尼, Ⅰ b型抑制剂包括特泊替尼、卡马替尼、沃利替尼以及APL-101, 此型TKI结合位点少, 相对特异性高; Ⅱ 型抑制剂, 主要结合在ATP口袋非活性构象激酶区, 目前有cabozantinib、foretinib以及glesatinib; Ⅲ 型抑制剂, 是一类非ATP竞争性变构抑制剂, 主要结合于ATP口袋区以外, 目前尚无药物进入临床研究阶段。
MET抑制剂难以避免的是耐药的发生, 针对耐药的研究也是驱动新药研发的动力, 不同类型MET抑制剂是否可为耐药提供部分解决方案, 例如, Ⅰ 型MET-TKI耐药的MET基因二次突变D1228N/H、D123Y等, 从机制上, 可以应用Ⅱ 型MET-TKI卡博替尼进行针对性的治疗。随着不同类型抑制剂的临床应用, 针对其作用机制及耐药机制, 如何更好排兵布阵需要我们进行深入思考。另外, GEOMETRY mono-1研究显示卡马替尼安全性总体良好, 常见不良反应包括Ⅰ b类MET-TKI药物(特泊替尼、沃利替尼)共有的周围性水肿、恶心、腹泻并相互类似。卡马替尼间质性肺病发生率达到4.5%, 与特泊替尼相类似, 但在沃利替尼的临床数据中并无间质性肺炎发生, 而肝脏毒性是服用沃利替尼患者中止治疗的主要原因, 即使同一类型的MET-TKI, 其不良反应也有差别, 为临床应用提供更多的思考与选择。
(4)MET变异类型繁多为伴随诊断提出挑战:使用MET预测标志物来进行患者筛选分层, 大大提高了MET靶向药物临床研究的成功率。但MET异常的形式多样, 包括MET基因突变(如点突变、重排等)、拷贝数扩增、c-MET蛋白过表达, 对现有临床检测手段具有一定挑战性[4]。例如, MET ex14突变的发生位置多样化, 导致MET ex14突变的DNA序列变化超过100余种, 目前最常用的手段是二代测序(next generation sequencing, NGS), 可有效检出不同类型的已知/未知MET基因变异, 极大地弥补传统检测方法的不足。卡马替尼和特泊替尼获批研究中, 也都使用了NGS技术来进行METex14跳读突变检测。但DNA-NGS检测中, 当引物设计为靶向13号内含子和14号内含子的剪接点时, 可能漏检部分MET ex14跳跃突变, 因此临床检测平台需不断优化。
MET高扩增可作为MET靶向治疗的潜在预测标志物。MET基因扩增检测的一种方法是通过原位杂交技术(fluorescence in situ hybridization, FISH)评估MET拷贝数在7号染色体拷贝数占比(CEP7), 以鉴别是MET扩增还是7号染色体整体扩增导致MET多体性。除了FISH技术以外, 基于NGS测序平台也同样可以发现MET扩增, GEOMETRY mono-1研究也是应用此方法进行的检测, 在不同研究中无论是FISH还是NGS方法所设定的域值均不同, 目前界值定义标准仍然欠缺。MET扩增与免疫组织化学(immunohistochemistry, IHC)蛋白水平检测之间的一致性不完全匹配, 利用IHC筛选MET阳性患者使用MET抑制剂治疗的早期临床试验也因此以失败而告终。因此MET扩增伴随诊断技术及其界值的设定是MET抑制剂应用于此部分患者面临的挑战。目前实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qRT-PCR)、NGS(检测MET ex14跳读和MET扩增), IHC(MET蛋白过表达)和FISH(检测MET扩增)是临床研究中常用的手段。目前很多研究将多种方法结合, 以综合判断确定更适合的伴随诊断方法。
总而言之, MET ex14跳跃突变或扩增定义了一类特殊类型的NSCLC患者。随着对MET研究的深入, 药物陆续涌现, 针对MET的靶向治疗让我们看到了希望, 但仍需更精准预测标志物的发现、伴随诊断技术的完善、新药不断的开发, 以不断实现精准治疗, 为此部分患者带来受益。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|