许羚雁(1981-),女,吉林长春人,主管技师,医学硕士,研究方向为免疫学检验研究。
目的 探讨GALAD(Gender,Age,Lens culinaris agglutinin-reactive AFP,AFP,Des-γ-carboxy prothrombin)模型在原发性肝细胞癌(hepatocellular carcinoma,HCC)诊断和预后评估中的价值。方法 选取2016年11月至2019年11月在海南省肿瘤医院接受根治性手术治疗的HCC患者98例为HCC组,选取同期在海南省肿瘤医院确诊的良性肝脏疾病(benign liver diseases,BLD)患者87例为BLD组,同期进行健康体检的健康者86例为对照组。检测所有研究对象血清甲胎蛋白(alpha-fetoprotein,AFP)、甲胎蛋白异质体L3(Lens culinaris agglutinin-reactive alpha-fetoprotein,AFP-L3)、异常凝血酶原(des-γ-carboxy prothrombin,DCP)水平,采用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析单个血清标志物及GALAD模型对HCC的诊断效能,并分析GALAD模型在HCC患者手术预后中的评估价值。结果 GALAD模型诊断HCC的ROC曲线下面积(area under curve,AUC)为0.958,高于单个血清标志物及联合检测的AUC,差异有统计学意义( P<0.05),当截断值为2.75时,GALAD模型诊断HCC的灵敏度、特异度和准确度分别为81.6%、93.6%和89.3%。Kaplan-Meier生存曲线结果显示,GALAD模型高水平组患者3年累积生存率为23.8%,中位生存时间为28.03个月,低于GALAD模型低水平组的49.8%和36.38个月,差异有统计学意义( χ2=12.022, P=0.001),GALAD模型高水平组3年累积无进展生存率为7.2%,中位无进展生存时间为20.70个月,低于GALAD模型低水平组的46.0%和30.32个月,差异有统计学意义( χ2=9.810, P=0.002)。结论 GALAD模型用于HCC的诊断效能优于AFP、AFP-L3,DCP和三项联合,并对HCC患者手术预后具有一定评估价值。
Objective To explore the value of GALAD(Gender,Age,Lens culinaris agglutinin-reactive AFP,AFP,Des-γ-carboxy prothrombin) model in diagnosis and prognosis of primary hepatocellular carcinoma(HCC).Methods 98 patients with primary HCC who received radical operation from November 2016 to November 2019 in Hainan Cancer Hospital were enrolled into HCC group. At the same time, 87 patients with benign liver disease (BLD) confirmed in our hospital were enrolled into BLD group, and 86 health examinees were enrolled into control group. The levels of serum alpha fetoprotein (AFP), alpha fetoprotein variants (AFP-L3) and des-γ-carboxy prothrombin (DCP) of all subjects were detected. The receiver operating characteristic curve (ROC) was used to analyze the diagnostic performance of single serological marker and GALAD model for HCC. The evaluation value of GALAD model in the surgical prognosis of HCC patients was analyzed.Results The area under ROC curve (AUC) of GALAD model was 0.958, higher than that of single serological marker and combined detection, the difference was statistically significant ( P<0.05). When the cutoff value was 2.75, the sensitivity, specificity and accuracy were 81.6%, 93.6% and 89.3% respectively. Kaplan-Meier survival curve analysis showed that the 3-year survival rate and median survival time of patients with high GALAD level were 23.8% and 28.03 months, distinctly lower than that of patients with low GALAD level, the 3-year survival rate and median survival time for the latter were 49.8% and 36.38 months ( χ2=12.022, P=0.001). And the 3-year progression-free survival rate and median survival time of patients with high GALAD level were 7.2% and 20.70 months, distinctly lower than that of patients with low GALAD level, the 3-year progression-free survival rate and median survival time for the latter were 46.0% and 30.32 months ( χ2=9.810, P=0.002).Conclusions GALAD model has better diagnostic performance than AFP, AFP-L3, DCP and combined detection in HCC, and has certain value in evaluating the surgical prognosis.
肝细胞癌(hepatocellular carcinoma, HCC)是消化系统常见的恶性肿瘤之一, 其发病率在各类肿瘤中居第5位, 病死率居第2位[1]。HCC病情进展迅速, 恶性程度高, 治疗困难且疗效不佳, 采用便捷、客观的血清标志物对HCC进行早期诊断是保证HCC患者得到及时有效治疗, 改善其生存预后的关键。GALAD模型是2014年Johnson等[2]联合甲胎蛋白(alpha fetoprotein, AFP)、甲胎蛋白异质体L3(alpha fetoprotein variants AFP-L3)、异常凝血酶原(des-γ -carboxy prothrombin, DCP)以及患者年龄、性别多项因素创立的一种HCC诊断模型, 经后来多项研究证实GALAD模型在西方人群的肝癌及早期肝癌诊断中具有非常高的特异性和敏感性[3, 4], 但其在中国人群中诊断效能尚不明确, 且对HCC患者生存预后的评估价值国内外未见相关报道。本研究拟通过探讨GALAD模型在HCC中的诊断以及对患者生存预后的评估价值, 为HCC的临床诊断、预后评估提供参考依据。
选取2016年11月至2019年11月在海南省肿瘤医院接受根治性手术治疗的HCC患者98例为HCC组, 其中男68例, 女30例, 年龄36~75岁, 平均(48.6± 18.2)岁, 纳入标准:(1)术后病理证实为HCC; (2)术前未接受化疗或手术治疗; (3)依从性好, 自愿配合完成随访。选取同期在我院检查确诊的良性肝脏疾病(benign liver disease, BLD)患者87例为BLD组, 其中男45例, 女42例, 年龄30~69岁, 平均(50.2± 16.6)岁, 肝硬化40例, 慢性乙型病毒性肝炎47例, 诊断符合《肝硬化诊治指南》[5]或《病毒性肝炎防治方案》[6]中的诊断标准, 选取同期进行健康体检的健康者86例为对照组, 其中男48例, 女38例, 年龄35~70岁, 平均(46.1± 17.3)岁。以上三组研究对象均排除:(1)合并严重心、肺、肾功能障碍者; (2)合并其他肿瘤者; (3)正在使用维生素K或华法林治疗者; (4)合并自身免疫性疾病者。三组研究对象性别、年龄比较差异无统计学意义(P> 0.05)。三组研究对象均对本次研究知情同意, 并签署知情同意书, 本研究获海南省肿瘤医院伦理委员会审核并批准。
1.2.1 血清标志物检测
采集所有研究对象空腹静脉血4 mL(HCC组于手术前采血), 室温放置1 h, 4 000 r/min离心10 min, 分离血清进行检测。AFP采用电化学发光法检测, 仪器为罗氏E170电化学发光分析仪及其配套试剂; AFP-L3检测采用亲和离心吸附法, 分离纯化试剂盒购自北京热景生物技术有限公司; DCP检测采用酶化学发光法, 仪器为日本LUMI-PULSE G1200全自动免疫分析仪及其配套检测试剂。
依据相关文献[2], GALAD模型计算公式为:Z=-10.08+0.09× 年龄+1.67× 性别+2.34× log10(AFP)+0.04× AFP-L3%+1.33× log10(DCP)。其中男=1, 女=0, 当AFP< 10 ng/mL时AFP-L3水平不可测, 此时AFP-L3%定义为0。
1.2.2 术后随访
采用电话、门诊等方式对HCC组患者进行术后随访, 术后1年内每3个月随访1次, 随后每半年随访1次, 以肿瘤死亡为主要研究终点, 以疾病进展为次要研究终点, 疾病进展包括肿瘤复发或肿瘤转移, 随访截止至2020年8月, 以失访和随访结束仍无终点事件发生为截尾数据。
采用SPSS 22.0统计软件进行统计学分析, 计数资料以百分比表示, 组间比较采用χ 2检验。满足正态分布的计量资料以均数± 标准差(x ± s)表示, 多组间比较采用单因素方差分析, 不满足正态分布的计量资料采用中位数(四分位数间距)表示, 组间比较采用Kruskal-Wallis H检验, 两两比较采用Mann-Whitney U检验, 绘制相关检验指标的受试者工作特征曲线(receiver operating characteristic curve, ROC), 计算曲线下面积(area under curve, AUC), AUC比较采用Z检验, 生存分析采用Kaplan-Meier生存曲线法, 组间累积生存率比较采用Log-rank检验, P< 0.05为差异有统计学意义。灵敏度=真阳性例数/筛检人数× 100%, 特异度=真阴性例数/筛检人数× 100%, 准确度=(真阳性例数+真阴性例数)/筛检人数× 100%。
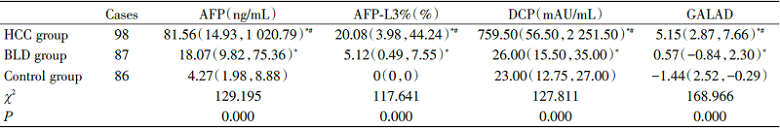
血清AFP、AFP-L3%、DCP水平及GALAD模型Z值在各组间的差异均具有统计学差异(P< 0.05), HCC组的血清AFP、AFP-L3%、DCP水平及GALAD模型Z值显著高于BLD组和对照组, 差异有统计学意义(P< 0.05), BLDs组的血清AFP、AFP-L3%、DCP水平及GALAD模型Z值显著高于对照组, 差异有统计学意义(P< 0.05), 见表1。
| 表1 三组受试者血清AFP、AFP-L3%、DCP水平及GALAD模型Z值比较 [M(P25, P75)] Tab.1 Comparison of serum AFP, AFP-L3%, DCP and GALAD model in three groups [M(P25, P75)] |
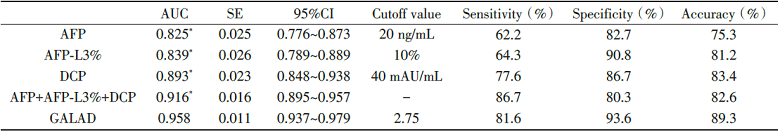
以HCC组患者为阳性样本, 以BLD组和对照组为阴性样本建立ROC曲线, 结果显示AFP、AFP-L3%、DCP、三项联合及GALAD模型诊断HCC的AUC分别为0.825、0.839、0.893、0.916、0.958, GALAD模型AUC明显高于AFP、AFP-L3%、DCP及三项联合, 差异有统计学意义(P< 0.05), GALAD模型的截断值由Youden’ s指数计算为2.75, AFP、AFP-L3%、DCP截断值采用临床标准, 分别为20 ng/ml, 10%, 40 mAU/ml, GALAD模型诊断HCC的灵敏度为81.6%, 特异度为93.6%, 准确度为89.3%, 其中特异度和准确度高于AFP、AFP-L3%、DCP单项及三项联合检测, 见图1, 表2。
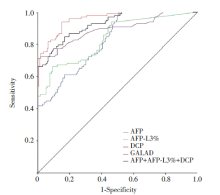 | 图1 AFP、AFP-L3%、DCP和GALAD模型诊断HCC的ROC曲线Fig.1 ROC curve of AFP, AFP-L3%, DCP and GALAD model in diagnosis of HCC |
| 表2 AFP、AFP-L3%、DCP和GALAD模型诊断HCC的ROC曲线结果 Tab.2 ROC curve analysis results of AFP, AFP-L3%, DCP and GALAD model in diagnosis of HCC |
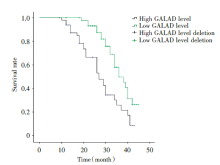
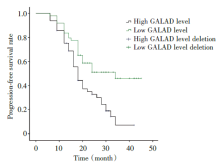
截至2020年8月HCC组患者共94例完成随访, 失访4例, 失访率4.1%, 随访时间为9~45个月, 完成随访患者中有54例患者因肿瘤死亡, 62例患者发生疾病进展。以术前HCC组患者GALAD模型Z值的中位数为分界值, 将HCC组患者分为GALAD模型高水平组49例和GALAD模型低水平组49例, 经Kaplan-Meier生存分析显示, GALAD模型高水平组3年累积生存率为23.8%, 中位生存时间为28.03个月, 低于GALAD模型低水平组的49.8%和36.38个月, 差异有统计学意义(χ 2=12.022, P=0.001), GALAD模型高水平组3年累积无进展生存率为7.2%, 中位无进展生存时间为20.70个月, 低于GALAD模型低水平组的46.0%和30.32个月, 差异有统计学意义(χ 2=9.810, P=0.002), 见图2、3。
AFP联合影像学检查是目前临床诊断HCC的主要方法, 但AFP单独诊断HCC的敏感度较低, 近年来关于AFP的争论越来越多, 有研究显示高达40%的HCC患者AFP水平可正常[7], 本研究中AFP的敏感度也仅为62.2%。而影像学检查的效率又较低, 难以满足对HCC高危人群进行筛查的需求, 因此探讨简便、高效的HCC筛查指标成为近年来的研究热点。《中国原发性肝癌诊疗规范》中将AFP-L3和DCP作为HCC诊断的血清标志物, 其中AFP-L3是肝癌细胞特异性分泌的一种糖蛋白, 对小扁豆凝集素具有很高的亲和力, 诊断HCC的特异性较高[8, 9], DCP是由于肝癌细胞对维生素K摄取及利用障碍, γ -谷氨酰羧化酶活性降低, 凝血酶原合成过程中凝血酶原前体未完全羧化所形成的异常产物, 与肿瘤生长和微血管侵犯显著相关[10]。但本研究结果显示AFP-L3%与DCP单独诊断HCC的敏感度分别为64.3%、77.6%, 仍难以满足临床对HCC的筛查的要求。
GALAD模型将AFP、AFP-L3%、DCP三项血清标志物和患者年龄、性别联合, 使各项指标互为补充, 彼此间取长补短, 显著提高了HCC的诊断效能。Roberts等[11]研究显示在西方人群中GALAD模型诊断HCC的AUC高达0.976, 敏感度、特异度达85.6%、93.3%。但西方HCC人群以酒精性肝病相关的肝细胞癌为主, 而中国人群以HBV/HCV感染相关的肝细胞癌为主, GALAD模型是否同样适用于中国人群尚需要进一步研究证实。本研究结果显示, GALAD模型诊断HCC的AUC为0.958, 高于AFP、AFP-L3%、DCP单项和三项联合检测, 当GALAD模型截断值为2.75时, 其诊断HCC的敏感度为81.6%, 特异度为93.6%, 证实在以HBV/HCV感染为主的中国HCC人群中GALAD模型同样具有较高的诊断效能。GALAD模型仅需要检验血清学指标, 操作简便, 适用于对高危人群进行大范围筛查, 以早期诊断HCC, 进而提高临床治疗HCC的效果, 改善患者的生存预后。
HCC患者手术预后受肿瘤大小、肿瘤分期、血管浸润程度、患者年龄等多种因素共同影响[12], 以往研究显示DCP不仅可以作为诊断HCC的血清标志物, 还可以在一定程度上反映肿瘤恶性程度和肿瘤血管浸润程度, 血清AFP和AFP-L3%水平的变化常被临床医生用作判断HCC复发的指标, GALAD模型综合了上述血清指标和患者年龄, 理论上可以评估HCC患者的临床预后, 本研究结果显示GALAD模型高水平组患者3年累积生存率和累积无进展生存率分别为23.8%和7.2%, 低于GALAD模型低水平组患者的49.8%和46.0%, GALAD模型高水平组患者中位生存时间和中位无进展生存时间也短于GALAD模型低水平组。说明术前GALAD模型水平可能与HCC患者手术后总生存期和无进展生存期存在一定相关性, 可成为HCC患者手术预后评估的有效指标。
综上所述, GALAD模型在中国人群HCC的诊断中显示出较好的诊断效能, 优于AFP、AFP-L3%、DCP单项和三项联合检测, 同时对HCC患者手术预后具有一定的评估价值。由于本研究为单中心研究, 研究样本量有限, 且均为住院患者, 存在一定选择性偏倚, 故本研究结论有待多中心、大样本随机对照研究予以证实。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|