作者简介:
黄仲(1983- ),男,广东河源人,主治医师,医学硕士,主要研究方向是肺癌的基础与临床转化研究。
目的 研究长链非编码RNA(long non-coding RNA,lncRNA)LINC01515对非小细胞肺腺癌细胞增殖、凋亡的影响。方法 采用 qRT-PCR法检测4株非小细胞肺腺癌细胞和1株正常支气管上皮细胞LINC01515的表达水平,选择LINC01515表达水平最高的H1975和H838两株细胞进行后续实验。将siLINC01515转染细胞后,qRT-PCR检测转染效率,并用WST法检测各细胞增殖活力,流式细胞术检测细胞凋亡,蛋白质免疫印迹(western blot,WB)法检测细胞中Ki67、p21表达水平。结果 在H1975、PC-9、H838、H1650和HBE五种细胞系中,H1975和H838细胞LINC01515表达水平最高。与对照组比较,siLINC01515组细胞增殖活力显著降低( P<0.01)、凋亡期细胞比例显著升高( P<0.01),Ki67表达水平显著降低,p21表达水平显著升高(均 P<0.01)。结论 敲低LINC01515通过抑制细胞增殖相关蛋白及促进凋亡相关蛋白的表达,进而影响非小细胞肺腺癌细胞的增殖和凋亡。
Objective To study the effects of long non-coding RNA (lncRNA) LINC01515 on the proliferation and apoptosis of non-small cell lung adenocarcinoma cells.Methods The expression levels of LINC01515 in 4 kinds of non-small cell lung adenocarcinoma cells and 1 kind of normal bronchial epithelial cell were detected by qRT-PCR, and the two cell lines with the highest expression levels, H1975 and H838, were selected for subsequent experiments. After transfecting the cells with siLINC01515, we detected the transfection efficiency by qRT-PCR, detected the proliferation activity of each cell lines by WST method, detected apoptosis by flow cytometry, and detected Ki67 and p21 expression levels in the cells by western blot.Results Among the 5 cell lines of H1975, PC-9, H838, H1650 and HBE, H1975 and H838 with the highest expression level of LINC01515 were selected as the research objects. Compared with the control group, the cell proliferation activity of the siLINC01515 group was significantly reduced ( P<0.01), the proportion of cells in the apoptotic phase was significantly increased ( P<0.01), the expression of Ki67 was significantly reduced, and the expression of p21 was significantly increased (both P<0.01).Conclusions Knockdown of LINC01515 could suppress the proliferation-related protein expression and promote the apoptosis-related protein expression, thereby affecting the proliferation and apoptosis of non-small cell lung adenocarcinoma cells。
肺癌是发生率及死亡率均高的恶性肿瘤之一, 每年有1 400万以上的新病例和800万以上的死亡数[1]。肺癌的发生率预计在不久的将来会进一步增加[2]。在中国, 肺癌仍然是最常见的癌症和与癌症相关的死亡率的主要原因[3]。除非大大减少中国的空气污染, 否则这种情况不会改变[4]。在过去几十年中, 早期肺癌患者的生存率已得到显著改善[5]。但是, 一旦发生转移, 其治疗效果将变得非常差[6]。目前, 早期诊断和治疗仍然至关重要, 对肺癌有效治疗方案的研发是迫切需要的。
长链非编码RNA(long non-coding RNA, lncRNA)曾被认为是基因组中没有功能的部分, 但近年来越来越多的研究数据证实, lncRNA在肺癌的诊断和治疗中发挥着重要的作用, 我们前期在数据库中发现LINC01515在肺腺癌组织比正常组织高表达, 可是目前尚未有关于LINC01515在肺腺癌中的分子功能及其机制的研究。本研究采用分子技术检测肺腺癌细胞中LINC01515的表达水平, 观察其对细胞增殖及凋亡的影响, 明确LINC01515的表达对肺腺癌细胞的作用。
肺腺癌细胞株 (PC-9, H1975, H1650、H838)和正常支气管上皮细胞株HBE均来自ATCC细胞库。其中PC-9是肺腺癌突变细胞株, H1975是肺腺癌T790M耐药的细胞株, H1650和H838是肺腺癌没有突变和耐药的细胞株。所有的细胞株均用含有10%的牛胎血清(Gibco公司)的RPMI 1640培养液(Hyclone公司), 并放入37℃含有5% CO2的细胞培养箱培养。实验中使用过的试剂为MEM培养基、胎牛血清(Gibco公司), RPMI 1640培养基(Hyclone公司), RNA提取试剂TRIzol(Ambion公司), 逆转录试剂盒(TaKaRa公司), SYBR Green qPCR试剂盒(KAPA Biosystems公司), 转染试剂Lipofectamine® TM2000(Invitrogen公司), 细胞凋亡检测试剂盒(BD公司), 兔抗Ki67抗体及p21抗体(Cell Signaling technology公司), PVDF膜、化学发光试剂(Merck Millipore公司)。
1.2.1 siRNA介导的敲低
将细胞以所需浓度接种, 并在接种后2~24 h用靶向siRNA寡核苷酸或非靶向对照转染, 终浓度为10 nM。根据制造商的说明书, 使用Lipofectamine® RNAiMax Reagent(Invitrogen公司)在 OptiMEM培养基(Gibco公司)中进行敲减。通过 qRT-PCR 确定干扰效率。所有siRNA均购自Dharmacon。
1.2.2 总RNA的提取和反转录
根据制造商的说明, 使用RNA提取试剂TRIzol从组织或培养的细胞中分离总RNA。使用逆转录试剂盒, 在标准条件下使用随机引物将1 μ g总RNA用于20 μ L终体积的逆转录反应。根据制造商的说明书, 使用SYBR Green qPCR试剂盒, 将1 μ L相应的cDNA用于随后qRT-PCR反应。GAPDH作为内参基因。PCR扩增在StepOne实时PCR系统上进行40个循环, 每个循环95 ℃变性15 s和60 ℃退火和延伸60 s。每个实验重复3次, 并使用比较循环阈值(Ct)方法分析数据。
1.2.3 WST-1法检测细胞增殖
将细胞以每孔1 000个的密度接种到96孔板上。在接种后24 h和48 h时加入LINC01515 siRNA和对照siRNA。根据制造商的说明书, 使用WST-1试剂(Roche, Mannheim, Germany)在siRNA转染后96~120 h测量细胞增殖。每个实验重复3次。
1.2.4 流式细胞术检测细胞凋亡
用不含EDTA的胰酶消化收集贴壁细胞, 用PBS洗涤细胞2次(2 000 rpm离心5 min)并收集1~5× 105个细胞; 加入500 μ L的binding buffer悬浮细胞; 加入5 μ L Annexin V-EGFP混匀后, 加入5 μ L propidium iodide混匀; 室温避光反应5~15 min; 在1 h内进行荧光显微镜或流式细胞仪的观察和检测。每个实验重复3次。
1.2.5 Western blot法检测蛋白表达
收集细胞, 提取总蛋白, 用BCA法测定蛋白浓度。每组细胞样本取40 μ g蛋白, 进行15% tricine-SDS-PAGE 凝胶电泳分离; 然后湿法将蛋白转至PVDF膜上, 用5%脱脂牛奶封闭, 一抗4℃孵育过夜, 二抗室温孵育1.5 h, 用ECL化学发光液进行显影。
采用SPSS 19.0软件进行统计学分析。计量资料以均数 ± 标准差(x ± s)表示, 计数资料采用构成比(%)表示, 100对配对的非小细胞肺腺癌和癌旁组织比较采用两配对样本t检验, 采用Kaplan-Meier法计算生存函数, 差异比较采用log-rank检验。P< 0.05视为差异具有统计学意义。
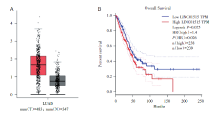
为了了解LINC01515在肺腺癌组织中的表达情况, 我们通过TCGA数据库[7]查询LINC01515在肺腺癌组织与正常肺组织之间RNA的表达差异。结果表明, LINC01515在肺腺癌组织中表达水平高于癌旁组织(见图1A)。同时分析其与生存预后的关系, 我们发现高表达LINC01515的患者预后更差(P=0.025)(见图1B)。
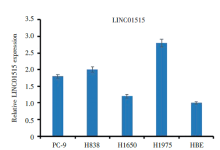
qRT-PCR 法检测肺腺癌PC-9、H1975、H838、H1650和正常细胞株HBE 细胞中LINC01515的表达水平, 结果(图2)显示, H1975和H838细胞LINC01515表达水平明显高于HBE细胞(P< 0.01)。因此, 选择LINC01515表达水平最高的H1975和H838细胞作为后续实验的研究对象。
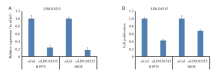
将干扰LINC01515表达的siRNA转染H1975和H838细胞96 h后, 检测细胞中LINC01515表达水平, qRT-PCR检测结果(图3A)显示, 与siCtrl对照组比较, siLINC01515组LINC01515的表达水平显著降低(P< 0.01)。故选择该靶序列进行后续实验。WST法检测结果(图3B)显示, 与对照组相比, LINC01515干扰组细胞活性显著减低, 增殖能力明显减弱(P< 0.01)。
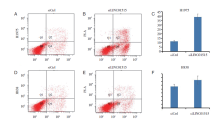
流式细胞术检测结果(图4)显示, 与对照组相比, H1975和H838细胞中LINC01515干扰组Q2和Q4象限内凋亡细胞数明显增加(P< 0.01), 说明敲低LINC01515表达会促进细胞凋亡。
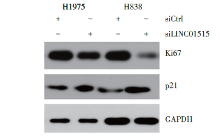
我们发现敲低LINC01515会抑制肺腺癌细胞增殖并促进细胞凋亡, 接着我们考虑这是否与增殖相关蛋白Ki67和凋亡相关蛋白p21有关。我们采取WB法检测了H1975和H838细胞中增殖相关蛋白Ki67和凋亡相关蛋白p21的表达水平, 结果(图5)显示, 与对照组相比, LINC01515干扰组细胞中Ki67相对表达量均显著降低, p21蛋白相对表达量均显著升高, 表明敲低LINC01515能抑制增殖相关蛋白Ki67的表达和促进凋亡相关蛋白p21的表达, 可能进而抑制细胞增殖及促进细胞凋亡(P< 0.01)。
非小细胞肺癌(non-small cell lung cancer, NSCLC)是世界上最常见的致死性疾病之一。 NSCLC的不良预后与肿瘤转移的发生密切相关[8]。因此, 找到用于NSCLC的诊断、预后和治疗的新分子靶标有可能提供新的治疗策略, 从而改善临床获益[9]。最近, 越来越多的证据表明, lncRNA在不同类型癌症的发展中可能起关键性的调节作用[10, 11, 12]。
在本项研究中, 我们通过数据库首先经过分析发现LINC01515在肺腺癌组织高表达, 及其与生存预后密切相关, 提示LINC01515与肺癌存在密切关系, 可能是一种潜在的新的癌症标志物。此外, 敲低LINC01515的表达会抑制肺癌细胞的细胞活力, 并促进细胞凋亡的发生。这表明LINC01515与肺腺癌细胞的增殖与凋亡有关。
细胞增殖是肿瘤发生发展的重要环节之一, 癌细胞实现了永久复制, 缺乏正常的生长控制[13]。Ki67是一种肿瘤细胞增殖标志物, 其表达水平反映了细胞的增殖活性, 与肿瘤的恶性程度紧密相关, 具有一定的临床肿瘤诊断和预后价值。已有研究者发现p21在多种人类癌症中过表达, 包括乳腺癌, 宫颈癌, 前列腺癌, 肾癌和睾丸癌[14]。p21作为细胞周期负性调控因子, 与细胞凋亡密切相关。一方面, p21能在DNA损伤时使生长周期停滞, 在DNA修复时保护细胞免受凋亡; 另一方面, 许多报道指出, p21在某些条件下具有促进细胞凋亡的作用。例如, 古曲霉素 A在诱导破骨细胞凋亡的过程中是通过上调p21来实现的。本研究经蛋白实验验证发现LINC01515通过Ki67与p21蛋白促进肺癌细胞增殖与抑制凋亡发生[15]。这些发现表明LINC01515在肺腺癌进展中起作用, 提供了我们新的研究方向和治疗选择。
总而言之, 我们研究的结果表明, LINC01515在肺腺癌组织高表达, 及其与生存预后密切相关; LINC01515表达下调会抑制肺癌细胞的增殖与生存能力, 促进细胞凋亡。因此, LINC01515可能成为肺癌的有希望的治疗靶标和新型分子生物标志物。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|