作者简介:
赖晓嵘(1971-),女,江西寻邬人,副主任医师,医学博士,主要研究方向消化道肿瘤的诊断和治疗。
[编者按]疾病的正确诊断和合理治疗是患者和医务工作者共同的心愿。在广东省人民医院肿瘤中心, 吴一龙教授指导临床医生应用循证医学理论进行肿瘤的多学科综合治疗, 开展临床病例讨论。讨论会上各学科共同围绕一个病例或一个病种进行会诊, 临床、病理、B超、放射影像等资料齐全, 除相关科室提前准备的中心性发言外, 到会人员各抒己见, 气氛热烈。参会人员受益匪浅, 提高了对疑难病例的诊治水平。为了将他们的诊治经验传播出去, 让更多的临床医生获益, 我刊开辟“ 循证病例讨论” 栏目, 希望广大医务工作者关注此栏目。
患者女性, 47岁, 因“ 发现腹部包块2周” 于2019-06-12入住我科。患者于2019年5月发现腹部包块, 伴不规则腹痛, 2019-06-03到我院做B超检查提示右侧腹腔异常回声(肠套叠?肠道肿瘤待排), 以腹部包块查因收入院。既往史:2018-06-30因“ 右乳肿物” 于广东省人民医院行右乳单纯切除术+右乳假体置入术+左乳缩乳术。病理:交界性叶状肿瘤。2019-03-19因“ 子宫肌瘤” 于广州市妇女儿童医疗中心行全子宫切除术+双侧附件切除术+盆腔松解术, 术后病理:部分内膜镜下呈复杂不典型增生, 局部见高分化子宫内膜样癌, 浸润浅肌层, FIGO分期Ⅰ A期。家族史:父亲患结肠癌, 母亲患卵巢癌, 患者哥哥无癌症病史, 儿子无消化道症状, 其他不详。
体格检查:生命体征平稳, PS评分1分。全身浅表淋巴结未触及, 头面部无水肿, Horner征阴性, 上腔静脉综合征阴性。皮肤黏膜无黄染, 无皮下出血点, 无肝掌、蜘蛛痣。右上腹部轻度压痛, 无反跳痛, 右中下腹部扪及一巨大包块, 大小约8× 10 cm, 质地韧, 边界不清, 无压痛, 活动差, 肝、脾无肿大, 腹部平坦, 移动性浊音阴性。神经系统检查无异常。
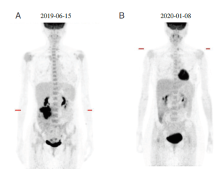
入院后辅助检查:2019-06-15行PET/CT示:(1)右半结肠肠壁增厚并肿块形成, 糖代谢增高, 考虑结肠癌; 侵犯肠壁全层, 向背侧侵犯形成右肾前脊柱旁肿块, 累及结肠肿块周围淋巴结, 肿块高代谢。左侧盆腔内高代谢小淋巴结, 考虑转移性淋巴结。盆底直肠周围见数个稍高代谢灶, 相应部位未见确切结节/肿块及肠壁异常, 建议术中探查, 以除外脱落种植肿瘤灶。(2)子宫内膜癌术后:未见术区确切复发征象。(3)右侧乳腺肿瘤术后, 未见确切复发征象。(4)18F-FDG-PET/CT体部扫描未见恶性肿瘤代谢影像。(5)甲状腺多发结节灶, 糖代谢未见增高, 考虑结节性甲状腺肿。(6)双肺上叶磨玻璃结节, 糖代谢未见增高, 建议随访。(7)肝脏多发囊肿。(8)脑形态、结构及脑功能代谢未见异常。见图1A。
2020-01-05复查PET/CT:(1)“ 结肠癌治疗后” , 与2019-06-15我院PET/CT比较:右半结肠病变较前明显缩小, 代谢减低; 原腹腔转移灶现未见明确显示。(2)子宫内膜癌术后:未见术区确切复发征象。(3)右侧乳腺肿瘤术后:未见确切复发征象。(4)甲状腺多发结节, 其中左叶结节糖代谢增高, 建议超声检查。(5)18F-FDG-PET/CT体部扫描其余部位未见恶性肿瘤代谢影像。(6)双侧颈部Ⅱ 区炎性淋巴结。(7)双肺上叶磨玻璃结节, 糖代谢未见增高, 所见大致同前。(8)肝脏多发囊肿。(9)盲肠局部糖代谢增高, 考虑生理性显影或炎性改变。(10)脑形态、结构及脑功能代谢未见异常。见图1B。
血常规及肝肾功能检验:血红蛋白:92 g/L, 白蛋白:24.00 g/L, 肾功能正常。肿瘤指标:CA19-9 6.56 U/mL; CA72-4 9.86 U/mL; CEA 4.06 ng/mL。
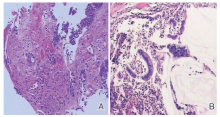
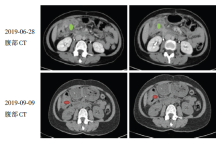
治疗过程:患者于2019-06-19行肠镜检查:距肛门50 cm约横结肠处, 见一环腔浸润性肿物, 表面覆污物, 无法窥视全貌, 触之质硬, 活检质脆, 易出血, 因肿物堵塞管腔, 未能继续进镜。治疗前活检病理诊断:结合免疫组化结果, 考虑肠道原发的腺癌(图2A), MLH1(+), MSH2(-), MSH6(-)和PMS2(+)。进一步行基因检测, 证实MSI三个位点BAT-26, BAT-25, D2S123的重复序列发生重复次数的变异, MSH2 c.1457_1460del, 基因第九号外显子的1457-1460位置发生4个碱基的缺失突变。经肠镜和PET/CT检查诊断横结肠腺癌cT4bN2M0, Ⅲ C期, 微卫星高度不稳定性(microsatellite instability-high, MSI-H), Lynch综合征。2019-07-15至2019-12-09予程序性死亡受体1(programmed death 1, PD-1)卡瑞利珠单抗200 mg q3w治疗6周期, 同期行XELOX方案化疗6周期:奥沙利铂150 mg d1+卡培他滨1 000 mg bid d1~14, 2、4周期复查增强CT评价疗效为部分缓解(partial response, PR)(图3), 4周期后出现多处反应性血管瘤, 6周期PET/CT检查提示右半结肠病变较前明显缩小, 代谢减低; 原腹腔转移灶现未见明确显示(图1B)。复查肠镜见横结肠距肛门约52 cm处可见一不规则肿物环腔生长, 肠腔狭窄, 镜身勉强通过。提示肿瘤明显退缩, 疗效继续PR, 外科评估拟行手术, 因新冠病毒疫情建议延期手术, 2020-02-18予第7周期卡瑞利珠单抗+XELOX方案化疗。2020-04-03全腹CT示右中腹部结肠肝曲增厚较前缩小, 于2020-04-09行腹腔镜肠粘连松解术+右半结肠切除术, 术后病理:(升结肠)大肠肿瘤新辅助化疗后, 局部可见大片粘液湖残留, 粘膜下层可见小灶坏死、钙化及异物巨细胞吞噬, 未见明确肿瘤残留。未见明确脉管癌栓及神经束侵犯; 两端外科切缘均未见癌; “ 阑尾” 、“ 大网膜” 未见癌; 淋巴结未见癌转移(共0/14, 其中小肠系膜淋巴结, 0/4; 大肠系膜淋巴结, 0/8; “ 252组淋巴结” 为纤维脂肪组织; “ 253组淋巴结” 0/1; “ 第6组淋巴结” 为纤维脂肪组织; 大网膜内扪及淋巴结, 0/1)(图2B)。患者恢复好, 综合患者治疗经过建议PD-1维持治疗, 患者因自身经济原因未能继续卡瑞利珠单抗治疗, 慎重考虑后选择信迪利单抗治疗, 2020-06-01至2020-07-13予以第1~3周期信迪利单抗单药治疗 200 mg q3w, 过程顺利。近来患者无腹痛腹泻, 无咳嗽, 无胸痛, 无吞咽困难, 小便正常, 近期体重增加2 kg。
赖晓嵘(肿瘤内科医师):汇报病史特点:中年女性患者, 因“ 发现腹腔包块进行性增大2周” 入院。既往有右乳单纯切除术[导管上皮不典型增生(atypical ductual hyperplasia, ADH)]和全子宫切除术+双侧附件切除术+盆腔松解术(FIGO分期Ⅰ A期), 有肿瘤家族史。横结肠肿瘤DNA错配修复蛋白表达缺失(deficient mismatch repair, dMMR)(MSH6和MSH2), 经DNA错配修复基因检测和林奇综合征筛查诊断为MSH2 c.1457_1460del, 林奇综合征, MSI-H, 横结肠腺癌, cT4bN2M0, Ⅲ C期[1, 2]。先后行7周期卡瑞利珠单抗+XELOX方案化疗, 复查PET/CT和肠镜等提示结肠肝曲增厚明显缩小, 2020-04-09行右半结肠切除术, 术后病理提示病理学完全缓解(pathological complete response, pCR)。术后予以PD-1单抗维持治疗。提出讨论要点:(1)患者为林奇综合征, MSI-H的结肠癌晚期的治疗方案选择是化疗?还是单纯免疫治疗?还是化疗联合免疫治疗?(2)对于晚期结肠癌MSI-H患者, 原发病灶切除根治性手术后选择什么治疗方案, 治疗持续时间如何确定?(3)术后CT报告上的肝/脾可疑病灶如何考虑?如何处理这些病灶?
旁述:局部进展期直肠癌5-FU为基础的新辅助放化疗病理完全缓解率大约15%, 最多达38%, 已有多项临床研究均未能改善无病生存率(disease-free survival, DFS)。Ⅲ C期结肠癌目前的治疗疗效是化疗有效率约50%~70%, MOSAIC试验报道术后辅助化疗的五年DFS是58.9%~66.4%。来自美国国家癌症研究所的SEER数据中心, 其中包括2004年至2010年间被诊断患有结肠癌的人, Ⅲ A期结肠癌的相对5年生存率约为89%。对于Ⅲ B期的癌症, 存活率约为69%; 而对于Ⅲ C期的癌症, 其存活率约为53%, 效果不尽满意。鉴于免疫治疗在转移性结直肠癌(metastatic colorectal cancer, mCRC)免疫治疗迎来突破性进展[客观缓解率(objective response rate, ORR)和疾病控制率分别为62%和92%], 2017年NCCN指南首次推荐帕博丽珠单抗和纳武利尤单抗在dMMR/MSI-H的mCRC末线治疗, 并且, 逐步开始向前推, 已在结肠癌的一线治疗中取得阳性结果[3]。
吴一龙(肿瘤学教授):2017年NCCN指南推荐帕博丽珠单抗和纳武利尤单抗在dMMR/MSI-H的mCRC末线治疗, 肯定了免疫治疗在MSI-H结肠癌的有效性, 就是该病例选择免疫治疗的理由。2019年在MSI-H的晚期结肠癌患者新辅助治疗中还没有使用化疗联合免疫治疗的报道, 那尽可能寻找做这个联合治疗方案的理由, 比如结合化疗的理由有哪一些?可以参考和比较以往Ⅲ C期结肠癌化疗的疗效。另外, 根治性手术切除后的中位复发时间也可以给我们提示术后免疫单药巩固治疗的时间。
旁述:在结直肠癌领域, 从末线到一线再到新辅助治疗的研究均证实, 免疫治疗对MSI-H人群具有良好的疗效, 而对于微卫星稳定(microsatellite stability, MSS)的人群则疗效不佳。概述以下结直肠癌的免疫治疗成果, 末线治疗的研究:KEYNOTE-164[4]和KEYNOTE-158[5]研究证实, 帕博利珠单抗用于经治的晚期MSI-H CRC患者带来33%的ORR, 且有长期生存获益。CheckMate 142[6]研究发现, 多线治疗失败后的dMMR/MSI-H晚期结直肠癌患者接受纳武单抗治疗的研究结果, ORR可达到31.1%, 达到客观缓解的患者有34.8%持续缓解时间超过12个月。一线研究的数据:最新2020年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)报道的KEYNOTE-177[7]研究, 评估了帕博利珠单抗对比标准治疗(化疗± 贝伐珠单抗或西妥昔单抗)一线治疗dMMR/MSI-H mCRC患者的疗效和安全性。中期分析的结果显示, 与对照组相比, 帕博利珠单抗作为一线治疗可显著提高dMMR/MSI-H mCRC患者无进展生存期(progression-free survival, PFS)[中位PFS为16.5个月vs. 8.2个月; 风险比(hazard ratio, HR)0.60; P=0.000 2], 总生存期(overall survival, OS)数据尚未成熟。两组的ORR分别为43.8%和33.1%。新辅助治疗的研究:2018年ASCO大会上报道的NICHE[8]研究, 对伊匹木单抗联合纳武利尤单抗用于早期结肠癌术前新辅助治疗的效果进行了评估。结果发现, 仅仅经过1个月的治疗[1次伊匹木单抗治疗(d1), 2次纳武利尤单抗治疗(d1+d15)], 100%的dMMR肿瘤得到了明显缓解, 部分患者的明显肿瘤残存可降到0%, 而错配修复蛋白表达完整(proficient mismatch repair, pMMR)患者则几乎没有出现缓解。此外免疫治疗用于结肠癌的辅助治疗进行探索的ATOMIC研究以及靶向+化疗、免疫单药、免疫+靶向+化疗的疗效进行对比的COMMIT研究正在进行中, 结果将会更加准确的指导结直肠癌的临床实践。
马冬(肿瘤内科主任医师):目前国内外权威指南一致推荐PD-1抑制剂用于MSI-H晚期结直肠癌的治疗, 建议PD-1抑制剂应作为dMMR/MSI-H mCRC的一线标准治疗方案, 在某些特殊情况下, 如果治疗目标是快速控制高肿瘤负荷, 化疗± 靶向治疗应为首选方案, 如果治疗目标是转化为可切除状态, 抗PD-1治疗应为首选治疗方案。本病例发病特征及基因型符合Lynch综合征, 基因型为MSI-H型, 因考虑到患者的治疗目标需要同时兼顾到快速缩瘤以及转化为可切除状态, 因此采用了免疫联合标准化疗的方案, 和上述的结直肠癌免疫治疗专家共识有异曲同工之妙。Ⅲ 期结肠癌化疗的有效率在50%~70%, 对局部进展期和晚期结肠癌的化疗疗效肯定。因此, 在免疫治疗的基础上联合化疗, 可以尽可能缩小肿瘤, 达到根治性切除的目的。根治术后可疑肝脾病灶的后续处理, 我们选择动态观察, 若继续增大考虑局部介入处理[9, 10]。
谢淑飞(影像科副主任医师):患者术前PET/CT提示横结肠肿瘤高代谢, 并侵犯十二指肠, 治疗2/4周期复查CT可见肿瘤明显缩小。手术后发现肝/脾的病灶, 反复对比患者治疗前和治疗过程中的病灶, 发现肝转移基本可排除, 脾的病灶转移还不能排除, 可继续观察。
杨学宁(肺科主任医师):患者分子检测有3个结果, 那排除KRAS, Lynch综合征, 重点考虑MSI-H的Ⅲ C期结肠癌, 既往有的临床试验/或个案报道, 都可以给我们的治疗方案提供一些线索。
陈晓明(介入科主任医师):患者治疗后肿瘤明显缩小, 见大片坏死, 不增加手术难度, 在无出血/穿孔需要紧急手术的条件下不影响手术时机的把握。
吴一龙:总结上述观点, 一个罕见位点突变的Lynch综合征, MSI-H, 横结肠腺癌, cT4bN2M0, Ⅲ C期, 经过免疫治疗和化疗的联合新辅助治疗取得了肿瘤明显退缩, 根治性切除和pCR的结果。对这样的MSI-H的Ⅲ C期结肠癌化疗联合免疫治疗的方案, 需要在后续临床实践中在更多的病例中进行比较和验证, 包括根治术后免疫治疗的时间, 才能得到可靠的疗效和安全性的数据。
后记:患者于病例讨论后用PD-1单药规则维持治疗。因为自身经济原因选择信迪利单抗200 mg iv, 每月一次, 并规则复查, 末次复查时间是2020年12月, 评价病情稳定。没有显著的不良反应。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|