作者简介:
张菊花(1982-),女,海南东方人,理学学士,主管护师,主要研究方向为普通外科护理。
目的 探讨原发性肝癌伴门脉癌栓患者行局部治疗联合程序性死亡受体1(programmed death 1, PD-1)治疗不良反应的护理方法。方法 选取行PD-1联合局部治疗的原发性肝癌伴门脉癌栓患者68例,观察记录不良反应,并及时进行护理。结果 患者治疗后发生肝区疼痛20例,发热8例,纳差等消化道症状及疲乏45例,肝功能损害26例,间质性肺炎及神经毒性各1例。所有患者经处理均顺利恢复出院。结论 PD-1联合局部治疗后常见不良反应有肝区疼痛、发热、肝功损害、纳差等消化道症状及疲乏等。应提前采取有效措施,及时观察和处理,降低并发症发生率。
Objective To summarize nursing care for adverse reactions of programmed death 1(PD-1) inhibitor combined with locoregional therapy for the treatment of hepatocellular carcinoma patients with portal vein tumor thrombus(PVTT).Methods A total of 68 hepatocellular carcinoma patients with PVTT undergoing PD-1 inhibitor combined with locoregional therapy were enrolled. The adverse reactions were observed and nursing care was provided.Results Liver pain occurred in 20 patients, fever in 8 patients, fatigue and alimentary tract symptoms such as anorexia in 45 patients, liver function damage in 26 patients, interstitial pneumonia in 1 patients, nerve toxicity in 1 patients, all patients were discharged after recovery.Conclusions Liver pain, fever, fatigue and alimentary tract symptoms such as anorexia, liver function damage were common adverse reactions after PD-1 inhibitor combined with locoregional therapy, effective measures should be taken to reduce the occurrence of adverse reactions.
原发性肝癌合并门静脉癌栓(portal vein tumor thrombus, PVTT)治疗包括手术、经导管肝动脉化疗栓塞术(transcatheterarterial chemoembolization, TACE)、门脉支架、碘125粒子植入、微波消融、外放射、分子靶向治疗、支持治疗、多种介入手段及近年兴起的程序性死亡受体1(programmed death 1, PD-1)抑制剂等多种方法以及多学科综合治疗模式的开展。而无手术指征的原发性肝癌PVTT者主要治疗方法则为TACE联合粒子门脉支架、消融等局部治疗及靶向、PD-1以及支持治疗等多种治疗模式[1], 单一的治疗手段的效果尚不满意。目前关于TACE等局部治疗联合PD-1治疗原发性肝癌伴PVTT的不良反应的报道甚少, 尚没有相关循证医学研究, 本研究对TACE等局部治疗联合PD-1治疗原发性肝癌伴PVTT的不良反应68例患者进行了观察随访, 总结分析以上患者不良反应及护理报告资料, 现报道如下。
2018年1月至2019年12月于海南省东方市东方医院、海南省第三人民医院、海南省人民医院以及海南医学院第一附属医院收治符合病理或美国癌症联合会(AJCC)肝细胞癌TNM分期(第8版, 2017)为各期肝癌; 合并PVTT, Child-Pugh分级A~B级患者68例, ECOG评分0~1分, 预计生存时间≥ 3个月。排除标准:疑似非癌栓形成, 合并严重心肝肾功能不全, 出血倾向, ECOG评分体力状态极差, 化疗及免疫药物过敏者, 患者本人拒绝使用PD-1抑制剂和局部治疗等。
1.2.1 所有患者均行TACE:符合TACE适应证者, 局麻后穿刺右桡动脉, 植入动脉鞘, 用造影导管造影, 行数字减影血管造影(digital subtraction angiography, DSA)观察肿瘤位置和供血血管, 挑选进入肝左右动脉及癌肿供血动脉, 予肝动脉灌注化疗及栓塞治疗, 每例患者均用化疗药行肝动脉灌注化疗, 用超液化碘油栓塞, 复查DSA满意后, 治疗结束, 加压包扎后回病房。
1.2.2 超声引导下微波消融:32例患者接受超声引导下微波消融术, 微波消融术在局部麻醉下通过超声引导定位, 向瘤体内刺人微波消融针。确定微波消融的输出功率在40~60 w之间, 尽可能实现病灶的完全消融。
1.2.3 门脉粒子支架植入:36例患者接受门脉粒子支架植入术, 将制备好的粒子条置于支架与门静脉癌栓之间, 造影复查, 确认支架及粒子条位置满意后封堵穿刺道。
1.2.4 患者应用的PD-1免疫检查点抑制剂为帕博利珠单抗或纳武利尤单抗, PD-1配置好后经双人核对准确无误, 按医嘱及时给患者进行静脉输注。输液时间大于半小时。
观察患者局部治疗术后肝部疼痛(数字评分法)、发热、纳差、恶心、呕吐等不良反应发生情况,术后一天内,每6小时护士询问患者,记录每6小时内的不良反应,一天后护士每24小时询问不良反应情况并记录1次。患者PD-1免疫治疗结束后1周内,均行血象、肝肾功能及甲状腺功能等检查;PD-1治疗每2个周期进行胸部CT检查,每周期21天;每个周期治疗结束后于1周内进行电话随访,随访6个月,电话、住院或门诊询问患者治疗副反应情况。
采用SPSS 19.0软件统计, 一般资料均数以均数 ± 标准差表示, 定量资料行t检验, 定性资料行χ 2检验。P< 0.05具有统计学差异。
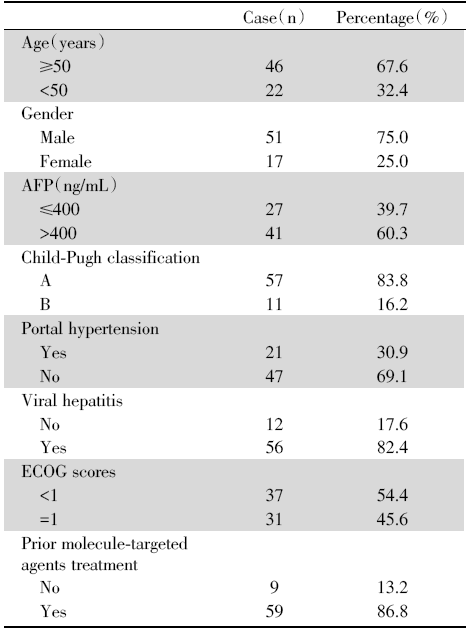
68例肝癌合并PVTT患者中, 男性51例, 女性17例; 年龄35.1~70.6岁, 平均年龄(56.1± 7.4)岁。Child-Pugh分级A级57例, B级11例; 合并病毒性肝炎56例, 既往有索拉非尼、仑伐替尼等靶向药物治疗史者9例, 详见表1。
| 表1 肝癌合并PVTT患者基线资料 Tab.1 Baseline characteristics of hepatocellular carcinoma patients with portal vein tumor thrombus |
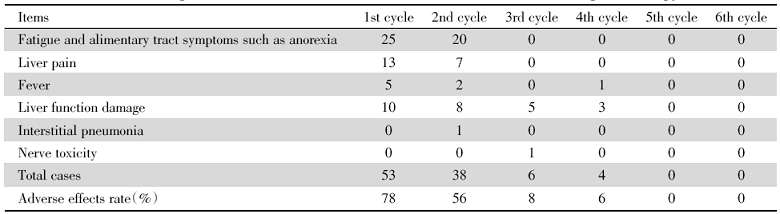
68例肝癌患者接受治疗期间, 所有患者均完成六周期PD-1治疗及1次以上的TACE术, 32例患者完成1次以上微波消融术, 其余36例患者完成1次门脉粒子支架植入。术后发生不良反应症状轻微, 均未发生3~4级不良反应。其中, 纳差等消化道症状及疲乏分布在术后2个周期内。与患者肝功能损害相关; 所有患者发生局部治疗联合PD-1治疗相关不良反应的时间是在前4个周期, 提示局部治疗联合PD-1治疗的相关不良反应出现在治疗前3个月内, 详见表2。
| 表2 肝癌合并PVTT患者行局部治疗联合PD-1治疗不良反应发生时间 (n) Tab.2 Occurring time of adverse reactions of PD-1 inhibitor combined with locoregional therapy (n) |
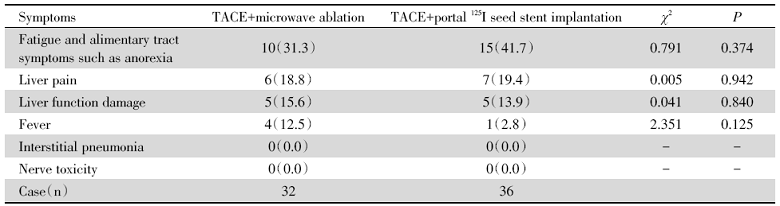
局部治疗方案联合PD-1治疗后一周期内, 患者不良反应发生率最高, 其中, 32例患者经TACE+微波消融术联合PD-1治疗后, 发生纳差等消化道症状及疲乏不良反应、肝部疼痛、肝功受损、发热分别为10、6、5、4例, 发生率为31.3%、18.8%、15.6%、12.5%, 36例患者经TACE+门脉粒子支架植入术联合PD-1治疗后, 发生纳差等消化道症状及疲乏不良反应、肝部疼痛、肝功受损、发热分别为16、7、5、1例, 发生率为41.7%、19.4%、13.9%、2.8%; 在治疗后一周期内未发生间质性肺炎及神经毒性。TACE+微波消融术联合PD-1治疗与TACE+门脉粒子支架植入术联合PD-1治疗组两组患者不良反应发生率差异均无统计学意义(P> 0.05)。不同局部治疗方案联合PD-1治疗后不良反应发生率比较见表3。
| 表3 不同局部治疗术后不良反应比较 [n(%)] Tab.3 Comparison of adverse reactions of patients between different locoreginal therapy [n(%)] |
所有患者均出现不同程度的纳差等消化道症状及疲乏, 与TACE化疗药灌注PD-1治疗及局部治疗有关[2, 3, 4]。健康宣教和积极的心理护理减轻患者的围治疗期产生的焦虑恐惧等负面情绪。保持病房环境清洁, 指导患者正确饮食及按时服药, 清淡饮食, 少食多餐, 减少胃肠道刺激。恶心呕吐者可及时予止吐药物干预。适度运动及开胃饮食, 提振患者食欲, 防止便秘和腹泻。放松训练、有氧运动、中医药以及心理干预等帮助解除患者疲乏感。护理的要点是做到保证患者安全, 且定期对症状随访以及护理指导。
TACE、微波消融穿刺等局部治疗方法均可以引起肝部疼痛[5], 故应积极控制疼痛。疼痛的程度与肿瘤的部位、范围, 穿刺部位等有关。应向患者解释疼痛的原因, 予以半卧位或右侧卧位, 如果出现疼痛逐渐加重, 应注意观察是否有出血及其他并发症, 疼痛严重时可给予止痛药物。可术前预防性口服阿片类控释药物镇痛。患者疼痛症状均有不同程度缓解。
应用PD-1、TACE术、微波消融等局部治疗均可能引起发热, PD-1治疗前, 进行宣教, 让患者及家属知晓探视陪伴制度; 输入PD-1严格控制滴速, 输液操作注意无菌操作, 防止交叉感染, 定时监测体温, 加强巡视[6]; 每次输入PD-1完毕, 留观一小时。TACE、微波治疗, 门脉粒子支架植入均可使肝癌组织坏死, 尤其粒子照射肿瘤后引起肿瘤组织坏死并被吸收机体吸收后可使体温上升, 患者发热一般在术后0.5~3天出现, 好发时间无规律性。体温37.5~39 ℃, 一般体温在38℃内, 无需特殊处理, 可嘱患者多饮水, 体温高于38.5℃则遵医嘱给予物理降温、酚麻美敏口服、复方氨林巴比妥或地塞米松静脉注射, 同时加强基础护理, 发热多在7天内缓解。但也有偶见TACE术后发热持续8周后缓解。发热程度、持续时间常与坏死范围有关, 坏死范围越大, 发热时间越长, 体温越高。出院前告知患者如术后定期行血常规、血液生化及腹部CT等检查。
原发性肝癌患者本身就存在不同程度的肝功能损伤或合并病毒性肝炎, 如PD-1引起的肝功能损害, 将与肝癌肝功能损害相互叠加, 肝功能损害程度较重。鉴于此, 美国国家综合肿瘤网络(National Comprehensive Cancer Network, NCCN)指南对纳武利尤单抗的应用限于肝功能Child-Pugh分级A~B级肝癌患者, 而对帕博利珠单抗或纳武利尤单抗的应用仅限于肝功能Child-Pugh分级A级患者[7]。护士遵医嘱给予还原型谷胱甘肽、异甘草酸镁、抗病毒等药物治疗, 免疫治疗, 同时进行保肝治疗宣教, 定期监测肝功能, 观察大小便情况, 嘱患者禁酒戒烟, 给予饮食指导避免营养不良发生。
1例患者在PD-1治疗期间出现间质性肺炎。经治疗缓解后继续PD-1治疗。发生间质性肺炎后遵循医嘱给予糖皮质激素治疗, 做好日常护理, 密切观察肺功能、胸部CT。必要时遵医嘱予雾化、拍背促痰咳出, 营养管理指导宣教。如患者病情需要, 则做好机械辅助通气护理准备[8]。做好定期肺不良反应评估以及用药前宣教, PD-1治疗期间要密切观察患者有无新发的气促、咳嗽、发热等症状, 预防并发感染, 护理操作均遵循无菌操作原则, 预防肺部PD-1免疫治疗相关不良反应的发生。
1例患者在PD-1治疗期间出现头痛, 应用PD-1联合各种局部治疗出现神经系统症状相当罕见[9]。排除颅脑器质性病变以及精神疾患后, 遵医嘱予观察及对症治疗后患者头痛症状缓解, 继续PD-1治疗。
做好患者及家属的门脉粒子支架植入术内放射治疗健康宣教, 术后几天避免家属看望, 限制探视人员和探视时间, 孕妇和儿童不能探视病人。放射性粒子门脉支架植入术后2周内, 病人家属探视时, 应该与病人保持2米以上的距离; 医护人员在进行查房或护理操作时, 应该穿铅制裙, 每次与病人沟通时保持1米以上的安全距离[10]。粒子植入后, 由于长期电离辐射作用, 少数患者可引起白细胞减少, 因此, 注意监测血象。嘱患者出院后定期复查血常规、血液肝肾功能, X线复查粒子位置。
不可切除门脉癌栓肝癌患者治疗主要为TACE联合粒子门脉支架、消融等局部治疗、包括靶向和免疫PD-1治疗在内的系统治疗及支持治疗等多种治疗模式[4]; 程序性死亡配体1(programmed death ligand 1, PD-L1)在肝癌细胞中普遍高表达, 尤其在索拉非尼耐药人肝癌细胞中高表达[11], 但是索拉非尼等多靶点靶向分子药物于PD-L1基因阳性肝癌患者总生存改善并不显著。PD-1抑制剂与多靶点靶向分子药物相比, PD-1抑制剂在肝癌患者中尤其PD-L1基因阳性患者显示出良好的安全性和临床意义上的OS改善, 以及在作为一线治疗中, 获得更高的完全缓解率, 取得令人鼓舞的疗效[12]。所以, 2020版原发性肝癌NCCN指南在系统治疗部分将PD-1抑制剂纳武利尤单抗和帕博利珠单抗作为2B类推荐[7]。免疫治疗价格高昂且使患者获益的同时也会引起一系列免疫相关不良反应(immune-related adverse reaction, irAE)[13], 大多数irAE较为轻微, 但也可能发生严重不良反应甚至致死。TACE+门脉粒子支架植入术或微波消融术联合PD-1免疫治疗, 局部治疗与免疫治疗这两类治疗发生的不良反应往往交错叠加, 医护人员虽难以辨别, 但经过积极的对症治疗也能够避免不良反应和保证治疗的安全。如不良反应的观察以及护理治疗意识不足将导致严重后果, 将影响患者对联合治疗的信心, 局部治疗与免疫治疗联合治疗难以取得其该有的效果。因此在联合治疗开始, 护士应对治疗可能发生的不良反应引起足够重视和警惕, 密切观察和护理, 第一时间汇报医生, 遵医嘱做好不良反应的治疗和处理。
TACE联合粒子门脉支架、消融等局部治疗与免疫治疗联合治疗护理措施应在传统TACE基础上增加如下内容:(1)局部治疗术前和免疫治疗前牢记患者病情, 医护配合下主管护士主动向患者沟通及心理辅导, 消除患者对疾病及治疗的恐惧。微波消融术前指导患者调整饮食和肝脏穿刺治疗宣教; 门脉粒子支架术前, 介绍门脉支架及植入穿刺手术相关知识和放射性粒子防护的相关知识; 免疫治疗前做好相关免疫治疗可能引起副反应种类和预防的宣教。(2)由于长时间的放射辐射, 门脉粒子支架的125I粒子治疗增加了护理的难度, 需要更精细的护理方案设计, 注意做好围治疗期对患者放射防护和护理[14]。TACE联合微波消融等多合一的局部综合治疗方案以及联合PD-1在提高疗效的同时, 也为护理工作带来了新的挑战, 需要熟悉了解患者病情、穿刺和手术方法, 警惕免疫治疗的常见以及罕见不良反应, 加强免疫治疗发生不良反应的观察护理, 才能制定更加周密严谨的综合护理计划, 提高护理质量。(3)另外, 本研究68例患者均未出现文献报道PD-1免疫治疗的相对高频不良反应如甲状腺机能减退、皮疹以及心脏毒性等[15], 可能与入组的患者样本量不足所致, 本研究采用非参检验方法的卡方检验, 可能会由于样本例数偏少导致差异无统计学意义; 也可能是发生的不良反应症状轻微, 患者能自行缓解有关, 故不良反应发生结束均较隐匿, 不易发现。免疫治疗后出院应做好患者定期复查甲状腺功能等检查的院外不良反应预防管理。如发生皮疹, 护士应询问是输液治疗中还是输液后居家出现, 以便鉴别输液反应和免疫治疗所致皮疹。
综上所述, PD-L1基因阳性肝癌伴PVTT患者行局部治疗联合PD-1治疗, 能使患者生存获益的同时也可能发生不良反应。对局部治疗联合PD-1治疗的不良反应需有预见性, 并制定相对应的护理策略应对。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|