林雯(1994-),女,贵州遵义人,在读硕士研究生,主要研究方向为生殖免疫相关研究。
目的 探索母胎界面调节性T(regulatory T cells,Treg)细胞的来源及机制。方法 收集不同孕期(妊娠第0天为E0,以此类推E4.5、E7.5、E10.5、E13.5、E16.5、E19.5)小鼠的胸腺、外周血、脾脏、淋巴结和蜕膜,利用流式细胞术检测各组织中CD4+Foxp3+ Treg细胞占CD4+ T细胞的比例。实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-PCR)和Western blot检测未孕及孕鼠E13.5的子宫蜕膜组织中趋化因子CCL2、CCL7、CCL12及CCL20在mRNA和蛋白的表达水平。流式检测未孕及E13.5孕鼠外周血中Treg细胞表面趋化因子受体CCR2和CCR6的表达。趋化实验检测CCL2、CCL7、CCL12及CCL20对E13.5孕鼠的脾脏中Treg细胞的趋化作用。结果 同/异基因配对组孕鼠胸腺的Treg细胞在E10.5和E13.5较未孕组增多,但两者之间无差异;而异基因配对组孕鼠蜕膜的Treg细胞占CD4+T细胞的比例都明显高于同基因配对组,在E10.5达到高峰,并都高于未孕组。而同/异基因配对E13.5两组孕鼠子宫蜕膜中CCL2、CCL12、CCL20的mRNA和蛋白表达水平较未孕组均明显升高,且异基因配对E13.5组明显高于同基因配对E13.5组;而CCL7在mRNA水平的表达升高但在蛋白水平无差异。同/异基因配对E13.5组孕鼠外周血中Treg细胞表面CCR2和CCR6的表达较未孕组均显著升高;CCL2、CCL7、CCL12、CCL20均对妊娠期Treg细胞有明显的趋化作用。结论 母胎界面的Treg细胞可能主要来源于胸腺,并可通过趋化作用到达蜕膜。
Objective To investigate the sources and mechanisms of regulatory T cells at the maternal-fetal interface.Methods Thymus, peripheral blood, spleen, lymph nodes and deciduas were harvested from different pregnancy periods (E0 for embryonic day 0, E4.5, E7.5, E10.5, E13.5, E16.5, E19.5)mice. The proportion of CD4+Foxp3+ Treg cells among CD4+ T cells in each sample was determined by flow cytometry. Real-time quantitative polymerase chain reaction (RT-PCR) and Western blot were used to detect the mRNA and protein expression level of chemokines (CCL2, CCL7, CCL12 and CCL20) in uterine and decidua of non-pregnant and E13.5 mice. Expression of CCR2 and CCR6 in Treg cells of peripheral blood of non-pregnant and E13.5 mice were tested by flow cytometry. Their chemotaxis to Treg cells during pregnancy was assessed by an in vitro chemotaxis assay in a transwell chamber.Results Compared to non-pregnant mice, the proportion of Treg cells in CD4+ T cells in thymus from syngeneic and allogeneic pregnant group was increased at E10.5 and E13.5, but there was no difference between them. The proportion of Treg cells in CD4+ T cells of allogeneic pregnant mice increased significantly and was higher than syngeneic pregnant group, while reached a peak at E10.5. Treg cells of both the two pregnant groups were higher than normal non-pregnant mice. The mRNA and protein expression level of CCL2, CCL12 and CCL20 in uterine and decidua of E13.5 pregnant mice were increased to non-pregnant mice, but the increase of CCL7 occurred in mRNA not protein. The expression of CCR2 and CCR6 in the surface of Treg cells in peripheral blood significantly enhanced in syngeneic and allogeneic pregnant group than non-pregnant one. CCL2, CCL7, CCL12, CCL20 exerted obvious chemotaxis on Treg cells during pregnancy.Conclusions Thymus maybe the main sources of Treg cells at the maternal-fetal interface and Treg cells arrived there by chemotaxis.
妊娠过程是一种生理状态, 母体对精液中父本异体抗原的耐受性是受精卵成功植入的关键, 而对拥有来自父母双方各一半基因的胎儿的耐受性则是母亲和胎儿跨越胎盘屏障共存的关键, 即母体免疫系统必须耐受精液中的抗原和胎儿异体抗原才能成功建立并维持妊娠至成功分娩。有研究证明从妊娠早期到中期, 免疫细胞约占蜕膜细胞总数的30%~40%[1], 这些免疫细胞可以影响妊娠期的整个过程, 包括植入、妊娠的维持、对感染的防御以及分娩等[2]。
调节性T细胞(regulatory T cells, Treg)是具有免疫抑制作用的T淋巴细胞亚群, 它们可以维持机体对自身抗原的耐受以及防止自身免疫性疾病的发生[3]。Treg细胞可以在细胞毒性T淋巴细胞相关抗原4(cytotoxic T-lymphocyte-associated antigen 4, CTLA-4)、转化生长因子β (transforming growth factor β , TGF-β )、白细胞介素10(interleukin-10, IL-10)等细胞因子的参与下抑制大多数免疫细胞群的功能, 包括淋巴细胞、各种类型的巨噬细胞、树突状细胞和B细胞[4, 5]。Treg细胞根据其来源可以分为胸腺来源的Treg(thymus-derived Treg, tTreg)细胞和外周来源的Treg(peripherally derived Treg, pTreg)细胞[6]。CD4+Foxp3+的tTreg细胞是由CD4+CD25+ T细胞在胸腺中发育而来。而pTreg细胞主要是由未致敏的CD4+CD25-T细胞(conventional T cells, Tconv)在受到抗原刺激后在外周淋巴器官中诱导生成。tTreg细胞和pTreg细胞均表达Foxp3, 并且均具有免疫抑制功能[7], 但它们在基因表达、表型的稳定性以及表观遗传学调节等方面存在明显的差异[8]。然而, tTreg细胞和pTreg细胞在机体总的Treg细胞池中所占的比重、具体功能以及二者如何区分等方面也尚未完全阐明。
研究表明, Treg细胞在妊娠耐受中起着关键作用[9, 10, 11, 12]。妊娠开始建立时来自父体的精液抗原以及妊娠建立后的异体胎儿抗原都会引起母体的自然杀伤(natural killer, NK)细胞[13]、单核细胞[14]和T细胞[15]活化, 从而导致母体的免疫系统激活。为了维持母体免疫系统的动态平衡和正常的妊娠过程, 免疫调节作用的发挥必不可少, 其中Treg细胞是主要调节者[16]。蜕膜即母胎界面, 是母亲与胎儿“ 对话” 的主要场所, 免疫激活以及抑制作用都主要发生于此[17]。经研究发现, 人和小鼠在妊娠期间的Treg细胞数量较未孕时都是增加的[18, 19]; 流产患者的外周血和蜕膜中的CD4+CD25bright或者CD4+Foxp3+Treg细胞都明显少于正常妊娠的孕妇[20, 21]; 如果用白喉毒素(diphtheria toxin, DT)消耗转入了白喉毒素受体(diphtheria toxin receptor, DTR)的转基因小鼠的Foxp3+Treg细胞, 小鼠的胚胎会明显变小并且繁殖率明显降低[22]。既然Treg细胞在妊娠中起着重要作用, 那么妊娠期间蜕膜的Treg细胞的来源主要是哪里呢?有研究发现tTreg是蜕膜Treg细胞的主要来源[23], 但同时也有研究表明pTreg细胞是主要的来源[24]。而如前所述, 由于区分tTreg和pTreg细胞的标志物的缺乏, 所以无法确定蜕膜中的Treg的主要来源。本研究的目的在于探究妊娠期Treg细胞在不同组织中(主要是母胎界面)的比例变化, 并为探索母胎界面即蜕膜中Treg细胞的来源及机制提供进一步的证据。
所有的实验动物在湖南斯莱克景达实验动物有限公司购买, 选择8~10周龄的健康清洁级C57BL/6雌鼠和雄鼠, 以及BALB/c雄鼠, 饲养于华南理工大学实验动物中心无特定病原体(specific pathogen free, SPF)环境。所有的动物实验均通过华南理工大学实验动物伦理委员会审查。
1.2.1 流式细胞术
将所购小鼠适应性饲养1周后, 于17:00将雌性、雄性小鼠以2∶ 1比例合笼, 次日清晨8:00检查阴道栓, 以查见阴道栓日为妊娠第0.5天(embryonic day 0.5, E0.5), 其余妊娠天数依次类推。分别于E4.5、E7.5、E10.5、E13.5、E16.5以及E19.5通过颈椎脱位法处死孕鼠, 设立各孕龄组, 以正常未孕C57BL/6雌鼠作为对照组, 每组3只。分离各组胸腺、外周血、脾脏、淋巴结和子宫蜕膜单个核细胞。为了检测妊娠期各组织中的Treg细胞的变化, 取各组织的1× 106个细胞, 用APC/Cy7标记的抗小鼠CD45抗体(Biolegend, San Diego, CA)、Brilliant Violet 421标记的抗小鼠CD3抗体(Biolegend, San Diego, CA)、PerCP/Cy 5.5标记的抗小鼠CD4抗体(Biolegend, San Diego, CA)、Brilliant Violet 785标记的抗小鼠CD8a抗体(Biolegend, San Diego, CA), 室温避光孵育20 min。PBS洗涤一次后, 加入1 mL固定破膜液(eBioscience, California, USA), 室温避光固定45 min。直接加入3 mL破膜缓冲液(eBioscience, California, USA), 400 g/min离心5 min。弃去上清, 用50 μ L破膜缓冲液重悬细胞。加入Alexa flour 647标记的抗Foxp3抗体(Biolegend, San Diego, CA)室温避光孵育20 min。用破膜缓冲液再洗一遍。同时设立Foxp3的同型抗体对照组。使用FACS Celeasta流式细胞仪(BD Bioscience, New Jersey, USA)检测CD45+CD3+CD4+CD8a-Foxp3+Treg细胞占CD45+CD3+CD4+CD8a-T细胞的比例。为了进一步检测外周血中Treg细胞表面的趋化因子受体的表达情况, 取外周血的1× 106个细胞, 除了在以上染色方案的基础上加入表面抗原趋化因子受体APC标记的抗小鼠CCR2抗体(Biolegend, San Diego, CA)和PE-Cy7标记的抗小鼠CCR6抗体(Biolegend, San Diego, CA)的染色外, 其余操作均相同。全部样品采用FlowJo软件(FlowJo, LLC, Ashland, OR)进行数据分析。
1.2.2 实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction, RT-PCR)
快速摘取未孕组的子宫、孕龄为E13.5的同基因配对组以及异基因配对组的子宫蜕膜组织并置于液氮中, 转移至-80 ℃冰箱保存备用。使用Trizol萃取法提取子宫蜕膜组织的总RNA。按照PrimeScript™ RT reagent Kit with gDNA Eraser (Perfect Real Time)(TaKaRa)说明书进行基因组DNA去除和逆转录反应后得到cDNA, 随后使用PowerUp™ SYBR™ Green Master Mix (Applied BiosystemsTM)在RT-PCR仪(AppliedBiosystemsTM)上采用RT-PCR法检测子宫蜕膜组织中CCL2、CCL7、CCL12以及CCL20的mRNA表达水平, 使用β -actin作为内参, 运用2-△ △ Ct相对定量法比较各组目标mRNA表达差异。趋化因子引物序列见表1。
| 表1 趋化因子引物序列表 Tab.1 Sequences of chemokines primers |
1.2.3 Western blot
使用如前述的保存于-80 ℃冰箱的子宫蜕膜组织, 在液氮预冷的研钵中将组织研磨成为粉末, 使用说明书建议量(每20 mg组织使用200 μ L)的RIPA裂解液(碧云天), 使用前需加入蛋白酶抑制剂PMSF(碧云天)。将组织和裂解液的混合液放在冰上裂解30 min, 每15 min震荡1次。4 ℃, 14 000 rpm离心15 min, 吸取上清即为子宫蜕膜组织的总蛋白。通过BCA定量试剂盒(Thermo Fisher)对提取的组织总蛋白进行定量, 根据定量结果调整其浓度。以每孔60 μ g的总蛋白稀释在5× 上样缓冲液(上海生工)中, 使得最后的上样体积为20 μ L, 并在100 ℃的沸水中煮10 min使蛋白变性。使用SurePAGE预制胶(金斯瑞)及其配套的电泳缓冲液(金斯瑞), 以每孔60 μ g/20 μ L的总蛋白上样。在电泳槽(Biorad Mini-Protean Tetra)中先70 V电泳5 min, 再将电压转为110 V电泳约85 min。同时预冷转膜缓冲液, 并在转膜前用其浸泡转膜夹、海绵、滤纸及0.2 μ m PVDF膜(Millipore), PVDF膜需提前在甲醇中活化5 min。按照转膜夹的透明一侧向下, 依次是海绵、滤纸、PVDF膜、凝胶、滤纸、海绵的顺序夹紧转膜夹, 注意不要有气泡。在冰浴中转膜, 转膜条件为30 V, 70 min。使用5%脱脂牛奶室温摇床封闭1 h。加入1∶ 500稀释的抗CCL2 (Abcam)、CCL7 (R & D system)、CCL12 (R & D system)、CCL20(Abcam)和GAPDH(Abcam)一抗4 ℃孵育过夜。洗膜3次, 每次5 min, 于1∶ 1 000稀释的辣根过氧化物酶标记的二抗(Thermo Fisher)稀释液中室温摇床孵育1 h。洗膜3次, 2次5 min, 1次15 min, 加入超敏型化学发光底物(Thermo Fisher)显色曝光。采用ImageJ分析软件对条带进行分析。
1.2.4 趋化实验
处死异基因配对E13.5孕鼠后于无菌条件下通过研磨过滤法分离其脾脏的单个细胞。使用CD4+CD25+Treg细胞磁珠分选试剂盒(MiltenyiBiotec)进行磁珠分选, 主要步骤为先孵育包含抗CD8a、CD11b、CD45R、CD49b和Ter-119抗体-生物素混合物、生物素偶联的磁珠及抗CD25-PE抗体, 以标记出非CD4+细胞从而阴选出CD4+细胞, 再向CD4+细胞中加入PE偶联的磁珠进行孵育, 进一步阳选出CD4+CD25+Treg细胞。使用无血清培养基重悬CD4+CD25+Treg细胞并将细胞浓度调整为2× 106个/mL, 混匀后取2× 105个细胞(即100 μ L)铺到适配24孔培养板的孔径为5 μ m的嵌套小室(Corning Costar)中。将嵌套小室置入24孔培养板, 每孔含有600 μ L无血清培养基, 分别加入或不加入CCL2、CCL7、CCL12、CCL20, 于37 ℃、5% CO2的培养箱中培养24 h后, 流式细胞术检测下层小室中的CD4+CD25+Treg细胞数, 计算迁移指数(migration index, MI, 即趋化因子组下室的细胞数/对照组下室的细胞数), 检测各趋化因子对Treg细胞的趋化作用。
使用Graphpad Prism 8.0软件进行统计学分析。数据用均数± 标准差表示, 采用单因素方差分析和独立样本t检验进行统计学分析, 以P< 0.05为有统计学意义。
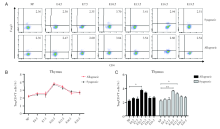
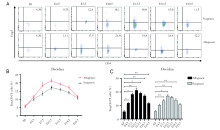
通过对不同孕龄小鼠的胸腺的CD4+Foxp3+Treg细胞进行流式分析, 妊娠期的胸腺中CD4+Foxp3+Treg细胞占CD4+T细胞的比例在E4.5和E7.5时与未孕组保持一致, 后逐渐升高至E10.5达高峰, 随后逐渐下降, E13.5时仍高于未孕组, E16.5和E19.5时趋于未孕时的水平。同/异基因配对组之间无显著差异, 见图1。
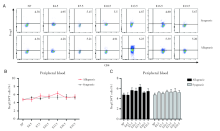
通过对不同孕龄小鼠外周血中的CD4+Foxp3+Treg细胞进行流式检测, 妊娠期的外周血中CD4+Foxp3+Treg细胞占CD4+T细胞的比例不会随着孕龄的变化而变化, 而且同基因配对组与相应孕龄的异基因配对组无明显差别, 见图2。
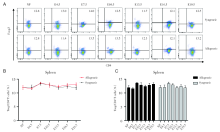
通过对不同孕龄小鼠脾脏的CD4+Foxp3+Treg细胞进行流式分析, 妊娠期的脾脏中CD4+Foxp3+Treg细胞占CD4+T细胞的比例在同基因配对组和异基因配对组, 变化没有显著差异, 而且与正常未孕小鼠也无明显差别, 见图3。
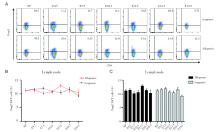
通过对不同孕龄小鼠淋巴结的CD4+Foxp3+Treg细胞进行流式分析, 同基因配对组孕鼠和异基因配对孕鼠不同孕期淋巴结中CD4+Foxp3+Treg细胞占CD4+T细胞的比例, 均没有显著差异, 而且与正常未孕小鼠也无明显差别, 见图4。
通过对不同孕龄小鼠的蜕膜中的CD4+Foxp3+Treg细胞进行流式检测, 我们发现妊娠期的蜕膜中CD4+Foxp3+Treg细胞占CD4+T细胞的比例随着孕期的变大而逐渐增加, 并在E10.5达高峰, 随后逐渐下降。其中E7.5的异基因配对组会比同基因配对组的比例明显更高(P< 0.05), E4.5、E10.5、E13.5、E16.5的异基因配对组的比例也是比同基因配对组高的, 但是不具有统计学意义, 见图5。
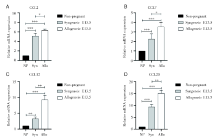
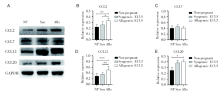
通过RT-PCR对子宫蜕膜组织中趋化因子mRNA表达水平的检测, 发现与未孕组相比, 同基因和异基因配对孕鼠在E13.5蜕膜CCL2、CCL7、CCL12、CCL20的表达都明显升高, 并且异基因配对E13.5组均明显高于同基因配对E13.5组, 见图6。
Western blot检测未孕、同基因和异基因配对E13.5孕鼠的蜕膜中CCL2、CCL12和CCL20的相对表达水平, 发现怀孕组比未孕组升高, 而且异基因配对E13.5比同基因配对E13.5的更高, 但是CCL7在三组间无明显差异, 见图7。
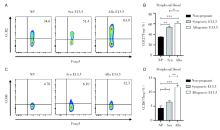
流式检测未孕、同/异基因配对E13.5小鼠的外周血中Treg细胞表面的趋化因子受体, 妊娠期Treg细胞表面的CCR2和CCR6的表达明显增多, 其中异基因配对E13.5最高, 其次是同基因配对E13.5, 未孕最低, 见图8。
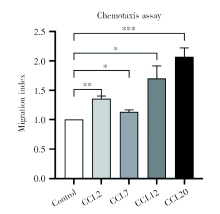
通过对磁珠分选异基因配对E13.5小鼠的CD4+CD25+Treg细胞进行趋化实验, 与不加趋化因子的对照组(迁移指数为1)相比, 趋化因子CCL2、CCL7、CCL12、CCL20四个组的迁移指数明显升高, 见图9。
我们通过研究发现, 不仅妊娠期孕鼠的子宫蜕膜组织的Treg细胞相比于未孕组是增多的, 而且异基因配对组孕鼠的Treg细胞比相同孕龄的同基因配对组孕鼠也是明显增多的。在E10.5和E13.5的小鼠胸腺中, Treg细胞比例比正常未孕小鼠增多。在子宫蜕膜中的趋化因子CCL2、CCL12、CCL20的mRNA表达水平, 妊娠期孕鼠是高于未孕小鼠的, 并且这几个趋化因子对孕鼠的Treg细胞也都是有明显的趋化作用。虽然CCL7的mRNA表达水平在妊娠期与未孕时升高, 但是最终的蛋白表达水平与未孕时并无明显差异, 并且CCL7对孕鼠的Treg的趋化作用不如CCL2、CCL12、CCL20明显。
众所周知, Treg细胞是免疫耐受的重要组成部分, 而正常妊娠的建立与维持均需要耐受环境的存在。研究者们使用不同的小鼠模型来耗竭Treg细胞从而研究Treg细胞在妊娠耐受的建立(妊娠早期)与维持(妊娠中、晚期)阶段的必要性。如Teles等人[25]使用Foxp3DTR的转基因小鼠模型, 在交配前注射DT以消耗Treg细胞从而造成Treg细胞的缺失, 结果是效应T细胞激活并聚集到子宫的着床部位后导致这些部位的炎症和纤维化, 这表明子宫中的Treg细胞有助于建立适合胚胎植入的“ 友好” 微环境, 而Treg细胞的缺失则会将子宫转化为一种不利于植入的恶劣环境; 此外, Shima等人[26]在小鼠的不同妊娠期腹腔注射抗CD25单克隆抗体来耗竭CD25+Treg细胞, 他们发现在建立耐受的妊娠早期, Treg细胞缺失会引起流产率的增高, 而对于妊娠晚期, Treg细胞可能并不是必需的。我们的研究也发现, 在母胎界面(即蜕膜)的Treg细胞在妊娠早期是逐渐增多的, 直到E10.5时达到高峰, 此后开始逐渐下降, 到接近分娩的时候(E19.5)趋于正常未孕组的水平。所以, 我们得出结论, 可能Treg细胞在妊娠耐受的建立阶段是十分必要的, 在妊娠中期时达到最高水平, 但是在妊娠晚期的作用就逐渐减弱。
本研究还发现, 妊娠期蜕膜中, 异基因配对组的Treg细胞数目与同基因配对组相比是增加的。和Zhao等[19]的研究一致的是, 妊娠期Treg细胞在其主要生产场所胸腺增加, 不同的是, 他们并没有检测蜕膜中的Treg细胞数量的变化。我们的研究表明妊娠期Treg细胞增加的现象出现但并不局限于蜕膜局部, 也出现在胸腺。这说明, 蜕膜中Treg细胞的来源可能主要是tTreg。但是由于tTreg和pTreg细胞都表达Foxp3并且具有免疫抑制功能, 但是并没有明确地可以区分二者的标志物, 所以区分二者的标志物的缺失, 也是本研究的局限性之一。
本研究就在此次发现的妊娠期胸腺及蜕膜Treg细胞数量明显增加这一现象的基础上, 对tTreg细胞向蜕膜迁移的机制进行了初步探索。根据Zhang等[27]在一项胰岛移植模型中的发现, Treg细胞先从血液循环迁移至发生炎症反应的同种异体移植物中, 这一过程依赖于趋化因子受体CCR2、CCR4、CCR5和P-选择素、E-选择素。Treg细胞在同种异体移植物中激活后, 随后以依赖CCR2、CCR5、CCR7的方式迁移入引流淋巴结。这两个连续步骤对于Treg细胞的迁移来说都是必需的, 因为如果消除其中的相关受体(CCR2、CCR4、CCR5、CCR7等), 就会导致同种异体移植物的存活率降低。所以, 妊娠期Treg细胞的迁移也有可能与趋化作用相关。从我们的研究结果中可以看出, 不论在mRNA水平还是蛋白水平, 妊娠期蜕膜中的CCL2、CCL12、CCL20的相对表达水平相对于未孕组子宫是明显升高的, 这说明, 趋化因子CCL2、CCL12、CCL20在妊娠期Treg细胞向蜕膜组织的迁移中可能起着重要作用。而且CCR2和CCR6分别作为CCL2、CCL12和CCL20的受体[28], 它们在Treg细胞表面的表达也是增多的, 它们与趋化因子相互作用可以促进Treg细胞向蜕膜组织的迁移。CCL2、CCL12和CCL20在mRNA和蛋白水平的表达都是在异基因配对E13.5组、同基因配对E13.5组、未孕组依次降低, 说明异基因配对E13.5组的胎儿异体抗原会引起CCL2、CCL12、CCL20表达水平升高, 从而促进Treg细胞向蜕膜的迁移。而异基因配对E13.5孕鼠的子宫蜕膜中CCL7的mRNA表达水平比同基因配对及未孕组都更高, 但是CCL7在三组中的蛋白表达水平无明显差异, 这说明虽然妊娠期的CCL7的mRNA表达升高, 但是最终的蛋白表达水平与胎儿异体抗原的作用不大。也说明CCL7作为CCR2的配体之一, 在妊娠期引起Treg细胞迁移的趋化作用中占的作用并不大, 而CCL2和CCL12是妊娠期和CCR2结合引起Treg细胞迁移的主要配体。不管是同基因还是异基因配对, 妊娠期母胎界面的Treg细胞可能主要来源于胸腺, 其迁移过程与趋化因子引起的趋化作用密切相关, 从而参与妊娠耐受的建立与维持。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|