张绪超(1974-),男,安徽芜湖人,医学博士,研究员,主要研究方向为肿瘤分子标志物。
免疫检查点抑制剂的出现为恶性肿瘤的治疗带来了跨时代的革新。PD-1/PD-L1虽然是免疫检查点抑制剂的主要靶点,但机体免疫系统与肿瘤的交互作用极为复杂,免疫检查点分子如PD-1、PD-L1、CTLA-4存在多类结合蛋白,且亲和力不同,并介导不同的细胞生物学及免疫反应。因此在考察PD-1/PD-L1单抗的免疫效应时,不应简单地理解为阻断免疫检查点以激活免疫系统,可能还需考虑封闭PD-1/PD-L1后对其他配体、结合蛋白的作用及连带效应。PD-L2作为PD-1第二类配体,其免疫调节作用复杂而具争议。早期研究仅将PD-L2作为PD-1的次要配体而未给予足够关注,但越来越多的研究显示,PD-L2在肿瘤患者临床预后及PD-1单抗疗效预测方面显示出一定潜力。本文就PD-L2在肿瘤免疫治疗中的作用作一简述。
Immune checkpoint inhibitors (ICI) have brought transformative innovation for the treatment of malignancies. Though programmed death 1(PD-1) and programmed death ligand 1(PD-L1) have been the major targets for immune therapy, the interplay of human immune system and tumors is very complex because there are other checkpoint molecules and their interaction with many other proteins with differential affinity to mediate diverse cellular processes and immune response. So, while assessing the efficacy of antibody inhibitors against PD-1 or PD-L1, the action on other ligands or binding proteins by blocking PD-1 or PD-L1 and related effects should be included instead of simply taking it as to activate immune system by single checkpoint blockade. PD-L2 acts as a secondary ligand for PD-1 with debated role of complicated immune modification. Early studies just took PD-L2 as a ligand for PD-1. However, recently more and more data showed that PD-L2 could have substantial role in the prognosis and prediction of clinical immune treatment in cancer patients. In this paper, the role of PD-L2 in tumor immunotherapy is briefly described.
肿瘤免疫治疗的发端源自19世纪末, 德国医师Fehleisen和Busch首次报道患者发生丹毒感染后肿瘤消退的现象。利用感染激活免疫系统以实现肿瘤治疗的思路, “ Coley毒素” 成为首个用于临床治疗的免疫治疗药物。在随后漫长的百年探索历程中, 细胞因子、肿瘤疫苗、单克隆抗体、溶瘤病毒、细胞免疫疗法等相继被开发, 但因有限的疗效及治疗安全性等问题限制了肿瘤免疫治疗的临床应用。以程序性死亡受体1(programmed death 1, PD-1)/程序性死亡配体1(programmed death ligand 1, PD-L1)单抗、细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte associated protein 4, CTLA-4)为代表的免疫检查点抑制剂掀起了免疫治疗的一波新热潮, 2010年后, 免疫检查点抑制剂陆续在全球范围内获批用于多瘤种的治疗, 且相关适应证仍在持续拓展中。发现免疫检查点的主要研究贡献者James P. Allison与本庶佑也因此荣膺2018年诺贝尔生理、医学奖[1]。
用以指导PD-1/PD-L1单抗治疗的生物标志物是目前肿瘤免疫治疗的热点之一, 虽然现阶段PD-L1是最为广泛使用的生物标志物, 但其疗效预测准确性仍有待优化。PD-L2是继PD-L1后发现的第二个PD-1配体, 其生物学效应及临床应用价值尚未被广泛、深入研究。
编码人源性PD-L2的基因位于9p24.2染色体, 包含13个外显子, 12个内含子。PD-L2与PD-L1同属B7蛋白家族, 两者氨基酸序列存在34%的一致性, 结构均由信号序列、IgV样、IgC样跨膜结构域及短胞浆尾段构成[2]。
PD-L2与PD-1以化学计量学1∶ 1相结合。结构生物学研究显示, PD-L2与PD-1的结合方式包括位于IgV结构域的1 915 Å 2结合面、18个强氢键及面积为570 Å 2的疏水核[3]。PD-L2与PD-1之间的亲和力是PD-L1的2~6倍, 可能原因是两者色氨酸侧链分布位置不同。PD-L1色氨酸侧链隐藏在疏水核心结构内部, 不参与PD-1的相互作用; 而PD-L2暴露于外侧, 可伸入PD-1核心结构内部[4]。
与PD-L1的组成性表达不同, 生理情况下PD-L2多诱导性表达于树突状细胞、巨噬细胞、肥大细胞、特定B细胞亚群等免疫细胞[4]。在肿瘤患者中, 免疫组化结果显示, PD-L2在间质细胞、内皮细胞及肿瘤细胞中均呈阳性表达。PD-L1与PD-L2表达相关性因不同瘤种而异, 且伴随明显个体差异, 这可能和各瘤种不同的免疫微环境特征及遗传多态性相关。三阴性乳腺癌中两者线性相关性最为明显(r2=0.623 8), 然而在多数瘤种中, 两者表达水平呈现出不一致性:在非小细胞肺癌(non-small cell lung cancer, NSCLC)、膀胱癌中, PD-L1表达水平高于PD-L2, 但在头颈鳞癌、胃癌中则呈现相反趋势。肾细胞癌(renal cell cancer, RCC)、黑色素瘤中则呈现出双向不一致性, 不同患者PD-L1/PD-L2主要表达类型截然相反[5]。另外, 一项针对RCC的研究显示, 肾上腺、内脏等转移灶PD-L2阳性比例高于原发病灶, 但差异无显著性[6]。以上特征提示, 在考察PD-L2在肿瘤免疫治疗中的预后评估价值时, 应明确限定瘤种, 并充分考虑肿瘤组织样本取样方式。
PD-L2的免疫调控作用复杂且充满争议。2001年Gordan Freeman团队首次报导PD-L2为PD-1的第二类配体, PD-L2/PD-1结合对于T细胞受体介导的CD4+T细胞增殖及细胞因子分泌具有强烈的抑制作用[2]。因此在早期阶段, PD-L2被认为是免疫抑制性分子。
PD-L2新型结合蛋白排斥性引导分子b(repulsive guidance molecules b, RGMb)的发现揭示了PD-L2作为免疫共刺激分子的新功能。RGMb是一类糖基磷脂酰肌醇锚定膜蛋白, 结合PD-L2亲和力与PD-1相近。PD-L2与BMP-BMP受体-Neogenin形成超复合物, 启动下游靶基因转录、细胞骨架重组等一系列下游事件, 进而介导T细胞扩增[7]。PD-L2/RGMb虽然发挥免疫激活作用, 但阻断二者相互作用可导致气道超敏。其中可能的原因是PD-L2/RGMb共刺激触发了Th1细胞应答, 进而抑制Th2介导的哮喘, 缓解小气道炎症[8]。
PD-1/PD-L1通路作为经典的免疫检查点, 同样也是肿瘤免疫逃逸的重要机制— — 肿瘤细胞所表达的PD-L1可介导PD-1阳性T细胞的失活与耗竭[9]。因此, 围绕该通路所开发的PD-1单抗与PD-L1单抗是目前临床使用最为广泛的免疫检查点抑制剂。然而, 在药物临床开发过程中, PD-1单抗、PD-L1单抗呈现了疗效与安全性的差异, 体现为针对同一瘤种治疗获益不同[10, 11], 以及特定免疫相关不良反应发生率不同[12]。
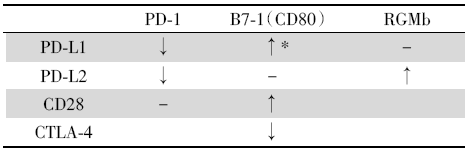
PD-1与PD-L1之间的配受体关系并非唯一, 其中PD-1配体还包括PD-L2, 而PD-L1亦可与B7-1(CD80)配接。因此, 阻断PD-1或PD-L1带来的影响不仅限于PD-1/PD-L1通路本身, 还应考虑对于其他结合蛋白的连带效应[13, 14]。PD-1/PD-L1与不同结合蛋白配接后对于T细胞活化、增殖的效应见表1。
| 表1 PD-1/PD-L1与不同结合蛋白配接后对于T细胞活化、增殖的效应 Tab.1 Effects of PD-1/PD-L1 on activation and proliferation of T cells after being conjugated with different binding proteins |
2.1.1 阻断PD-1的免疫学效应
PD-1抑制剂可阻断PD-1/PD-L1及PD-1/PD-L2的结合, 进而削弱后两者均介导T细胞抑制效应, 同时有更多的PD-L2可与RGMb结合, 后者可促进Th1型CD4+T细胞的扩增, 从而有利于抗肿瘤免疫效应的发挥。
2.1.2 阻断PD-L1的免疫学效应尚存争议
(1)正向促进观点:PD-L1单抗除了阻断PD-L1/PD-1通路对T细胞的抑制作用外, Mayoux M等研究认为, 树突状细胞同样参与了PD-L1单抗的T细胞激活效应[16]。PD-L1可与B7-1配接, 后者与T细胞表面的CD28结合形成共刺激信号, 促进T细胞激活。现有研究显示, PD-L1与B7-1仅能在同一细胞上以顺式结合[15]。树突状细胞同时表达PD-L1与B7-1, 且PD-L1表达丰度更高, 提示树突状细胞B7-1几乎全部被PD-L1所封闭。在PD-L1单抗作用下, B7-1得以释放, 并结合CD28以激活T细胞。
(2)负向抑制观点:CTLA-4同样是B7-1的结合蛋白, 且两者之间的亲和力远高于B7-1与CD28。作为T细胞激活后早期表达的表面标志物, CTLA-4与B7-1结合后可发挥T细胞抑制效应[17, 18]。PD-L1单抗虽然阻断了PD-L1/B7-1的结合, 但被释放的B7-1接着被T细胞表达CTLA-4所结合, 进而介导免疫抑制效应[14]。
除此之外, PD-L1单抗并未阻断PD-1/PD-L2结合所介导的免疫抑制效应。综合上述两个观点, PD-L1单抗对于T细胞的调控效应存在截然相反的调控机制, 这对PD-L1的免疫治疗是否会产生影响有待探明。但从现有临床证据来看, PD-L1单抗对比PD-1单抗对于晚期实体瘤的疗效、安全性差异可能归因于此。
在免疫检查点抑制剂早期, 部分PD-1单抗与PD-L1单抗同时进入临床开发赛道, 但初期研究数据显示PD-1单抗似乎有一定治疗优势。2012年, 《N Engl J Med》同期发表了PD-1单抗与PD-L1单抗单药治疗晚期实体瘤的Ⅰ 期临床研究, 虽然两项研究并非头对头比较, 但PD-1单抗治疗缓解率从数值上高于PD-L1单抗(黑色素瘤 28% vs. 17%, NSCLC 18% vs. 10%, RCC 27% vs. 12%)[19, 20]。随后该PD-1单抗顺利进入后续研究历程, 最终成为现如今广泛用于临床的纳武利尤单抗。
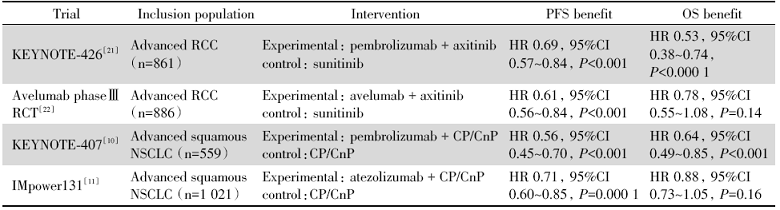
在一些大型Ⅲ 期随机对照临床研究(randomized control trial, RCT)中, 即便采用相同的研究设计, PD-1单抗、PD-L1单抗所呈现的临床获益依旧存在差异, 如RCC治疗KEYNOTE-426研究[21]对比avelumab Ⅲ 期临床研究[22], 以及晚期肺鳞癌KEYNOTE-407研究[10]对比IMpower131研究[11], PD-L1单抗的无进展生存(progression-free survival, PFS)获益均未能成功转化为总生存(overall survival, OS)获益, 见表2。
| 表2 相同研究设计大型Ⅲ 期RCT中PD-1单抗与PD-L1单抗获益的差异 Tab.2 Difference of benefit between PD-1/PD-L1 monoclonal antibody in large-scale phase Ⅲ RCT with the same research design |
但上述研究之间并非头对头比较。2019年王洁团队发表在《JAMA Oncol》的系统性回顾及荟萃分析对比了PD-1单抗及PD-L1单抗的疗效与安全性特征, 纳入2001年1月至2019年3月期间的19项RCT研究、11 379例患者, 研究筛选基于镜像法则, 以尽可能减少研究异质性造成的偏倚[23]。研究主要分析结果为两类单抗OS获益差异。汇总所有镜像对比的组别结果后, 发现总体而言PD-1单抗方案OS获益优于PD-L1单抗方案(HR 0.75, 95%CI 0.65~0.86, P< 0.001), 异质性I2=37%(P=0.15); 利用固定效应模型的出一致结果(HR 0.77, 95%CI 0.69~0.85, P< 0.001)。利用干预方案类型进行分层发现, 无论是免疫单药还是联合治疗, PD-1单抗方案OS获益均优于PD-L1单抗(免疫单药:HR 0.78, 95%CI 0.63~0.95, P=0.01; 免疫联合:HR 0.68, 95%CI 0.55~0.83, P< 0.001)。治疗安全性方面, 两类单抗总体而言具有相近的不良反应发生风险, 包括任何类型不良反应[3~5级:相对危险度(relative risk, RR) 1.04, 95%CI 0.78~1.39, P=0.78]、免疫相关不良反应(3~5级:RR 0.88, 95%CI 0.46~1.68, P=0.69), 以及导致死亡或停药的不良反应风险(任何导致死亡的不良反应:RR 1.01, 95%CI 0.53~1.93, P=0.98; 任何导致停药的不良反应:RR 1.20, 95%CI 0.95~1.52, P=0.13; 免疫相关不良反应导致的死亡:RR 1.38, 95%CI 0.11~16.89, P=0.80)。
截止至2021年1月15日, 于clnicaltrials.gov检索正在进行的肿瘤免疫治疗相关临床研究共计2 000余项, 且在持续增长。虽然以PD-1/PD-L1单抗为代表的免疫检查点抑制剂已在全球多国、多地区获批用于多瘤种的治疗, 但肿瘤免疫治疗领域仍然有许多亟待解决的问题。2020年《Cell》刊载专家观点论述, 汇总分析了肿瘤免疫治疗10大挑战, 其中4项与疗效评估及优化相关, 而生物标志物是其中的重要方面[24]。现阶段国内外药物监管部门批准用于指导免疫治疗的生物标志物主要有3类:
(1)PD-L1:诸多PD-1/PD-L1单抗临床研究将PD-L1纳入研究人群的预设分层因素, 且PD-L1在免疫治疗, 尤其是单药治疗中对于治疗获益人群的预测价值有着明确的临床证据[25, 26]。然而, PD-L1作为生物标志物无法解释部分低水平PD-L1患者依旧可从免疫单药治疗中获益的现象[27]。且PD-L1具有明显的瘤间与瘤内异质性, 可表达于多类细胞, 这些因素均可对其疗效预测的准确性造成干扰[28]。
(2)肿瘤突变负荷(tumor mutation burden, TMB):2020年, 美国食品药品管理局批准帕博利珠单抗用于先前治疗失败的、高TMB、不可切除或转移性成人或儿童实体瘤的治疗, 同时批准TMB检测的伴随性诊断[29]。现阶段二代测序(next generation sequencing, NGS)取代外显子测序成为TMB检测新标准, 但依旧存在平台普及性差、检测成本高的问题。且一些研究显示, TMB并不能有效预测免疫单药或联合治疗疗效[30, 31]。
(3)微卫星高度不稳定性/错配修复基因缺陷(microsatellite instability-high, MSI-H/deficient mismatch repair, dMMR):该类分子学标志物在结直肠癌中发生比例较高, 但在其他类型实体瘤中发生率低, 约为15%, Ⅳ 期肿瘤甚至仅占3%[32]。
PD-L2的表达在部分瘤种中与PD-L1相关性不显著, 可能因此具有不同于PD-L1的预后评估价值。
一项韩国研究利用425例RCC患者手术切除样本进行PD-L1、PD-L2免疫组化染色, 发现PD-L2在不同类型RCC中具有不同的预后评估价值。在透明细胞RCC中, PD-L2的表达与c-MET及VEGF表达相关, 且PD-L2阳性与更短的PFS(P=0.033)及癌症特异性生存(P=0.010)显著相关, 但在乳头状RCC患者中未显示出相关性[33]。
PD-L2对于结直肠癌的预后作用在一项中国多中心研究中得以揭示, 该研究纳入127例结直肠癌患者, 其中40%表达PD-L2。研究发现PD-L2过表达与更差的OS显著相关(46.3个月 vs. 69.1个月, P=0.000 4; 多变量COX回归分析HR 2.778, 95%CI 1.668~4.627, P< 0.000 1)[34]。
一项荟萃分析纳入16项研究、汇总分析3 533患者数据发现, PD-L2过表达是OS较弱的负相关预测因子(HR 1.38, 95%CI 1.05~1.81, P=0.021), 且为无病生存率(disease free survival, DFS)/PFS(HR 1.44, 95%CI 1.15~1.81, P=0.001)的强预测因子。亚组分析显示, PD-L2与肝细胞癌预后不良显著相关(OS:HR 1.60, 95%CI 1.12~2.29, P=0.011; DFS/PFS:HR 1.50, 95%CI 1.04~2.16, P=0.031)。除此之外, PD-L2的表达提示淋巴转移风险(转移 vs. 未转移:OR 1.61, 95%CI 0.98~2.65, P=0.061)[35]。
虽然PD-L2在PD-1/PD-L1单抗疗效预测方面的证据不及PD-L1, 但目前部分研究已显示出PD-L2在此方面的临床应用潜力。
KEYNOTE-012研究是证实帕博利珠单抗单药治疗复发/转移性头颈部鳞癌疗效与安全性的Ⅰ b期临床研究。Yearly J等分析了该研究中172例头颈部鳞癌患者PD-L2表达情况及其与疗效的关系, 发现不同PD-L2表达情况患者PFS、OS存在显著差异, 阳性患者接受帕博利珠单抗单药治疗后生存获益显著更佳。在治疗缓解预测方面, PD-L2甚至可能优于PD-L1, PD-L1(+)/PD-L2(+)、PD-L2(+)、PD-L1(+)/PD-L2(-)患者ORR分别为27.5%、26.5%、11.4%, 以PD-L1单阳表达缓解率最低[5]。一项纳入10例接受根治性手术NSCLC患者的小样本临床研究显示, 部分PD-L1阴性但PD-L2阳性患者依旧可实现疾病控制[36]。
上述研究不仅证实PD-L2对于PD-1单抗疗效预测潜力, 还在一定程度上揭示PD-L2有望弥补PD-L1在疗效预测上的短板。
与PD-L1类似, PD-L2检测真正用于临床需要建立经过严密验证的规范, 以保证检测结果的稳定性, 以及不同中心研究结果的可比性, 具体问题可包括:明确检测对象, 如肿瘤细胞(tumor cell, TC)或是肿瘤浸润性免疫细胞(tumor-infiltrating immunocyte, TIC); 明确活检取材规范, 如原发病灶、转移病灶或淋巴结; 液体活检的可行性; 经过验证的免疫组化检测抗体及相关标准操作规程(standard operating procedure, SOP); 设定明确的表达水平cut-off值。
如前所述, 目前免疫治疗标志物均存在各自的局限性, 而联合应用, 取长补短, 可能提升预后及疗效评估准确性的合理方向。以胰腺癌为例, 单一PD-L2无法预测患者生存预后, 而与TIC相关指标相结合, 则可有效实施预后评估[37, 38]。
现阶段, 虽然PD-L2肿瘤临床预评估方面积累了一些证据, 但免疫治疗疗效预测相关临床证据极为有限, 亟需开展大量高质量、多中心、前瞻性临床研究, 以在更广泛的瘤种中探索PD-L2的临床应用价值。
致谢:感谢默沙东(中国)投资有限公司医学部郑尧杰、牛春皓对本文提供的数据整理及文稿校对的支持。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|