作者简介:
林辉(1987-),男,江西萍乡人,医学硕士,主要研究方向为肺及头颈部肿瘤的放射治疗。
[编者按] 疾病的正确诊断和合理治疗是患者和医务工作者共同的心愿。在广东省人民医院肿瘤中心,吴一龙教授指导临床医生应用循证医学理论进行肿瘤的多学科综合治疗,开展临床病例讨论。讨论会上各学科共同围绕一个病例或一个病种进行会诊,临床、病理、B超、放射影像等资料齐全,除相关科室提前准备的中心性发言外,到会人员各抒己见,气氛热烈。参会人员受益匪浅,提高了对疑难病例的诊治水平。为了将他们的诊治经验传播出去,让更多的临床医生获益,我刊开辟“循证病例讨论”栏目,希望广大医务工作者关注此栏目。
患者张某, 男性, 52岁, 于2018年体检发现肺部结节, 未处理, 2020年4月因“ 回吸性涕血伴鼻塞3月, 加重伴右耳鸣1月” 入住放疗科, 重度吸烟者, PS 1分。入院诊断为鼻咽非角化未分化癌cT3N2M0 Ⅲ 期 [PD-L1(22C3)(大于90%+)], 右上肺腺癌cT1cN2M0 Ⅲ A期(EGFR/ALK野生型, PD-L1结果未知, 不可切除)。
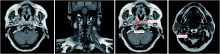
行鼻咽+颈部MRI示:鼻咽可见肿物侵犯颅底骨质, 双侧颈部淋巴结肿大, 见图1。行PET-CT示:肺部结节及纵膈淋巴结肿大, 考虑鼻咽癌转移, 不除外原发, 见图2。鼻咽活检病理示:免疫组化:PD-1(MRQ-22)(-), PD-L1(22C3)(大于90%+), PD-L1(阴性试剂对照)(-), P63(+++)。分子原位杂交检测:EBERs(+++)。诊断:(左鼻咽)非角化性未分化型癌。因肺部CT穿刺考虑出血风险大, 故于2020-05-08行超声内镜引导下的经支气管针吸活检(endobronchial ultrasound-guided transbronchial needle aspiration, EBUS-TBNA):气管下段右侧探及4R淋巴结, 呈低回声, 予行TBNA。右主支气管上段探及7组淋巴结, 呈低回声。右主支气管下段近右侧第二隆突探及右肺门淋巴结, 呈低回声。肺EBUS活检病理示:免疫组化:CK(+++), CK7(+++), TTF1(-), Napsin A(-), P40(-), P63(-), CK5/6(个别+), CK10/13(-)。分子原位杂交检测:EBERs(-)。特殊染色结果:粘液卡红(+)。诊断:(4R LN TBNA)分化差的癌, 倾向于低分化腺癌。基因:EGFR、ALK:野生型, 标本不够无法行PD-1检测。
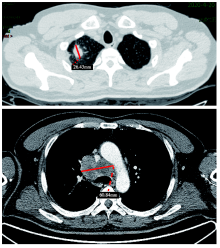
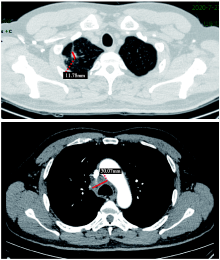
患者入院后行替雷利珠单抗 200 mg+紫杉醇 175 mg/m2 +卡铂曲线下面积(area under the curve, AUC)5, 3个疗程后复查鼻咽部MRI(图3)及肺部CT(图4)评价部分缓解(partial response, PR)。现已完成免疫+化疗5个疗程。
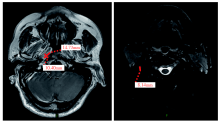 | 图3 3程化疗后2020-07-24鼻咽部增强MRIFig.3 Nasopharyngeal contrast-enhanced MRI on 2020-07-24 after 3 cycles chemotherapy |
林辉(放疗科医师):病例汇报(略)。讨论要点:双原发癌免疫加化疗后疗效达到大PR, 下一步综合治疗策略?鼻咽病灶是否可以行累及野照射?
潘燚(放疗科主任医师):目前这例患者的病史比较有意思, 双原发癌的处理原则主要有以下几点:(1)排除转移可能, 明确双原发癌的诊断; (2)分别分期, 优先治疗预后较差的肿瘤, 根据预后差的肿瘤定义根治性还是姑息性; (3)若另一预后较好的原发肿瘤有临床症状, 治疗预后较差肿瘤时应兼顾另一肿瘤的治疗; (4)如需全身治疗, 化疗方案尽量兼顾两种肿瘤。既往该类病例一般首选化疗, 化疗后再考虑是否加局部治疗。该患者与既往的双原发癌有些不一样, 该病例既往在肿瘤中心讨论过, 根据讨论意见, 肺癌预后更差, 优先治疗肺癌, 同时考虑兼顾原则建议使用紫杉醇+卡铂化疗, 先行肺部放疗, 结束后行鼻咽单纯放疗[1]。因为在泛肿瘤时代, 免疫治疗非常热门, 有效率也很高, 该病例PD-L1(22C3)(大于90%+), 同时有研究显示肺癌化疗+免疫可以提高疾病的缓解率。所以当时定的方案是化疗+免疫治疗, 目前已完成5个疗程治疗, 接下来是否需要加局部治疗?还是继续免疫治疗?
旁述:多重原发的发生率为2%~17%, 多个原发癌定义为同一患者同时或异时患有两种或以上的癌症。区分同时和异时多原发性癌定义取决于是否应用SEER(Surveillance Epidemiology and End Results)或IACR/IARC(the International Association of Cancer Registries and International Agency for Research on Cancer)规则[2], SEER规定2个月内为同时性, 超过2个月为异时性多重原发癌, 而IACR/IARC规定6个月内同时患有多种癌为同时性多重原发癌, 超过6个月患有多种癌为异时性多重原发癌。多种原发性疾病的常见危险因素如下:遗传易感性癌症、生活方式、激素和环境因素的致癌因素等。本例患者不论按照SEER或IACR/IARC规则都属于同时性多原发性癌。
马冬(肿瘤内科主任医师):目前对于这种病例没有明确的指南, 因为一般的临床研究入组标准都排除双原发癌, 所以对于这种病例一般都是靠经验和已有的文献证据来推测。该病例鼻咽的PD-L1(22C3)(大于90%+), 根据目前的文献显示可能加上免疫治疗有效率会提高, 肺部病灶虽然没办法完成PD-L1的检测, 但是化疗加免疫可能比单纯化疗有效率更高。有文献报道在头颈部肿瘤[3]及其他肿瘤免疫治疗与铂类联用可以提高PD-L1的表达[4, 5], 所以个人建议继续行化疗+免疫治疗, 化疗完成6个疗程后免疫维持治疗, 至于放疗加入的时机, 因为目前肿瘤还在继续缩小, 对当前治疗的方案是有效的, 病灶有可能达到完全缓解(complete response, CR), 可以等当前方案无效后再考虑加入局部治疗手段, 且加入前先行PET-CT评估。
周清(肺内科主任医师):该病例肺部分期为右上肺腺癌cT1cN2M0 Ⅲ A期。治疗前肺外科会诊后无法手术切除, 但是目前经过化疗+免疫治疗后肺部及鼻咽都达到了大PR, 肿瘤缩小超过50%。目前可以加入局部治疗, 但局部治疗手段有手术和放疗, 具体是手术还是放疗值得讨论。该病例肺部分期为Ⅲ A期, 不是Ⅲ B期, 经过化疗+免疫治疗后肺的纵隔淋巴结较前明显缩小, 初诊无法切除, 目前有机会可以行手术治疗, 一般对于考虑手术的患者化疗+免疫治疗一般行4个疗程左右可考虑手术, 尽量请外科考虑能否手术治疗, 如可以考虑手术完全切除, 术后仅行免疫维持治疗, 鼻咽再考虑加入放疗, 最后免疫维持。
陈晓明(介入科主任医师):目前已完成5个疗程化疗+免疫治疗, 该肿瘤全身治疗有效, 肿瘤有继续缩小, 可以考虑继续完成化疗+免疫治疗, 化疗+免疫完成6个疗程后评估, 如果肿瘤继续缩小可以考虑免疫维持治疗, 把化疗+免疫治疗的疗效达到最大化, 如果系统治疗到可以手术治疗, 肺部病灶就可以用手术解决。
董嵩(肺外科副主任医师):根据病史及影像学, 该病例化疗+免疫治疗前肺部病灶至少是Ⅲ A期不可手术病例。但是经过化疗+免疫治疗5个疗程后肿瘤明显缩小, 新辅助化疗加免疫在肺癌中作用还是有的, 许多患者能达到病理学显著缓解(major pathologic response, MPR)即新辅助化疗后残留存活肿瘤≤ 10%。目前肺部病灶不是难点, 肿瘤比较小手术很容易切除, 目前难点是纵隔淋巴结, 手术最大的难点在于肿瘤是否与上腔静脉粘连, 如果粘连明显手术完整切除可能性较小, 目前手术不能达到根治性目的, 纵隔淋巴结有部分包绕上腔静脉, 目前仅能把原发灶切除后可以评价是否能达到MPR, 纵隔淋巴结仅行采样术, 但术后还需要加上放疗。
李伟雄(放疗科主任医师):对于化疗+免疫治疗后降期的尤其是从N2降为N1的这类患者预后怎么样呢?
潘燚:目前入组新辅助免疫治疗的临床研究的病例是否只考虑可以手术的病例?临床实践一般是哪种病例呢?
董嵩:目前我们入组的临床研究患者还是考虑可以手术完整切除的, 与本例不一样。本例病例化疗+免疫前影像纵隔淋巴结与周围组织粘连致密, 化疗+免疫治疗后也难以完整切除。
潘燚:根据前面专家的意见基本达成一致:继续行化疗+免疫治疗至第6疗程后行PET-CT复查疗效, 再次请肺外科会诊探讨是否可以手术, 如可以手术优先考虑行手术治疗, 如不能完整手术切除, 考虑行根治性肺部放疗。先行肺部病灶放疗, 结束后继续完成鼻咽的放疗。
旁述:对于同时性多原发癌的治疗原则[2]主要考虑以下几点:(1)最影响预后是哪种肿瘤?治疗是根治性还是姑息性?如果姑息性转移了哪个肿瘤是转移的?(2)治疗策略应集中于局部治疗还是全身治疗?有哪些全身治疗选择?若其中一种肿瘤可以治愈, 第二肿瘤随后也可以根治吗?(3)可以预见哪些伴发问题?例如, 未治疗的大肠癌患者的肠梗阻, 广泛肝转移时的肝衰竭。(4)如果对于多原发癌需要全身治疗, 是否可以选择对多种肿瘤均有效的方案?如果没有, 多种抗肿瘤方案之间有否交集?有否相关组合的文献参考?是否可以完全针对晚期实体瘤进行全身化疗?可否以交换化疗方案的方式治疗多原发癌(例如, 对肿瘤A进行全身治疗2~3个月, 然后对选对肿瘤B有效的全身治疗)?(5)是否可以对多种肿瘤进行基因分析, 寻找共同的突变基因, 这样就可以选择一个对多种肿瘤都有效的治疗方案。
林辉:前面大家讨论的结果是需要加上放疗, 按照常规的根治性放疗目前鼻咽癌淋巴结的照射是选择性照射, 对于肺部病灶是累及野照射[6], 选择性照射区域淋巴结可能会有三种不同的效果:(1)对肿瘤局部控制率增加, 但是加重了正常组织的损伤; (2)对肿瘤局部控制率无影响, 但是加重了正常组织的损伤; (3)降低了肿瘤局部控制率同时也加重了正常组织损伤。免疫治疗时代肿瘤区域淋巴结的处理可能影响免疫治疗的疗效。因为有文献报道减少淋巴结引流区照射可能会增加免疫治疗在抗肿瘤中的疗效[7], 同时也有文献报道鼻咽癌没有淋巴结转移的患者不行淋巴结预防性照射不会增加局部区域复发率[8]。
旁述:肿瘤免疫循环的主要有以下七个环节[9]:肿瘤细胞释放抗原, 肿瘤抗原呈递, T细胞激活, T细胞向肿瘤组织迁移, 肿瘤组织T细胞浸润, T细胞识别肿瘤细胞, 清除肿瘤细胞。淋巴结结构和功能的完整在肿瘤免疫循环的七个环节中起到至关重要的作用, 首先, 抗原提呈细胞(树突状细胞)在肿瘤抗原诱导下迁移到淋巴结, 诱导免疫细胞产生特异的CD4/8+ T细胞, 最终进入肿瘤病灶清除癌细胞, 它是肿瘤免疫发生的起始部位也是维持部位; 其功能缺失将引起肿瘤免疫循环的功能损伤, 导致免疫监视失效。因此, 放疗预防性照射淋巴引流区会破坏肿瘤免疫循环的关键环节, 导致肿瘤免疫逃逸或免疫治疗失败[10]。
林辉:因为淋巴结在免疫治疗有重要作用[11, 12], 尽量减少淋巴引流区照射可能会增加免疫治疗的效果[13], 本例患者鼻咽病灶是否可以行累及野照射?
潘燚:该病例虽然是多原发癌, 但是两个肿瘤分开都可以进行根治性治疗。无论是进行手术清扫淋巴结, 还是放疗预防性照射淋巴引流区, 都将人为地破坏肿瘤免疫循环的关键环节, 导致肿瘤免疫逃逸或免疫治疗失败。免疫器官的完整对于免疫治疗的作用有重要作用[14, 15]。免疫治疗时代, 放射治疗从目前的大野照射逐步向缩小放疗野体积照射。
周清:过去对于局部晚期不可切除的非小细胞肺癌患者, 根治性治疗方案是同期放化疗或者序贯放化疗。但是其实我们看所谓的“ 根治” 的中位无进展生存期(progression-free survival, PFS)一般就5个月左右, 也就是说5个月后50%的患者复发, 但是加上免疫治疗后中位PFS可以达到15个月, 提高3倍, 这还是整体人群的效果, 对于PD-1表达高的患者获益可能更多。所以真正延长患者生存的是免疫治疗, 而不是原来传统的放化疗, 以后一般患者都会接受免疫维持治疗。免疫系统激活后会自动识别残留的肿瘤细胞, 对其进行杀灭, 比任何监视系统都能更灵敏的发现肿瘤。对于使用免疫治疗能达到大PR的这部分患者, 有可能达到治愈的效果, 对于该患者接受了免疫治疗, 如果肺部接受放疗, 随后出现免疫性肺炎的可能性较大, 虽然文献中报道的严重的肺炎的可能性小, 但是临床实践中我们发现放疗加上免疫治疗会增加患者放射性肺炎的风险。所以我建议患者如果必须接受肺部的放疗, 放疗野尽可能的缩小, 从而降低放射性肺炎的发生率。
潘燚:周主任刚刚提到放疗与外科都有异曲同工的效果, 都是根治性的治疗方法[16], 我想请教外科医生, 在免疫治疗时代淋巴结清扫的站数是否可以减少?
董嵩:淋巴结清扫的目的主要是两个:一是将转移的和可疑的淋巴结清扫达到治疗的目的, 第二个是对于原来PET-CT可疑的淋巴结进行明确, 是否有肿瘤转移。我个人认为在手术可及的范围内应该还是按照目前标准的清扫范围。
谢松喜:我也支持尽量减少淋巴引流区照射, 本例患者鼻咽病灶建议行累及野照射而不行选择性照射区域淋巴结, 肺部目前的标准治疗就是行累及野照射, 主要原因是目前肺的放射剂量对于控制原发灶的有效率不高, 对于淋巴结选择性照射意义不大。
潘燚:目前免疫维持的时间标准是多久, 对于该病例局部晚期的患者, 是有治愈机会的, 与晚期转移的患者免疫维持治疗的时间有何区别?
周清:对于晚期转移的患者目前免疫维持治疗时间一般是2年, 但是对于达到2年后是否立即停下来尚未达成共识。临床实践中一般与患者密切沟通, 如果2年后肿瘤还未达到CR, 同时患者担心肿瘤复发也是可以继续使用的。但是对于局部晚期的患者一般都是维持1年。
刘思旸(肺外科医师):我同意周主任的意见, 对于局部晚期的患者目前标准一般是维持1年, 但是可以使用ctDNA监测的方式来缩短使用免疫治疗维持时间。对于手术是否可以保留一部分淋巴结以保留一部分免疫功能目前还没有明确的证据, 但是目前新辅助免疫治疗比辅助免疫治疗的效果更好, 可能的原因就是保留了淋巴结的功能。目前的标准治疗还是根治性的淋巴结清扫。
潘燚:总结今天讨论的双原发癌的病例, 已使用化疗+免疫治疗后患者达到PR的效果。继续行化疗+免疫治疗至第6疗程结束后行PET-CT复查疗效, 再次请肺外科会诊, 是否可以手术, 如可以手术优先考虑行手术治疗, 如不能完整手术切除, 考虑行根治性放疗。先行肺部病灶根治性放疗, 结束后继续完成鼻咽部位的根治性放疗。放疗采用累及野照射。
[后记]讨论后患者完成第6程化疗+免疫治疗, 后复查影像学显示PR, 请肺外科会诊后预计无法完整手术切除病灶, 故予鼻咽+颈部68 Gy/31 F, 肺+纵隔60 Gy/30 F方案完成放疗。目前行替雷利珠单抗维持治疗中。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|