作者简介:
张嘉涛 (1993-),男,广东顺德人,在读博士研究生,主要研究方向:1.肺癌液体活检; 2. 肺癌围术期综合诊疗。
近年来, 从评估肿瘤负荷角度出发, 循环肿瘤DNA(circulating tumor DNA, ctDNA)作为评估微小残留病灶(minimal residual disease, MRD)或分子残留病灶(molecular residual disease, MRD)的研究对象在肺癌这一实体瘤中的证据不断积累, 其价值及应用前景逐步开发当中; 迎来2021年的开端, 肺癌MRD作为划时代的标志物, 已然蓄势待发。
在2017年, 引人瞩目的TRACERx研究中通过追踪前期入组100例早期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者术后血液标本, 揭示了早期肺癌术后复发ctDNA系统进化轨迹[1]。该研究在原发灶多点测序确定其单核苷酸变异(single nucleotide variant, SNV)克隆结构的基础上, 通过个体化定制的多重聚合酶链式反应技术对其中24例早期NSCLC患者术后外周血ctDNA进行动态监测。在14例复发患者中, 其中13例在影像学复发前即可在动态ctDNA中检测出至少两个SNV; 而仅有1例无复发患者的血浆ctDNA检测出两个以上SNV。这一研究也很好地体现了ctDNA的复发超前预判效能, 中位超前预判时间窗为70天(10~346天)。值得关注的是, 动态ctDNA负荷变化也反映了辅助化疗的疗效。3例患者在术后30天内即检测ctDNA阳性, 并且在辅助治疗期内, 其血浆SNV负荷仍不断升高, 并在术后1年内出现复发; 与此相反, 有1例患者, 虽然术后3天、辅助化疗前ctDNA检测阳性, 但辅助治疗完成后以及术后457天、667天均检测阴性, 而术后688天时仍无肿瘤复发。由此提示动态血浆ctDNA检测能够超前预判肿瘤复发, 同时与辅助治疗疗效具有一定相关性。
同样在2017年, 来自斯坦福大学Diehn等[2]回顾性入组40例根治性切除术后的Ⅰ ~Ⅲ 期肺癌患者及54例健康人群作为对照, 采用基于肿瘤个体化深度测序谱(cancer personalized profiling by deep sequencing, CAPP-seq)分析了入组患者的255份外周血标本。结果提示94%的肿瘤复发患者在术后首次血标本中即可检测ctDNA阳性; ctDNA检测阳性可早于约72%的影像学诊断的肿瘤复发, 中位超前预判时间窗为5.2个月。另外, 在2019年北京大学人民医院王俊教授团队公布的一项前瞻性队列研究中[3], 通过环化单分子扩增和重测序技术(circulating single-molecule amplification and resequencing technology, cSMART)对26例术前ctDNA可检出突变并最终接受根治性切除术的患者进行术后动态ctDNA监测, 同样可以看到平均超前预判时间窗为165天(12~337天); 此外, 在接受辅助治疗的17例患者中, 术后ctDNA阳性患者无复发生存期长于阴性患者(269天vs. 111天, P=0.018)。
以上证据都提示着术后ctDNA不但能超前预判患者复发, 还与术后辅助治疗密切相关, 证明MRD未来用于预测辅助治疗疗效颇有前景。
随着PACIFIC临床试验里程碑式成功, 同步放化疗后免疫检查点抑制剂(immune checkpoint inhibitor, ICI)巩固治疗已成为不可手术局部晚期NSCLC的标准治疗。在此基础上, Moding等[4]进行了一项通过MRD来预测巩固疗效的探索性研究, 该研究回顾性入组65例局部晚期NSCLC根治性放化疗(chemoradiation therapy, CRT)后患者, 其中28例患者接受了巩固ICI, 利用CAPP-seq技术对患者不同治疗时间点进行动态ctDNA监测以评估其MRD状态。在疗效预测方面, 在巩固ICI早期血液样本中ctDNA阳性的患者在CRT 1年内全部都发生了疾病进展, 而ctDNA阴性患者87.5%免于疾病进展[P < 0.000 1, 风险比(hazard ratio, HR) 84.4, 95%可信区间(confidence interval, CI) 12.3~579.9]; 更值得关注的是, 研究者通过CRT后ctDNA状态以及有无接受巩固ICI进行不同组间生存分析比较, 发现CRT后ctDNA阴性患者可能无法从巩固ICI治疗中获益, 而CRT后ctDNA阳性患者接受ICI则明显优于未接受ICI巩固治疗患者(P=0.04)。
在晚期治疗中ICI疗效与ctDNA之间的相关性证据则相对更多。2020年8月, Zhang等[5]发表了一项通过Guardant 360靶向二代测序技术分析ctDNA与ICI疗效之间的相关性研究。该研究通过入组三项Ⅰ /Ⅱ 期临床试验978例泛癌肿患者, 包括Study 1108 (durvalumab), ATLANTIC (durvalumab) 以及Study 10 (durvalumab联合tremelimumab), 其中包括171组配对治疗前后血液样本。结果提示, ICI治疗过程中ctDNA变异等位频率降低与患者无进展生存期(progression-free survival, PFS)、总生存期(overall survival, OS)与客观缓解率明确相关, 是一个明确的ICI疗效预测标志物, 而非预后标志物。同样地, 由朱波教授团队报导的另一项根据患者肿瘤组织测序结果分析其新生抗原图谱, 对接受ICI治疗的患者外周血进行个体新生抗原定制化测序追踪, 结果同样提示治疗早期的ctDNA丰度降低可预测ICI的疗效[6]。
2016年《Lancet Oncol》正式公布了一项针对肺癌寡转移多中心Ⅱ 期随机对照临床试验, 1∶ 1随机分配局部治疗组或维持治疗组, 两组PFS是11.9个月对比3.9个月(P=0.005)[7]; 而随后在2019年《J Clin Oncol》公布了此研究两组的OS分别是41.2个月对比17个月(P=0.017)[8]。当将MRD以及肺癌寡转移治疗模式联系在一起, 这引发了一个科学假设:当肺癌寡转移患者转移病灶经根治性治疗手段处理后, MRD是否可以指导下一步系统治疗方案?2019年, Tang等[9]对上述Ⅱ 期临床试验21例患者进行动态ctDNA检测(其中10例为局部治疗组), 结果提示基线ctDNA参数与患者PFS、OS无关, 而后期随访中局部干预组可观察到ctDNA负荷显著性降低, 这提示着局部干预手段对于患者整体肿瘤负荷的减轻; 此外, 在最终5例影像学复发的患者中, 同样可以看到ctDNA负荷增加, 平均超前预判时间窗为6.7个月(2.9~17.9个月)。
因此, 当寡转移患者经过局部治疗手段降低全身肿瘤负荷时, 通过MRD指导系统治疗是一个具备一定可行性的科学假设。
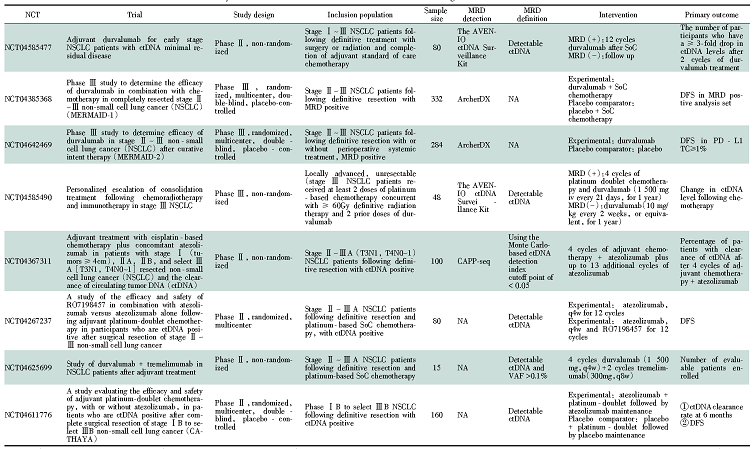
为进一步了解目前针对肺癌MRD临床研究趋势, 以(“ ctDNA” or “ minimal residual disease” or “ molecular residual disease” ) AND “ Lung Cancer” 在www.clinicaltrial.com上进行检索, 排除观察性研究, 可以看到已有不少相关研究正在进行中, 临床试验特点见表1。
| 表1 关于肺癌微小残留病灶(MRD)临床试验信息汇总 Tab.1 Summary of clinical trials for minor residual disease(MRD) in lung cancer |
从表1所列举的临床试验信息, 可以进一步总结以下几个特点:(1)目前临床试验均是通过ctDNA检测来评估肺癌MRD状态, 多采用的是多基因高通量检测模式; (2)大部分临床试验定义只要检测到ctDNA即判定为MRD阳性; (3)入组人群多为ctDNA阳性患者, 即为根治性治疗后复发高风险人群, 而随机治疗组多为较标准治疗更为积极的系统巩固治疗。
因此, 目前大部分肺癌MRD临床试验突出的是MRD的阳性预测价值, 其广义上代表患者体内累积的肿瘤负荷, 为该患者群体中高复发风险人群; 而以MRD作为治疗预测标志物的研究仍然不多。
肿瘤克隆进化耐药是肿瘤治疗失败及病情进展的重要原因, 而目前的治疗模式多为药物固定剂量规律持续用药直至肿瘤进展; 而近年来基于数字肿瘤学提出的进化博弈论模型, 提出了通过动态监测肿瘤克隆进化来决定的适应性用药模式, 从而保持肿瘤的自身瘤内竞争, 从而延缓耐药。基于此理念, 莫菲特癌症中心的Gatenby等[10]发起了一项探索性研究, 该研究入组11例去势难治性前列腺癌患者, 入组后予以阿比特龙联合泼尼松治疗, 直至前列腺特定抗原(prostatic specific antigen, PSA)降低至基线水平50%以下, 随后停药观察, 一旦患者PSA水平上升至基线水平, 则重新予以药物联合治疗; 最终结果提示运用这一适应性疗法时, 可以观察到11例患者仅有1例在第11个月时出现进展, 这已远远超过以往研究历史水平, 更重要的是, 该组患者整体用药剂量相比同一时期治疗患者降低了47%。
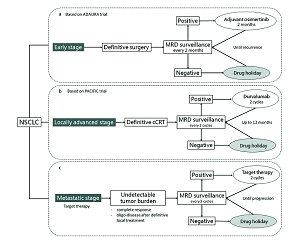
因此随着测序技术水平进一步提高, 当可以通过ctDNA检测准确评估患者体内肿瘤负荷时, 我们可以科学、合理地通过MRD监测给予肺癌患者药物假期(drug holiday), 如图1所示。从ADAURA临床试验出发, 早期表皮生长因子受体(epithermal growth factor receptor, EGFR)突变肺癌患者根治性切除术后, 通过MRD监测予以指导奥希替尼用药(图1a), 而非连续性用药模式, 理论上是否可以延缓肿瘤EGFR靶向治疗耐药克隆的发展, 从而延缓耐药?同时可以减轻患者治疗负担, 享受一段时间的“ 药物假期” ; 从PACIFIC临床试验出发, 不可手术局部晚期NSCLC患者, 经过根治性放化疗后, 通过MRD监测予以指导度伐利尤单抗维持治疗(图1b), 既可以预测ICI巩固治疗获益人群, 又可以减轻治疗负担, 享受“ 药物假期” ; 从晚期靶向治疗患者群体出发, 在患者获得完全缓解或者寡转移经局部治疗后, 通过MRD监测予以指导靶向药物使用, 让患者享受“ 药物假期” (图1c)。
目前对于肺癌MRD定义仍不完善, ctDNA检测标准仍不确定, MRD本身仍有很多问题有待进一步解决, 但相信MRD有望成为新时代下肺癌治疗的标志物, 给予患者难能可贵的“ 药物假期” , 肿瘤治疗的目标从来都不仅仅是生存期的延长, 更重要的是生活质量的提高。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|