| 朱正飞,复旦大学附属肿瘤医院放疗科主任医师,博士生导师,复旦大学附属肿瘤医院临床研究中心主任,复旦大学胸部肿瘤研究所副所长; 中国临床肿瘤学会(CSCO)青年委员会常务委员,中国抗癌协会肿瘤放射治疗专业委员会委员,中国医药教育学会肿瘤放疗专业委员会副主任委员,《Front Oncol》杂志副编辑(Associate Editor),《中国肺癌杂志》青年编委; 主要从事胸部肿瘤放射治疗及综合治疗相关的临床与基础工作; 2012年3月至2014年3月在美国MD Anderson肿瘤中心放疗科以访问学者身份学习两年; 入选上海市浦江人才计划和上海市卫健委“医苑新星”杰出青年医学人才培养计划; 以项目负责人身份承担国家自然科学基金(面上项目)、教育部留学回国人员科研启动基金、上海市自然基金、上海市卫计委课题(面上项目)等课题项目共10余项; 以第一作者/通讯作者身份发表文章40余篇,其中SCI收录论文30余篇。 |
Tang C, Lee W C, Reuben A, et al. Immune and circulating tumor DNA profiling after radiation treatment for oligometastatic non-small cell lung cancer: Translational correlatives from a mature randomized phase Ⅱ trial[J]. Int J Radiat Oncol Biol Phys, 2020, 106(2):349-357.
2b。
1995年, Weichselbaum和Hellman首先阐述了一种转移中间状态— — 寡转移, 即一种相对惰性的转移状态, 同时他们还提出, 伴有寡转移的患者或许可从局部治疗中获益, 该假设最近被两个随机Ⅱ 期临床研究证实, 伴有寡转移的非小细胞肺癌(non-small cell lung cancer, NSCLC)患者在接受根治性局部放疗后可以获得更长的无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)。具有转移潜能的肿瘤克隆数的下降, 促转移细胞因子分泌量大幅减少以及放射治疗诱导的抗肿瘤免疫或许是寡转移患者从局部放疗获益的原因。然而, 目前缺乏探索寡转移状态下局部治疗增益的潜在机制研究。
在一项Ⅱ 期随机试验中, 局部巩固治疗(local consolidation therapy, LCT)相比维持治疗或观察(maintenance therapy or onservation, MT/O)可显著延长寡转移性NSCLC患者的PFS(中位PFS为4个月vs. 12个月, P=0.005)。后续随访(follow-up, FU)数据提示, LCT同样可显著延长OS(17个月vs. 41个月, P=0.017)。为了探索LCT如何诱导外周生物标志物谱动态变化以及其与疗效的相关性, 研究者们开展了此项研究, 对循环肿瘤DNA(circulating tumor DNA, ctDNA), T细胞受体谱(T cell receptor, TCR)以及细胞因子谱进行分析。
• 研究条件:美国及英国等多中心参与研究(NCT01725165)。
• 研究时间:2012年11月28日至2016年1月19日。
• 研究方法:Ⅱ 期、前瞻性、随机、对照临床研究的探索性分析。
• 研究对象:经系统治疗后, 伴有至多3个转移灶NSCLC患者。
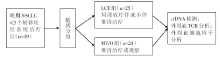
• 干预措施:干预组:所有转移灶均进行局部根治性治疗(LCT组); 对照组:维持治疗或观察组(MT/O组); 共49例患者入组, 其中LCT组25例, MT/O组24例。外周血标本留存时间点, 包括基线, 随访早期(随机后6-18周)以及随访后期(随机后22~50周)。检测方法包括TCR测序, ctDNA检测以及细胞因子检测, 见图1。
• 评价指标:检测ctDNA指标与患者PFS和OS的相关性。
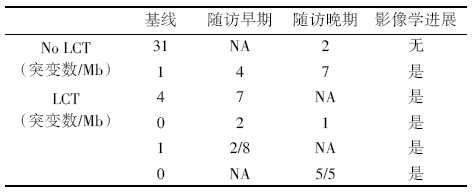
共21例进行了基于二代测序(1 021个肿瘤基因)的ctDNA检测, 其中LCT组10例, MT/O组11例; 研究结果表明, 基线ctDNA指标与OS或PFS均无相关性。6例进行了至少2次动态ctDNA检测, 包括5例在FU期间出现影像学进展, 结果如表1。
| 表1 ctDNA动态变化与影像学进展 |
共31例患者进行基于外周血的TCR分析, 其中LCT组15例, MT/O组16例; 研究结果表明, TCR指标基线及其动态变化数据均与OS或PFS无相关性。
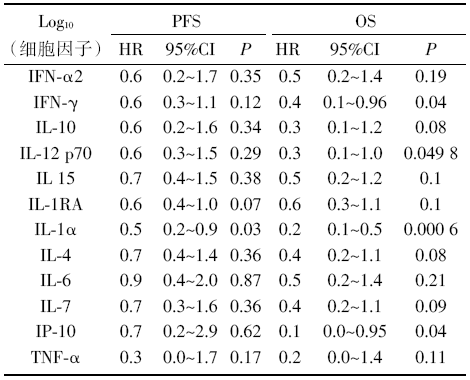
19例患者进行基于血浆的外周细胞因子分析。分析提示, 基线高水平γ 干扰素(interferon-gamma, IFN-γ )[风险比(hazard ratio, HR) 0.4, 95%可信区间(confidence interval, CI) 0.1~0.96, P=0.04], 白细胞介素12(interleukin 12, IL-12)(HR 0.3, 95%CI 0.1~1.0, P=0.049 8), IL-1α (HR 0.02, 95%CI 0.1~0.5, P=0.000 6)以及IFN-γ (HR 0.1, 95%CI 0.1~0.95, P=0.04)。诱导蛋白10与OS改善相关。而所有与OS相关的细胞因子中, 仅有IL-1α 同样也与PFS相关(HR 0.5, 95%CI 0.2~0.9, P=0.03)。基线细胞因子与患者预后见表2。
| 表2 基线细胞因子与患者预后 |
LCT与ctDNA负荷降低和寡克隆扩增相关。基线IL-1α 与患者预后改善相关。
自Wiechselbaum和 Hellman教授1995年首次提出“ 寡转移” 的概念以来, 包括放疗在内的局部治疗, 用于合并“ 寡转移” 状态的晚期实体瘤的临床价值和最佳时机, 一直是学术界研究的热点。晚期非小细胞肺癌“ 寡转移” , 主要有三种临床场景:第一种, 初治时即合并寡转移, 称为同时性寡转移; 第二种, 系统治疗一段时间后, 全身大部分病灶退缩、消失, 残留的病灶达到“ 寡转移” 状态, 称之为“ 寡残留” ; 第三种, 系统治疗耐药后, 进展的部位局限于少数几个器官和少数几个病灶, 称之为“ 寡进展” 。同步局部治疗用于同时性寡转移、巩固性局部治疗用于寡残留、挽救性局部治疗用于寡进展, 一直是探索的重点[1]。
Gomez教授主持的NCT01725165, 是最早开始探索根治性局部治疗(手术、立体定向放疗等)用于晚期非小细胞肺癌“ 寡残留” 临床价值的前瞻性、Ⅱ 期、随机对照临床试验, 在业内具有重大影响力— — 该临床研究首次证实了包括立体定向放疗在内的根治性局部治疗, 可以显著延长晚期非小细胞肺癌“ 寡残留” 患者的中位无疾病进展生存期(PFS)和总生存期(OS), 相应的结果先后发表于《Lancet Oncol》[2]和《J Clin Oncol》杂志上[3]。除此之外, 基于该临床试验所留取的外周血标本, 研究者开展了一系列的转化医学研究, 探索了ctDNA、T细胞受体组库和细胞因子, 用于根治性局部治疗的患者选择、分子机制解析以及预后判断的可行性。
ctDNA作为肿瘤负荷的替代指标, 已经在诸多癌种、各类临床场景中得到证实。本研究中发现, 接受过巩固性局部治疗的患者, 相比于传统维持治疗的患者, ctDNA的含量明显下降; 同时, 在影像学发现疾病复发进展之前, ctDNA的含量出现反弹。类似的结论, 在非小细胞肺癌各个分期、接受各类治疗前后以及各类ctDNA检测技术中, 均反复得到验证, 应该说已经是业内熟知、并且得到广泛认可的临床现象[4, 5]。
肿瘤组织中癌细胞及间质细胞会释放各类细胞因子、趋化因子和血管生成因子, 这些生物调控分子的浓度与肿瘤负荷、治疗反应和患者预后密切相关。本研究检测了19位患者基线及动态留取的外周血中36种生物调控因子的含量, 并深入分析了潜在的预后价值。结果发现, 只有IL-1α 同时与PFS和OS密切相关。IL-1α 是由巨噬细胞、中性粒细胞等促炎的免疫细胞所分泌的一种功能广泛的细胞因子, 其含量的高低与患者体内的炎症水平密切相关; 肿瘤患者基线状态的炎症水平, 在不合并细菌、病毒感染等特殊情况下, 多数时候反映的是肿瘤组织内部的抗癌免疫反应的激烈程度[6, 7]。因此, 基线状态下IL-1α 的浓度越高, 可能预示着该患者肿瘤组织内部抗癌免疫反应响应水平越高, 因此预后越好。
本研究最有趣的部分是外周血中TCR组库的动态变化。立体定向放疗用于寡转移患者, 之所以具有临床治愈的潜能, 除了高效清除少数几处可见病灶, 更重要的是借此激活全身的抗癌免疫反应, 产生更多、更强的肿瘤特异性T细胞[8]。本研究发现, 接受立体定向放疗后, 患者外周血中一方面出现新增的TCR序列, 但总体而言TCR多样性减少且呈现“ 寡头垄断” 的趋势; 另外, 丰度排名前10或前100的TCR序列, 在所有TCR序列中所占的比例, 不断增高。上述结果提示, 立体定向放疗后, 患者外周血中出现新增的肿瘤特异性T细胞; 不过, 随着肿瘤负荷大幅度下降, 总体的TCR多样性是下降的; 此外, 占主导性的TCR序列不断富集、集中, 潜在的原因之一就是肿瘤特异性T细胞被激活、并不断扩增[9]。当然, 该研究只呈现了提示性的现象, 其背后的分子机制有待深入挖掘和确认。
综上所述, 利用外周血等液体活检标本, 进行动态监测和深入分析, 在非小细胞肺癌综合治疗的疗效评价、分子机制探索和预后评估中具有重要价值, 值得进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|