| 胡洁,复旦大学附属中山医院胸部肿瘤和呼吸介入科副主任,上海市呼吸病研究所细胞和分子生物实验室副主任,专业方向肺癌筛查、晚期肺癌个体化综合治疗和靶向免疫治疗、呼吸内镜技术; 美国胸科医师学院ACCP资深会员(FCCP); 兼任中华医学会呼吸病学分会(CTS)肺癌专业委员会委员、中国医师协会呼吸医师分会(CACP)肺癌专业委员会委员兼秘书、中国肺癌防治联盟免疫治疗委员会副主任委员兼秘书、中国临床肿瘤学会(CSCO)免疫治疗专家委员会委员、中国抗癌协会化疗专业委员会委员; 任《JCO中文版》编委、《国际呼吸杂志》和《J Thorac Dis》杂志通讯编委; 承担多项国家自然科学基金和上海市自然科学基金课题。 |
Ai X, Cui J, Zhang J, et al. Clonal architecture of EGFR mutation predicts the efficacy of EGFR-tyrosine kinase inhibitors in advanced NSCLC: A prospective multicenter study (NCT03059641)[J]. Clin Cancer Res, 2020. doi: 10.1158/1078-0432.CCR-20-3063.
2b。
多位点取样测序是研究肿瘤克隆结构的标准方法, 而单位点取样测序可能会将亚克隆肿瘤细胞误判为主克隆肿瘤细胞。由于多位点样本的可获得性受限, 晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)的肿瘤克隆结构及其对患者临床结局的影响尚不清楚。
• 研究配对肿瘤组织和循环肿瘤DNA(circulating tumor DNA, ctDNA)高通量测序作为分析晚期NSCLC克隆结构的可行性。
• 研究肿瘤克隆结构对晚期NSCLC患者临床结局的影响。
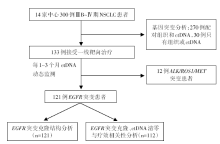
• 研究条件:国内14家中心、前瞻性观察性TRACELib研究(NCT03059641)。
• 研究时间:2017年2月至2019年12月。
• 研究对象:300例诊断明确的Ⅲ B~Ⅳ 期初治NSCLC患者。
• 研究方法:基于靶向捕获测序方法, 对配对的肿瘤和ctDNA样本进行1 021个基因的高通量测序, 然后在PyClone的基础上进行克隆结构分析。
• 干预措施:TRACELib研究流程见图1。
• 评价指标:肿瘤克隆结构, 客观缓解率(objective response rate, ORR)和无进展生存期(progression-free survival, PFS)。
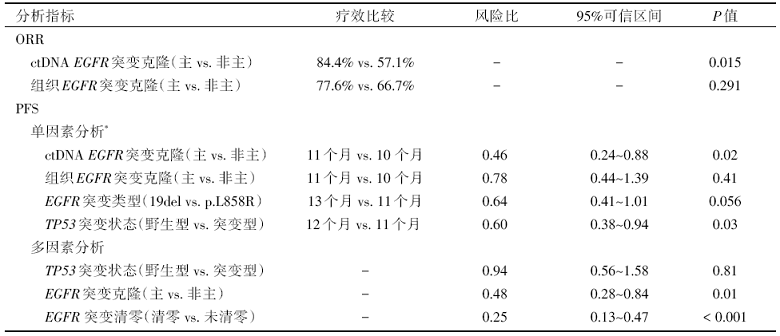
EGFR突变组和ALK/ROS1/MET突变组的ORR为74.4%和72.7%, 中位PFS分别为10.5个月和12.9个月。该研究进一步分析了EGFR突变克隆结构及与EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)疗效相关的因素, 具体结果见表1、表2。
| 表1 ctDNA和肿瘤组织EGFR突变克隆的一致性* |
* 67.8%(82/121)EGFR突变患者同时在组织和ctDNA检测到EGFR突变。
| 表2 影响EGFR-TKI疗效因素分析 |
* ctDNA或组织EGFR突变丰度(P=0.23和0.37)和肿瘤突变负荷高低对PFS无影响。
无论是ctDNA还是肿瘤组织, 均显示EGFR突变主克隆患者的肿瘤克隆种类更少, 但基因突变数目无区别。在ctDNA和肿瘤组织中均是EGFR突变主克隆的患者(n=43), 其ORR(83.72% vs. 37.5%, P=0.013)和PFS(11个月 vs. 6个月, P=0.003)明显好于EGFR非主克隆突变患者(n=8)。
配对组织和ctDNA检测可以用于晚期NSCLC的克隆结构分析; 在EGFR突变晚期NSCLC中, EGFR突变肿瘤细胞并不总是肿瘤主克隆群体; EGFR突变主克隆患者接受靶向治疗的疗效较非主克隆患者更好。
EGFR突变晚期非小细胞肺癌(NSCLC)对一线EGFR酪氨酸激酶抑制剂(TKI)治疗有不同响应, 其内在机制是众多学者关注的焦点。TRACELib001研究是国内首次从肿瘤克隆进化的角度探索了肿瘤异质性与治疗药物疗效之间的相关性。
TRACELib001研究在国内14家中心共前瞻性入组300例未经治疗的晚期NSCLC患者, 最终检测出121例EGFR敏感突变NSCLC并接受一线EGFR-TKI治疗, 基于其中82例具有合格的组织和ctDNA配对标本进行包含1 021个基因的大panel二代测序(next generation sequencing, NGS)基因检测, 用Pyclone贝叶斯聚类分析方法进行克隆结构分析。
研究发现无论是组织抑或是血浆标本, 约77%EGFR突变位于主克隆, 即并非全部EGFR突变均位于主克隆。EGFR突变的克隆属性差异与患者吸烟史、疾病分期、EGFR突变类型、EGFR-TKI药物选择无显著相关。不同EGFR突变的克隆属性, 其肿瘤相关基因变异数量相近, 但亚克隆具有更高的聚簇数。
进一步对121例接受EGFR-TKI治疗疗效相关性的分析显示, 主克隆EGFR突变者接受EGFR-TKI一线治疗的PFS和ORR均显著优于亚克隆患者。且当组织和ctDNA检测对EGFR突变克隆属性的判定结果一致时, 与疗效差异的相关性更为显著(n=43 vs. n=8, ORR: 83.7% vs. 37.5%, PFS: 11m vs. 6m)。
研究比较了其他已知可能潜在影响EGFR-TKI疗效的因素, 如EGFR突变亚型、等位基因突变频率(variant allelic frequency, VAF)、伴随基因突变数量、肿瘤突变负荷(tumor mutation burden, TMB)等均未发现有统计学意义的PFS差异。TP53伴随突变和EGFR突变清除影响EGFR-TKI疗效的结论与既往研究结果一致, 但此两项因素与EGFR突变克隆属性不相关。多因素分析表明EGFR突变的克隆属性是EGFR-TKI一线治疗疗效的独立预测因子。
本研究首次从肿瘤克隆进化的角度提出影响EGFR-TKI疗效的预测因子, 在以下三方面为我们认识理解并深入探索EGFR突变NSCLC提供有力帮助:
(1)对全面评估晚期肺癌异质性的技术方法和平台提供了有力证据。
肿瘤的时空异质性普遍存在[1, 2, 3, 4]。实体瘤在进化过程中常见的分支进化(即主干克隆进化形成不同分支克隆, 分布于空间上的不同区域)又进一步使异质性更为复杂化。通常需要对肿瘤组织进行多区域全面测序方有可能较为全面展现肿瘤的异质性。但对于晚期肺癌患者多点取样在临床实践中难以广泛应用和推广, 难度大。因此本研究通过结合配对组织和ctDNA样本, 并对ctDNA动态监测, 展示了对晚期NSCLC患者进行全面评估异质性的一种可行方式。
(2)首次提出EGFR克隆属性是一种新的EGFR-TKI疗效独立预测因子。
已有多项研究关注EGFR-TKI的疗效预测因子[5, 6, 7], 组织和ctDNA标本均可进行检测, 但ctDNA肿瘤突变基因的检出率受多种因素影响。本研究结果表明组织标本和ctDNA检测的一致性为77%, 肿瘤负荷、VAF、基因突变类型(缺失)等是影响ctDNA检出率和一致性的主要原因, 相比之下, 基于Pyclone贝叶斯聚类方法的克隆结构分析对揭示TKI疗效相关性可能相对更为稳定, 研究结果也证实基于ctDNA的克隆性结构定位不影响与疗效相关性分析的最终结果。
(3)对EGFR突变晚期NSCLC患者一线优化治疗策略提出新的思考。
多项研究表明EGFR-TKI联合化疗或抗血管生成治疗较EGFR-TKI单药显著改善患者生存, 但随之付出的是安全性、药物经济学、依从性等方面的代价[8]。本研究发现约1/4的EGFR突变并非位于主克隆, 对EGFR-TKI响应低, PFS短。因此, 对于这部分患者我们是否有必要进一步分析主克隆的基因构成采取初始联合治疗, 或进行动态监测在早期发现EGFR突变亚克隆形成时引入联合靶向治疗等, 这些一线治疗策略都有待于开展更多巧妙设计的临床研究来回答。
当然, TRACELib001研究对肿瘤克隆性结构分析与EGFR-TKI原发耐药机制的相关性尚未进一步阐明。肿瘤克隆性分析所采用的超过1 000个基因以上的大panel检测和生信分析在临床上推广普及应用也存在一定难度。但这些都不影响TRACELib001研究为首次从肿瘤进化克隆异质性的角度提出EGFR突变晚期NSCLC与EGFR-TKI疗效相关性这一开创性成果。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|