| 张绪超,医学博士,博士生导师。广东省人民医院(广东省医学科学院)肿瘤中心研究员、广东省肺癌研究所所长、华南理工大学第一临床学院研究生导师、南方医科大学第二临床学院研究生导师、广东省肺癌转化医学重点实验室副主任。兼任中国临床肿瘤学会(CSCO)理事会常务理事、CSCO肿瘤生物标志物专家委员会秘书、广东省转化医学会肿瘤学分会主任委员、广东省抗癌协会肺癌专业委员会常务委员、广东省抗癌协会靶向治疗专业委员会副主任委员、广东省抗癌协会分子诊断委员会候任主任委员、广东省药理学会肿瘤药理专业委员会副主任委员、美国临床肿瘤学会(ASCO)会员、美国癌症研究协会(AACR)会员、欧洲肿瘤内科学会(ESMO)会员、国际肺癌研究协会(IASLC)会员。 研究方向为肿瘤的分子标志物与转化应用研究,主要涉及癌症预测预后分子标志物、肿瘤的细胞与分子异质性、肿瘤免疫微环境、癌症转移机制、肿瘤遗传变异检测技术等; 着重在肿瘤的临床分子靶点和相关信号通路分析及肿瘤进化和耐药机制方面开展研究; 获得国家自然科学基金2项,省部级科研基金多项; 参与“863”课题、卫计委行业专项及国家自然科学基金多项; 获得国家科技进步奖二等奖1项、中华医学会医学科技一等奖1项、广东省科技成果奖3项; 入选2018广东省杰出青年医学人才; 在《Science》增刊发表综述,在《Nat Commun》、《J Clin Oncol》、《Ann Oncol》、《Clin Cancer Res》、《J Thorac Oncol》、《Mol Cancer》等杂志以第一作者、共同第一作者或参与作者发表SCI文章50余篇。 |
Chabon JJ, Hamilton EG, Kurtz DM, et al. Integrating genomic features for non-invasive early lung cancer detection[J]. Nature, 2020, 580(7802):245-251.
1b。
低剂量螺旋CT是目前肺癌早筛的主要方法, 但是其较高的假阳性率和较低的依从性仍然限制了它的应用率。
液体活检特别是循环肿瘤DNA(circulating tumor DNA, ctDNA)的检测已经成为晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者诊治的参考, 但是因为ctDNA在早期NSCLC患者的低检出率, 与血液中非肿瘤衍生突变的影响, 限制了ctDNA检测在早期NSCLC早诊模型中的应用。
明确NSCLC患者中肿瘤来源的ctDNA的分子特征, 拟通过机器学习建立一套基于血液来源DNA检测NSCLC的早诊模型。
• 研究条件:美国斯坦福大学、MD Anderson癌症中心等5个研究中心参与。
• 研究时间:2009年11月至2018年7月入组训练集(discovery cohort)患者; 2018年1月至2018年12月入组验证集(validation cohort)患者。
• 研究方法:多中心、非随机、非对照临床研究。
• 研究对象:目标人群为术后或者根治性放疗后确诊为Ⅰ ~Ⅲ 期NSCLC患者, 对照人群为年龄、性别、吸烟史高度匹配的非癌症患者及健康成年献血者, 主要对入组患者的ctDNA、白细胞DNA行基因检测。
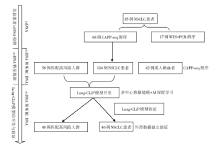
• 干预措施:Lung-CLiP模型研究的研究流程见图1。
• 评价指标:ctDNA的检出率, 诊断模型的敏感度、特异度及整体诊断效能。
本文研究团队采取了一系列措施对CAPP-seq测序方法进行了优化:(1)双端接头引物的改进; (2)双重UID错误纠正; (3)使用ROS清除剂降低体外PCR扩增氧化损伤等。采用255固定基因panel的NGS技术, 在85例Ⅰ ~Ⅲ 期NSCLC患者中, 有38例(38/85, 45%)患者检测到ctDNA。在17例固定panel方法未检出ctDNA的患者中, 利用基于全外显子测序结果的定制化基因panel的超深度测序方法, 有10例患者可以检测到ctDNA[中位等位基因变异频率(variant allele frequency, VAF) 0.002%]。使用优化后CAPP-Seq方法结合定制化基因panel的超深度测序方法, 在85例受检NSCLC患者中, ctDNA的检出率在Ⅰ 、Ⅱ 、Ⅲ 期中分别为42%、67%和88%。ctDNA的水平与肿瘤分期, 病理组织类型及PET-CT上代谢肿瘤体积有关。治疗前的ctDNA水平越高的患者无病生存期(P=0.026)、无转移生存期(P< 0.001)明显较短。
在本研究中, 58%的NSCLC患者及90%的高风险非癌症患症的游离DNA(cell-free DNA, cfDNA)中都能检测到克隆性造血相关突变, 如DNMT3A, TET2, TP53, PPM1D及SF3B1基因等。通过对NSCLC患者、高风险非癌症患者和健康成年献血者的cfDNA突变谱进行分析, 发现NSCLC患者中, 存在突变的cfDNA片段大多短于无突变cfDNA片段, 整体分布不均一, 而且其突变基因多与吸烟相关。而高风险非癌症患症及健康成年人患者中, 存在突变的cfDNA片段与无突变cfDNA片段大小分布基本相同, 整体分布均一, 且其突变基因多与衰老有关。
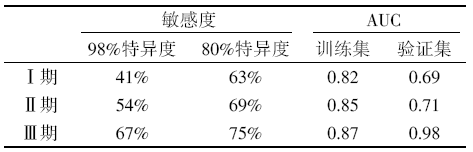
在提取到这104例NSCLC来源的ctDNA突变特征谱及56例高风险非癌症患症克隆性造血相关突变的特征谱之后, 本文研究团队通过人工智能进行深度学习之后开发了Lung-CLiP模型。根据训练集中ctDNA与白细胞的基因检测结果, 赋予不同的cancer likelihood score来判定患者是否存在肺癌可能。在98%的特异度下, 模型对Ⅰ 、Ⅱ 、Ⅲ 期患者的敏感度分别为41%、54%和67%。在80%的特异度下, 模型对Ⅰ 、Ⅱ 、Ⅲ 期患者的敏感度分别为63%、69%和75%。在受试者工作特性曲线中, Lung-CliP模型在训练集中对Ⅰ 、Ⅱ 、Ⅲ 期患者的曲线下面积(area under curve, AUC)分别为0.82、0.85和0.87。在麻省总医院的外部独立验证数据中, Lung-CLiP模型对Ⅰ 、Ⅱ 、Ⅲ 期患者的AUC分别为0.69、0.71和0.98。Lung-CLiP模型的诊断效能见表1。
| 表1 Lung-CLiP模型的诊断效能 |
本研究发现与克隆性造血相关的突变相比, NSCLC患者的cfDNA突变较多发生在更短的片段上, 且与吸烟相关。基于此类特征开发出的Lung-CLiP模型可以将NSCLC患者与高风险非癌症患症区分开。
肺癌是在全球和我国范围内发病和死亡均排前列的肿瘤疾病。加强预防, 结合早诊早治是减少患病和死亡的关键。低剂量螺旋CT用于高危人群的肺癌早期筛查能够显著降低癌症相关死亡率。但在实际工作中, 在很多适合筛查的人群并没有得到广泛应用。液体活检技术的进步使得其应用越来越广泛。如何将血浆游离DNA结合深度测序技术用于肺癌等高危人群的筛查一直是研究热点。在这个领域, 技术正在获得突破并有望尽快实现应用。
2020年2月, Alizadeh和Diehn等在《Nature》主刊发表文章[1], 他们建立了基于二代测序(next generation sequencing, NGS)和机器学习的Lung-CLiP (lung cancer likelihood in plasma)的检测技术, 能够超敏感地从血液游离DNA中分析出早期肿瘤患者。这篇文章是在2015发表于《Nat Med》的成果[2]的基础上, 又一篇基于NGS的超敏感肿瘤突变分析技术应用于早期诊断肺癌的成果。先前的超敏感分析技术是CAPP Seq(cancer personalized profiling by deep sequencing), 即癌症个体化深度测序分析, 该技术将在血液游离DNA中分析循环肿瘤DNA(circulating tumor DNA, ctDNA)的突变位点份数(mutation allele fraction, MAF)检测限(limit of detection, LoD)推进达到0.02%。这次报告的主要成果有:(1)根据分子特征, 包括单核苷酸变异(single-nucleotide variant, SNV)和拷贝数变异(copy number variation, CNV), 结合机器学习法, 研发并验证了一款名为Lung-CLiP的肺癌早检方法。该方法敏感, 与其他基于肿瘤突变已知(tumor-informed)的ctNDA检测方法相媲美, 能够区分患者与对照人群; (2)ctDNA在大部分早期肺癌患者都能被检测到, 且与生存预后强烈相关; (3)无论是肺癌患者, 还是经危险因子匹配的对照人群, 血浆游离DNA中的多数体细胞突变都来自于克隆性造血; 与肿瘤来源的突变相比, 克隆性造血相关突变发生在更长的DNA片段上, 而且缺乏吸烟相关的突变标签特征。
Lung-CLiP方法可根据临床应用场景需求来适当调整特异度, 而改善检测敏感度, 特别是为肺癌的早期筛查和诊断, 提供了敏感的技术方法。在解读中, 结合其他相关文献, 我们应该理解以下几点:第一, 技术上将分析性能大大提高。该方法通过生物信息分析、抑制杂交捕获过程中鸟嘌呤(G)碱基氧化、文库构建过程创新性引入双重接头序列, 减少了假阳性或引入性错误突变, 大大提高了早期患者肿瘤突变的检测能力。在85例早期患者中, 收集血液分离游离DNA(cell-free DNA, cfDNA), 应用覆盖225个基因和335 kb长度的CAPP-Seq通用群体测序集(测序范围)方法, 可检测出45%(38/85)的患者。而在17例有肿瘤组织全外显子组测序(whole exome sequencing, WES)的基础上, 增加已知突变的覆盖和检测数量, 改良的自定义测序集方法可检测出59%(10/17)的患者。变异位点频率的中位检测值为0.002%, 最低水平达到2.9/106, 分析性能方面可谓极其敏感。综合68例接受通用测序集方法和17例接受自定义测序集方法的结果, 可见在Ⅰ 、Ⅱ 、Ⅲ 期肺癌患者中检测敏感度分别为42%(20/48), 67%(14/21)和88%(14/16)。如果只考虑检测能力达到0.01%以下的受试者, 肺癌检测敏感度则分别提升至64%(14/22), 82%(9/11)及100%(10/10)。在上述分析性能提高的基础上, 结合拷贝数变异和机器学习法, 建立的Lung-CLiP得分在训练集的104例早期肺癌患者及56例对照人群中:若设定特异度为80%, 在Ⅰ 、Ⅱ 、Ⅲ 期患者中敏感度分别为41%、54%和67%; 若设定特异度为95%, 在Ⅰ 、Ⅱ 、Ⅲ 期患者中敏感度分别提升为63%、69%和75%。更进一步, 在验证队列中, 入组了前瞻性的46例早期肺癌和48例对照, 获得了相似的特异度和敏感度。第二, 早期疾病中敏感方法检测到的ctDNA具有强烈的预后意义。ctDNA的MAF中位值(0.003 1%)为界值, 无论在Ⅰ 期还是Ⅰ ~Ⅲ 期患者中, 疾病无复发生存时间(recurrence-free survival, RFS)均有显著性差异, ctDNA高的患者RFS较短。且在后续随访发现, ctDNA高的患者易发生远处转移。在验证队列中还发现Lung-CLiP得分与肿瘤病灶大小具有很好的相关性。这与早先的CRUK的Swanton课题组的研究结果相一致。第三, 克隆性造血对突变检测的影响。随着液体活检NGS应用的增多, 血浆DNA中的突变辨认和解读对临床决策很重要。该研究及其他文献都已经提示多数突变来自于克隆性造血相关基因, 如DNMT3A, TET2及TP53等。TP53基因是肿瘤中最常见的突变基因, 如何辨认血液检测TP53突变是真正的实体瘤来源的还是克隆性造血来源的就很重要, 可能会影响临床决策。可能需要通过测序的DNA片段长度及其中的烟草相关突变标签加以区分。
除了上述分析, 我们还应思考Lung-CLiP的最佳应用场景应该是什么。如果用于高危人群的早期是筛查, 是独立检测出早期肺癌患者还是与其他筛查手段相结合?该文作者提出Lung-CLiP方法对低剂量螺旋CT是重要的补充。现阶段在美国, 有约95%适宜筛查的高危人群并未做CT筛查, 因此血液检测用于早期诊断是重要的补充。这个概念也正在得到更多的验证, 2020年Kinzler, Vogelstein和Papadopoulos课题组在《Science》发表了基于16个基因及9个血液蛋白标志物的辅助筛查技术也验证了这种应用能力[3]。该文章展示了CancerSEEK早期癌症检测方法能够在前瞻性的队列中发现早期肿瘤患者而接受根治性治疗, 并对肺癌、乳腺癌、结直肠癌的常规标准早期发现方法有重要的补充作用。
另一方面, 我们还应考虑如何进一步提高血液检测技术的分析性能。理论上, 大家都期望“ 一滴血” 就能够解决疾病状态的判断。除了该篇研究, 2020年Rosenfeld等在《Sci Transl Med》发表了用于微小疾病的监测或检测[4], 应用INVAR(INtegration of VAriant Reads, 即变异reads整合分析)的算法, 在获取肿瘤组织突变位点(通常每个外显子组达到数百个突变)信息的基础上, 采用自定义靶向捕获测序, 并在减少检测错误、扩展检测范围、提高覆盖突变数量的基础上, 能够将整合突变位点份数(integrated MAF, IMAF)值推进至百万分之一(1/106)。值得一提的是, 这里的IMAF是整合了背景信号差减、每个位点的加权MAF、及测序片段大小加权的综合算法。这种方法在很大程度上克服了临床上常见的血浆DNA量不足的问题, 只需要少至个位数ng级cfDNA的量就能应用。
外周血检ctDNA的技术敏感度受到DNA量、已知突变位点数量两个重要因素的影响。如果进一步采用肿瘤组织和血浆DNA的同步进行WES, 则需要200X的数据量, 或是更浅的浅至1X的全基因组测序(whole genome sequencing, WGS)数据量就可以分别达到1/104和1/103的敏感度。
相信随着技术的进步, 一方面随着WES、WGS技术及新的算法的普及应用, 另一方面, 除了碱基序列和拷贝数变异, 其他类别的标志物如肿瘤基因组甲基化标签的分析技术应用[5], 在未来使用少量血液就可以进行癌症疾病早期筛查、早期检测或微小疾病监测, 甚至能够实现“ 一滴血检测癌症” 的理想。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|