| 朱波,陆军军医大学第二附属医院肿瘤科主任医师,教授,博士生导师;国家杰出青年基金、优秀青年基金获得者,重庆市肿瘤免疫与免疫治疗重点实验室负责人;围绕肿瘤免疫微环境,聚焦免疫调控细胞与分子机制,密切结合临床开展科学研究;首次发现肿瘤导致髓外造血红系发育受阻,并转分化成髓性细胞,参与系统性和肿瘤局部抗肿瘤免疫抑制形成;近年来以通讯作者在《Nat Med》、《J Clin Invest》和《Nat Commun》等杂志发表论文50余篇;兼任中国临床肿瘤学会(CSCO)患者教育专家委员会主任委员、中华医学会肿瘤学分会委员会副主任委员、CSCO免疫治疗专家委员会副主任委员等职;兼任《Oncogene》杂志副主编(Associate Editor)及国内外多个期刊的编委及审稿人;荣获“全国百篇优秀博士论文”、“中国青年科技奖”等荣誉。 |
Zhang Q, Luo J, Wu S, et al. Prognostic and predictive impact of circulating tumor DNA in patients with advanced cancers treated with immune checkpoint blockade[J]. Cancer Discov, 2020, 10(12):1842-1853.
2b。
用于监测免疫检查点抑制剂治疗反应的生物标志物很少, 尤其是可用于多种癌症类型的生物标志物。既往文献表明, 在接受程序性死亡配体-1(programmed death ligand 1, PD-L1)抑制剂治疗的患者中, 循环肿瘤DNA(circulating tumor DNA, ctDNA)早期降低与生存改善相关。
探索ctDNA作为接受免疫治疗的晚期肿瘤患者生物标志物的作用。
• 研究条件:3项Ⅰ /Ⅱ 期免疫治疗临床试验(Study 1108, ATLANTIC, Study 10)患者标本; Guardant Health实验室进行ctDNA检测(获CLIA / CAP认证)。
• 研究方法:探索性研究(生物标志物)。
• 研究对象:来自Study 1108, ATLANTIC, Study 10临床试验的978例晚期实体瘤患者814例治疗前肿瘤样本。入组标准:接受度伐利尤单抗± 细胞毒性T淋巴细胞抗原4(cytotoxic T-lymphocyte-associated antigen-4, CTLA-4)抑制剂治疗。
• 干预措施:收集患者免疫治疗前及初次用药后6~8周的标本, 二代测序(next generation sequencing, NGS)检测已知的73个体细胞癌基因的ctDNA变异情况(单核苷酸变异, 插入/缺失突变, 基因扩增和基因融合)。研究路线见图1。
• 评价指标:客观缓解率(objective response rate, ORR), 无进展生存期(progression-free survival, PFS), 总生存期(overall survival, OS), 分子缓解率(molecular response rate, MRS)。
ctDNA的平均变异等位基因频率(variant allele frequencies, VAF)与PS评分(P=0.000 4)、有无肝转移(P< 0.000 1)、肿瘤负荷(P< 0.000 1)有关; 与有无淋巴结转移、治疗线数、吸烟史、肿瘤细胞或免疫细胞PD-L1表达无关。
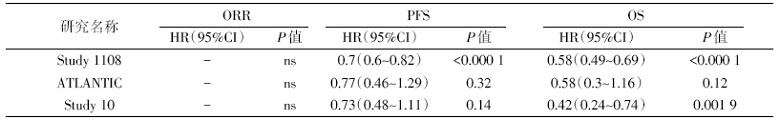
治疗前ctDNA的水平与OS呈负相关, 与免疫治疗缓解情况无关(n=978), 治疗前VAF与免疫治疗疗效和生存的关系见表1。
| 表1 治疗前VAF与免疫治疗疗效和生存的关系 |
治疗中ctDNA与免疫治疗缓解情况、PFS、OS负相关(n=171), 治疗中VAF与免疫治疗疗效和生存的关系见表2。
| 表2 治疗中VAF与免疫治疗疗效和生存的关系 |
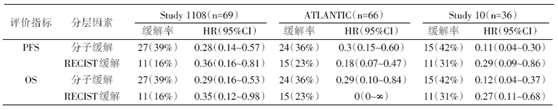
分子缓解:治疗中VAF/治疗前VAF, > 50%为分子未缓解, < 50%为分子缓解。与单纯治疗中VAF相比, 基于比率的分子缓解与RECIST缓解相关性更强(分子缓解:AUC=0.82, 95%CI 0.71~0.93; 治疗中VAF:AUC=0.73, 95%CI 0.61~0.85)。分子缓解对比实体瘤疗效评价标准(Response Evaluation Criteria In Solid Tumors, RECIST)缓解与免疫治疗疗效和生存的关系见表3。
| 表3 分子缓解vs. RECIST缓解与免疫治疗疗效和生存的关系 |
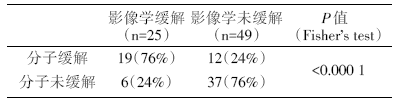
三组中有74例第一次疗效评估为疾病稳定(stable disease, SD), 在最终达到影像学缓解的患者中, 76%有分子缓解; 未达到影像学缓解患者中, 24%有分子缓解(P< 0.000 1), 见表4。
| 表4 初始SD患者中影像学缓解与分子缓解的比较 |
对于第一次疗效评估为SD的患者来说, 分子缓解可比影像学缓解提前8周出现, 比分子未缓解的患者肿瘤缩小比例更大(P< 0.000 1)。
初始SD患者, 分子缓解组与分子未缓解组的生存比较见表5。
| 表5 分子缓解vs分子未缓解生存期比较 |
治疗前ctDNA水平能提示免疫治疗预后, 治疗中ctDNA及其动态变化对免疫治疗疗效具有预测作用。
近年来, 以免疫检查点抑制剂(immune checkpoint blockade, ICB)为代表的免疫治疗始终是国内外肿瘤治疗领域关注的研究热点, 在晚期实体肿瘤治疗方面可以称之为革命性的突破。但是, 由于免疫相关不良反应、原发性/继发性耐药、或病灶快速进展等原因[1, 2, 3], 只有少部分患者可以从ICB治疗中长期获益。因此, 亟需能够有效判断预后和监测治疗应答的工具来帮助临床医生更有依据的做出临床决策。相比于肿瘤突变负荷(tumor mutation burden, TMB), PD-L1, 错配修复缺陷(deficient mismatch repair, dMMR)等已得到广泛应用的生物标志物, 循环肿瘤细胞DNA(circulatory tumor DNA, ctDNA)携带有肿瘤细胞的遗传信息, 可以以无创、动态的方式取得并加以检测, 在分子病理分型、残余病灶监测、预后判断等方面有着广泛的应用[4]。已有研究表明, 在非小细胞肺癌(non-small cell lung cancer, NSCLC)和泌尿系统肿瘤(urinary carcinoma, UC)中, ctDNA的变异等位基因频率(variant allele frequency, VAF)在治疗前后的动态变化与临床预后具有很强的相关性, 治疗早期患者VAF减少可预示该患者较大可能从ICB治疗中获益[5]。基于已有结果, Zhang等的研究[6]尝试证明ctDNA VAF在泛癌种中依然可以作为判断预后的有效手段, 同时探索治疗前后VAF的变化是否可以用于预测患者的长期获益情况。
该研究在Study 1108、ATLANTIC及Study 10研究中收集了横跨16个瘤种, 共计978例患者接受ICB治疗前的ctDNA样品进行了检测, 其中171例患者在治疗开始后6~8周时接受了二次ctDNA检测[6]。研究结果表明, 无论是治疗前VAF、治疗中VAF还是治疗前后VAF的差值均在泛癌种中具有预后判断价值, 其中治疗前和治疗中较低水平的VAF、以及在治疗中VAF有所降低的患者表现出更低的死亡风险及更长的生存时间。研究结果还表明其构建的“ molecular response” 模型不仅可以作为预后的标志物, 还在预测患者的ORR上比治疗中VAF更为敏感与特异(比例模型AUC:0.82, 95%CI:0.71~0.93; 治疗期内AUC:0.73, 95%CI:0.61~0.85)。与此同时, 该模型还可从早期影像学评估为SD的患者中区分出最终会从ICB疗法中长期获益的患者, 可以作为常规影像学评估手段的一个补充。
进一步分析该研究的结果。首先, “ molecular response” 模型的最终形式并非由该研究最初提出的线性模型经数学公式推导而来, 而是在研究过程中根据研究现象近似得到, 尽管研究者在两个独立数据集中进行了验证, 但由于目前没有标准化的ctDNA检测流程[4], 该近似结果是否能够在其他临床试验所收集到的患者中成立需要更进一步的证明。其次, 从临床实践角度看, 计算该模型需要治疗中VAF的数据, 这意味着患者在开始ICB治疗后6~8周需要重新进行ctDNA检测, 造成了一定程度的经济负担。第三, 本研究中治疗中ctDNA检测的时间点均为首次接受ICB治疗后6~8周, 该时间点是否最佳时间点是需要思考和进一步研究的。目前已有关于ctDNA动态监测的研究结果显示, 部分患者VAF的水平在治疗期内随着时间的推移, 表现出较为明显的波动性[7, 8, 9], 即使这部分患者最终可能长期受益, 但其某一时间段内的VAF较治疗前会有短时间升高的可能性, 若恰好选择该时间段作为治疗期内的采样节点, 则可能得到相反的结果。第四, 在该研究使用的阈值下, 仍有24%的患者在影像学评估为SD且比例模型评估为非获益者的情况下最终长期获益, 临床实践中如何辨别这类“ 双阴性” 患者并使之持续进行治疗是一个亟待解决的问题。最后, 由于研究中未使用白细胞的匹配测序来去除胚系突变的影响, 可能会导致ctDNA假阳性的结果, 使得本来低VAF的患者由于上述原因获得相反的预后结果或失去持续治疗的机会。
未来ctDNA的发展方向, 一方面需要继续关注其在癌症早筛、治疗评估和复发检测等领域的应用潜力; 更亟需探索如何建立标准化和规范化的ctDNA检测流程, 以用于转化研究目的并在常规临床实践中推广, 使之成为现有检测手段的补充或替代方案。同时, 临床医生应了解ctDNA检测与肿瘤组织检测各自的优缺点与基本的技术特征, 并在解释检测结果时评估假阳性和假阴性的可能性。尽管ctDNA技术存在明显的优缺点, 但其同样具有改善癌症治疗的应用前景, 我们期待着ctDNA技术的早日成熟, 期待更多关于ctDNA技术应用的研究可以帮助肿瘤患者获得更为科学合理的临床诊治, 最终实现生存获益。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|