作者简介:
邓秋梅(1994-),女,广东清远人,硕士研究生,主要研究方向为肺癌的靶向治疗。
目的 间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)融合基因是非小细胞肺癌(non-small-cell lung cancer,NSCLC)一个重要亚型,靶向ALK的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)显著改善了这一类患者的临床治疗结局。遗憾的是,大部分患者经过一段时间的ALK-TKI治疗之后终会产生耐药。研究发现其主要耐药机制包括 ALK继发性耐药突变、 ALK基因扩增、旁路及下游通路激活等。本研究旨在探讨ALK-TKI克唑替尼耐药的分子特征。方法 我们回顾性收集了广东省肺癌研究所从2016年1月到2020年12月通过Ventana免疫组化(immunohistochemistry,IHC)、荧光原位杂交技术(fluorescence in situ hybridization,FISH)、组织或液体二代测序(next-generation sequencing,NGS)确诊为 ALK重排晚期NSCLC患者共234例。对耐药后的组织/体液进行NGS检测,以分析克唑替尼耐药的分子特征。使用Fisher's精确检验分析 ALK融合变体与G1202R的关系并结合临床资料进行生存分析。结果 我们总共筛选出44例使用克唑替尼治疗的晚期 ALK重排NSCLC患者,并且在疾病进展后进行了至少1次重复活检(包括31个血浆标本和39个组织标本)。棘皮动物微管样蛋白4-间变淋巴瘤激酶(echinoderm microtubule associated protein like 4-anaplastic lymphoma kinase, EML4-ALK)变异体3(v3)是本队列中最常见的 ALK变体,其次为 EML4-ALK变体1(v1)。与其他变体相比,v3变体的人群中在克唑替尼耐药后更容易出现 ALKG1202R耐药突变(0% vs. 38%, P=0.006 4)。在这44例患者中有21例(48%)发现了 ALK酪氨酸激酶区域的第二位点突变,其中L1196M占比最多,占13%,其次为两个以上 ALK突变(11%)和G1202R(7%)。生存分析显示v3与其他变体的两组人群使用克唑替尼治疗的中位无进展生存期(progression-free survival,PFS)均为8.8个月,差异无统计学意义( P=0.683 6)。根据耐药后有无 ALK耐药突变进行生存分析, ALK耐药突变组的人群使用克唑替尼治疗的中位PFS为6.6个月,无突变组则为8.8个月,差异无统计学意义( P=0.615 0)。结论 晚期 ALK重排NSCLC患者克唑替尼耐药后以 ALK激酶区域突变为主。v3变体克唑替尼耐药后更容易产生 ALK G1202R耐药突变。
Objective The anaplastic lymphoma kinase ( ALK) fusion was an important driver gene of non-small-cell lung cancer (NSCLC), and ALK-tyrosine kinase inhibitor (TKI) have significantly improved clinical outcomes in patients with ALKfusion. Unfortunately, resistance to ALK-TKI inevitably occurs after a period of treatment. The main mechanisms of resistance have been found to include ALK secondary resistance mutations, ALK gene amplification, bypass and downstream pathway activation. The aim of this study was to investigate the mechanism of resistance to crizotinib in clinical practice.Methods We retrospectively collected a total of 234 patients with ALK-positive advanced NSCLC from January 2016 to December 2020 at Guangdong Lung Cancer Institute. Ventana immunohistochemistry (IHC), fluorescence in situ hybridization (FISH), tissue or liquid next-generation sequencing (NGS) were conducted to confirm ALKrearrangement. Tissues / plasma based NGS was performed again after ALK-TKI resistance. Clinicopathological and molecular characteristics and clinical data were collected for Kaplan Meier analysis.Results We screened a total of 44 patients with advanced ALK-rearranged NSCLC treated with crizotinib and who underwent at least 1 repeat biopsy (including 31 plasma specimens and 39 tissue specimens) after disease progression. Echinoderm microtubule associated protein like 4-anaplastic lymphoma kinase ( EML4-ALK) variant 3 (v3) was the most common ALK variant in this cohort, followed by EML4-ALKvariant 1 (v1). Of these variants, v3 cohort was more likely to developed ALK G1202R resistance mutation after crizotinib resistance compared to the other variants (0% vs. 38%, P=0.006 4). A second site mutation resistance mechanism in the ALK tyrosine kinase region was identified in 21 of these 44 patients (48%), with L1196M accounting for the most (13%), followed by more than 2 ALK mutations (11%) and G1202R (7%). Survival analysis showed that the progression-free survival (PFS) of v3 and other variants groups treated with crizotinib were both 8.8 months, with no statistically significant difference ( P=0.683 6). Survival analysis based on the presence or absence of ALK resistance mutation after drug resistance showed that PFS was 6.6 months in the ALK resistance mutation group, and 8.8 months in the absence of ALK resistance mutation group, with no statistically significant difference ( P=0.615 0).Conclusions ALK kinase domain mutations predominate after crizotinib resistance in patients with advanced ALK rearranged NSCLC. EML4-ALKv3 variants were more likely to produce ALK G1202R resistance mutations after crizotinib resistance.
间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)融合基因是非小细胞肺癌(non-small cell lung cancer, NSCLC)的一个重要的驱动基因, 发生率大概为5%[1]。融合断点主要位于ALK20号外显子的上游, 保留了完整的酪氨酸激酶域, 根据不同的断点分为不同的变体, 常见的棘皮动物微管样蛋白4-间变淋巴瘤激酶(echinoderm microtubule associated protein like 4-anaplastic lymphoma kinase, EML4-ALK)变体包括变体1(v1, E13:A20)、变体2(v2, E20:A20)和变体3(v3, E6:A20), 此外还有非EML4-ALK变体, 包括KIF5B, HIP1, KLC1等[2, 3, 4, 5]。随着越来越多选择性强、疗效好的ALK抑制剂被研发出来, 这一部分人群的临床治疗结局得到了显著改善, 使得晚期患者的五年生存率也能高达60%, 因此ALK融合也被称为“ 钻石突变” 。第一个应用在ALK融合晚期NSCLC患者的药物是克唑替尼。在一项随机Ⅲ 期试验, 克唑替尼与化疗相比, 克唑替尼显著的改善了客观缓解率(objective response rate, ORR)和无进展生存期(progression-free survival, PFS), 确立了克唑替尼在该部分人群中作为标准治疗的地位[6]。尽管这一部分患者在初始的治疗中对ALK-TKI敏感, 但是经过一段时间的治疗后终会产生耐药。
广义上讲, 靶内的耐药机制(例如, ALK激酶区域的二次突变, ALK基因扩增)是主要的耐药机制, 此外, 旁路途径的激活, 例如表皮生长因子受体(epidermal growth factor receptor, EGFR), 间质表皮转化因子(mesenchymal to epithelial transition factor, MET), Kirsten大鼠肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene, KRAS), 干细胞因子(steam cell factor, SCF)上调, P-糖蛋白(P-glycoprotein, P-gp)的过表达和小细胞(small cell lung cancer, SCLC)转化, 已被确定为另一种重要的耐药机制[7]。自ALK-TKI开启了ALK重排晚期NSCLC的靶向治疗时代后, 新一代选择性更强、疗效更好的ALK-TKI在不断地涌现。尽管更多强效的ALK抑制剂包括色瑞替尼、阿来替尼、恩沙替尼被批准用于临床, 克唑替尼在肺癌的治疗中仍有一席之地, 特别是在治疗肉瘤致癌因子-受体酪氨酸激酶(c-Ros oncogene 1 receptor tyrosine kinase, ROS1)融合以及MET突变患者中。本研究通过二代测序(next-generation sequencing, NGS)对44例ALK阳性患者克唑替尼治疗后的肿瘤活检样本进行了全面的基因组学分析, 分析了他们克唑替尼耐药后的分子特征。
本研究经伦理委员会批准, 回顾性收集了2016年1月至2020年12月于广东省人民医院广东省肺癌研究所诊断为晚期ALK融合NSCLC患者234例, 其中获得了44例患者克唑替尼耐药的标本进行了分子谱分析。所有患者或家属已经签署知情同意书, 并从广东省人民医院的电子病历系统获得患者的性别、年龄、病理、分期、治疗过程及影像学疗效评价等临床病理资料。
使用NGS(广州燃石公司或者南京世和公司)检测患者肿瘤组织、血浆、脑脊液、胸腔积液中的基因突变情况, 详细的方法参考既往文献[8]。
使用Kaplan-Meier方法估算PFS曲线, 并使用Log-rank方法以比较变异组之间的PFS差异。所有统计分析均使用graph pad prism 8软件进行。P< 0.05认为有统计学意义。使用Fisher's精确检验对v3变体和非v3变体两个队列中ALKG1202R的发生率进行比较。
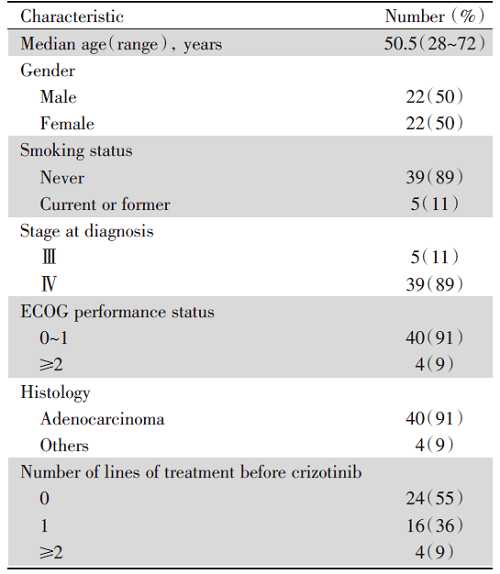
为了研究克唑替尼耐药后的分子特征, 我们一共分析了44例ALK阳性NSCLC患者经过克唑替尼治疗后耐药的NGS数据, 总共70个标本, 其中包括组织(n=39)和血浆(n=31)。具体组织标本的部位见表1。患者的基线特点见表2, 临床特征和既往的研究相似, 诊断为肺癌的中位年龄为50.5岁, 不抽烟的患者占89%, 诊断为Ⅳ 期的患者占89%, 病理类型为腺癌的患者占91%, 接受一线克唑替尼治疗患者占55%, 二线的占36%, 三线以上的占9%。
| 表1 组织活检的部位 Tab.1 Sites of tissue biopsy |
| 表2 研究人群的基线特征 Tab.2 Baseline characteristics of study population |
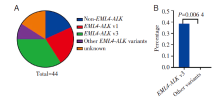
EML4-ALK v3和v1是ALK融合最常见的两个变异, 分别占队列的30%(13/44)和20%(9/44), 其他EML4-ALK变体大约在14%(6/44)的患者中检测到, 而其余8例(18%)为非EML4-ALK重排, 涉及罕见的融合伴侣, 包括AFF3、HIP1和SYNE1等, 见图1。我们用NGS的方法分析了这44例患者克唑替尼治疗后进展的标本, 发现49%(21/44)的患者出现ALK激酶区域耐药突变。其中, L1196M占比最多, 占13%, 其次为≥ 2个ALK突变(11%)和G1202R(7%), 见图2。此外, 我们一共发现了5例患者克唑替尼耐药后出现ALK G1202R突变(包括3例G1202R, 1例L1196M/G1202R复合突变, 1例G1202R/F1174L复合突变), 值得注意的是这5例患者均为v3变体, 而其他变体并没有出现ALK G1202R耐药突变(38% vs. 0%, P=0.006 4)。
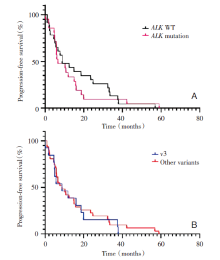
ALK融合变体的生存分析及Log-rank检验结果如图3A所示, EML4-ALKv3与其他变体使用克唑替尼治疗的PFS均为8.8个月, 差异无统计学意义(P=0.683 6)。根据耐药后有无ALK耐药突变进行生存分析, 如图3B所示, ALK突变组使用克唑替尼治疗的PFS为6.6个月, 无突变组为8.8个月, 差异无统计学意义(P=0.615 0)。
本研究通过回顾性收集克唑替尼耐药后的标本, 利用NGS技术, 初步探索了ALK重排晚期NSCLC对克唑替尼耐药的分子特征, 发现中国人群在克唑替尼耐药后出现ALK酪氨酸激酶第二位点突变占比高达48%, EML4-ALK变异体3(v3)是本队列中最常见的ALK变体, 其次为EML4-ALK变体1(v1)。与其他变体相比, v3变体的人群中在克唑替尼耐药后更容易出现ALKG1202R耐药突变。未发现耐药后是否出现ALK突变以及变体亚型与该部分人群的预后相关。
克唑替尼改善了大多数ALK重排晚期NSCLC患者临床治疗结局, 但获得性耐药的产生使得患者的受益有限。国外的一些回顾性研究发现克唑替尼耐药后大概有20%~30%的患者出现ALK激酶域的点突变[9, 10, 11, 12], 这些研究纳入的研究人群中绝大部分为高加索人种。而日本和中国的学者发现, 克唑替尼耐药后出现ALK激酶区域点突变的概率却高达50%左右, 并且纳入研究的人群为亚洲人群[13, 14]。在我们的研究中, 在克唑替尼耐药后有48%的患者出现了ALK酪氨酸激酶区域的第二位点耐药突变, 这一发现与中国和日本的回顾性研究具有一致性[13, 14]。我们推测, 亚洲人群的ALK重排阳性晚期NSCLC接受克唑替尼耐药后的分子特征谱与欧美人群是不一样的, 但是这些研究都是回顾性的小样本分析, 需要纳入更大的样本来证明我们的研究发现。
有研究发现不同的ALK融合变体可能具有不同的蛋白质稳定性, 这会影响克唑替尼的敏感性[15]。我们的研究发现各个ALK融合变体的分布跟文献报道的一致, 主要为EML4-ALKv1和v3变体。ALK G1202R溶剂前沿突变通过干扰药物与靶点的结合, 使得患者对第一代和第二代ALK抑制剂产生耐药[9], ALK G1202R同时也与第三代ALK-TKI劳拉替尼的疗效相关[16]。值得注意的是, 我们的研究发现, v3变体的这部分人群中在克唑替尼耐药后更容易出现ALK G1202R突变(38% vs. 0%, P=0.006 4), 与Lin等人的研究发现是一致的[17]。国外的很多研究表明, ≥ 2个ALK突变是劳拉替尼耐药的主要机制, 大概占35%, 而克唑替尼耐药后则较少出现≥ 2个ALK突变, 体外实验发现≥ 2个ALK突变对一代、二代和三代ALK-TKI是耐药的[13, 16]。在我们的研究中, 总共发现了5例在克唑替尼耐药后出现≥ 2个ALK突变, 分别为ALK 1196M/G1202R, G1269A/F1174L, L1196M和G1269A, C1156Y/G1269A, G1202R/F1174L, 但是在本研究中, 我们无法获知这些复合突变是顺式还是反式, 因为我们的NGS文库是从基因组DNA中制备的, 缺少足够的标本进行对单个互补DNA(complementary DNA, cDNA)进行测序。而且文献报道的复合突变大多是序贯使用多个ALK-TKI才出现, 对于使用第一代ALK-TKI克唑替尼就出现≥ 2个ALK突变患者来说, 下一步的治疗是使用二代或者三代的药物还是化疗还需要进一步的研究。
本研究有几个局限性。首先, 这是一项回顾性研究, 只在单个中心中纳入了少数患者。其次, 在本研究中, NGS的文库是从基因组DNA中制备的, 缺少足够的标本进行对单个cDNA进行测序来确定这些突变是顺式还是反式状态。最后, 由于目前靶向药物的发展, 阿来替尼已经取代克唑替尼成为首选的一线治疗ALK重排阳性晚期NSCLC的药物, 对于阿来替尼耐药机制的探索可能更具有临床意义。由于各个ALK-TKI对每种ALK激酶区域耐药突变的敏感性是不同的, 因此对患者耐药后的肿瘤标本进行分子分析有助于患者的个体化治疗。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|