作者简介:
邹威(1997-),男,广东揭西人,硕士研究生,主要研究方向为肿瘤的介入治疗。
[编者按] 疾病的正确诊断和合理治疗是患者和医务工作者共同的心愿。在广东省人民医院肿瘤中心, 吴一龙教授指导临床医生应用循证医学理论进行肿瘤的多学科综合治疗, 开展临床病例讨论。讨论会上各学科共同围绕一个病例或一个病种进行会诊, 临床、病理、B超、放射影像等资料齐全, 除相关科室提前准备的中心性发言外, 到会人员各抒己见, 气氛热烈。参会人员受益匪浅, 提高了对疑难病例的诊治水平。为了将他们的诊治经验传播出去, 让更多的临床医生获益, 我刊开辟“ 循证病例讨论” 栏目, 希望广大医务工作者关注此栏目。
患者李某, 男性, 69岁, 因“ 上腹部疼痛10天” 于2020-01-03第一次入院。当地CT提示肝硬化、腹水、肝右叶多发占位, 考虑肝细胞癌。既往自诉乙肝病史20余年, 余均无异常。个人史及家族史无异常。体格检查:PS 1分, 双下肢轻度指凹性水肿, 其余体征未见异常。
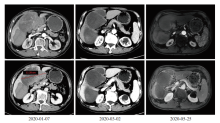
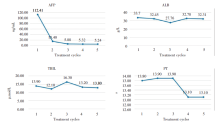
入院后辅助检查:甲胎蛋白(alpha-fetoprotein, AFP):112.41 ng/mL, 肝功能:谷丙转氨酶(alanine aminotransferase, ALT):59 U/L, 谷草转氨酶(aspartate aminotransferase, AST):62 U/L, 白蛋白(albumin, ALB):33.70 g/L, 总胆红素(total bilirubin, TBIL):13.9 μ mol/L, 凝血功能:凝血酶原时间(prothrombin time, PT):13.8 s, 乙肝五项:HBsAg(-), Anti-HBs(-), HBeAg(-), Anti-HBe(+), Anti-HBc(+), HBV-DNA< 100 IU/mL。于2020-01-06行上腹部增强CT示:平扫下S4段可见低密度占位, 长径12 cm, 增强下呈“ 快进快退” 模式, 符合肝细胞癌诊断。动脉期可见丰富肿瘤血管, 中央区为未见强化的坏死区域。S6、S7段可见类圆形稍高密度影, 密度较均匀, 矢状位见病灶与癌灶相联通, 诊断肝癌破裂合并血肿。
临床诊断:肝细胞癌, 巴塞罗那临床肝癌(Barcelona Clinic Liver Cancer, BCLC)分期C期, 中国肝癌分期方案(China Liver Cancer Staging, CNLC)分期Ⅲ B期。
入院后治疗:患者于肝胆外科首诊, 考虑肿瘤体积较大, 不适宜外科切除。根据美国综合肿瘤网络(National Comprehensive Cancer Network, NCCN)指南:不可切除的5 cm以上肝细胞癌, 需要考虑血管介入或者系统治疗[1], 遂转入介入科治疗。根据中国卫生健康委员会《原发性肝癌诊疗规范(2019年版)》, Ⅲ B期可接受系统治疗、经动脉化疗栓塞(transarterial chemoembolization, TACE)、放疗[2]以及仑伐替尼作为BCLC分期C期患者靶向治疗首选药物, 介入科予选择仑伐替尼[3]联合FOLFOX(奥沙利铂、亚叶酸钙、氟尿嘧啶)方案[4]灌注化疗。于2020-01-07、2020-02-04、2020-03-02、2020-04-09行肝动脉灌注化疗(FOLFOX方案); 2020-01-10口服仑伐替尼(8 mg, qd)至今。
治疗后评估:经仑伐替尼联合FOLFOX方案灌注化疗, 此次入院, 辅助检查:AFP 5.24 ng/mL, 肝功能指标:ALT 56 U/L, AST 81 U/L, ALB 30.36 g/L, TBIL 13.7 μ mol/L, PT 13.10 s。2020-05-25行肝胆胰脾MR示:残留癌灶在T1、T2呈稍高信号, 增强扫描各期未见明确强化。DWI/ADC病灶区域弥散不受限。评价疗效改良实体瘤疗效评价(modified Response Evaluation Criteria in Solid Tumors, mRECIST)标准部分缓解(partial response, PR)(缩小79%), RECIST 1.1标准疾病稳定(stable disease, SD)(缩小28%)。目前分期BCLC分期A期, PS 0分, Child-Pugh 6分A级。为明确残留癌灶是否仍有活性, 行CT引导下肝穿刺活检术, 病理提示肝细胞癌。
时丰(介入科医师):患者诊断肝细胞癌, BCLC分期C期, 予4周期FOLFOX方案动脉灌注化疗、口服仑伐替尼(8 mg, qd)治疗, 目前患者肿瘤活性区域缩小, 现BCLC分期A期, 实现降期目的。目前患者存在肿瘤破裂血肿, 且与肿瘤相通。提出讨论要点:(1)肿瘤破裂合并血肿对于肿瘤的分期及进一步治疗是否存在影响?(2)降期后的治疗策略?(3)其它治疗手段的应用。
马冬(肿瘤内科主任医师):如果肿瘤破裂, 出血涉及腹腔, 存在导致腹腔的种植的可能, 进而影响分期。目前患者血肿仍局限于肝内, 不影响分期。
杨衿记(肺内科主任医师):目前S5段血肿存在, 与肿瘤相通, 是否存在活性肿瘤细胞尚不明确, 建议行穿刺活检、细胞学检查、生物学检查等进一步确认血肿内有无活性肿瘤细胞。如明确血肿中无活性肿瘤细胞, 则不影响分期, 可继续行局部治疗。
陈晓明(介入科主任医师):患者经仑伐替尼联合FOLFOX方案灌注化疗后, 目前分期BCLC分期A期, 评价疗效mRECIST标准为PR(缩小79%), RECIST 1.1标准为SD(缩小28%), 达到降期目的。降期后可采取哪些治疗策略?
时丰:通过有效的肝动脉灌注化疗联合仑伐替尼治疗, 病灶明显缩小, BCLC分期降至A期, 肝移植为目前最佳的治疗选择。有研究表明[5], 经降期治疗后符合米兰标准(单发肿瘤且小于5 cm; 2个或3个肿瘤, 均小于3 cm; 不伴有血管侵犯及远处转移)的患者, 与原符合米兰标准的患者, 行肝移植治疗的生存率相当。现患者经过降期治疗, 肿瘤活性区域由12 cm缩小至2.3 cm, 符合米兰标准。但目前我国存在肝源缺乏、治疗费用过高等问题, 肝移植并不现实。外科切除更加值得考虑。
杨衿记:患者S4段孤立病灶结合S5段血肿, 可疑胆囊侵犯, 通过有效的肝动脉灌注化疗联合仑伐替尼治疗, 可见病灶明显缩小, BCLC分期降至A期, 肝移植为目前最佳的治疗选择, 但结合我国目前情况, 外科切除更加值得考虑。但目前S5段血肿存在, 与肿瘤相通, 是否存在活性肿瘤细胞尚不明确。如不处理, 有可能成为以后肿瘤复发的根源。如经过评估, 可行外科切除治疗, 局部干预具有价值; 如外科手术时机尚未成熟, 建议进行动脉灌注联合仑伐替尼继续治疗, 待血肿进一步缩小后再行外科切除。
金浩生(肝胆外科主任医师):患者首诊时, 肿瘤压迫第一肝门血管, 且存在肿瘤破裂出血, 没有手术机会。经过动脉灌注联合仑伐替尼治疗, 肿瘤逐渐退缩, 但目前仍有活性癌灶, 穿刺活检明确肝细胞肝癌。从外科角度分析, 病灶主要位于S4、S5段, 肝左、右动脉之间, 涉及第一肝门, 行肝中叶切除术难度较大, 存在损伤血管可能。建议继续行动脉灌注联合仑伐替尼治疗, 待肿瘤体积进一步缩小, 再考虑外科切除。
陈晓明:除了外科切除, 其它局部治疗, 如消融是否值得考虑?
时丰:目前肿瘤体积较大, 总体约8 cm, 进行消融不太现实[6, 7]。如选择仅对2.3 cm活性区域进行消融, 尚缺乏针对灌注化疗后残留病灶消融的数据。从操作角度分析, 残留活性肿瘤靠近第一肝门, 缺少足够的安全边界, 完全消融难度较大。
周泽健(介入科主任医师):患者经过动脉灌注联合仑伐替尼治疗, 效果较好。对于下一步治疗, 如肝移植、外科切除、继续介入治疗都是可以考虑的方案。目前, 外科切除及消融难度较大, 建议在仑伐替尼的基础上, 结合肝动脉腔内栓塞治疗[8, 9]。
陈晓明:目前, 立体定向放疗(stereotactic body radiation therapy, SBRT)对肝、肾上腺的治疗, 已改变我们过去对放疗的认识[10]。SBRT是否可以纳入降期后治疗的选择?
谢松喜(放疗科副主任医师):目前, 越来越多的临床研究证据提示, 采用现代放疗技术, 对肝癌可取得不错的结果[11]。放疗优势在于:4~5 cm病灶、靠近膈肌或侵犯包膜、靠近大血管。对于肝功能稍差、靠近周围组织、消融存在难度的患者, 可以考虑行SBRT放疗。就此患者, 在仑伐替尼取得良好效果的情况下, 增加局部放疗, 使肿瘤进一步缩小, 争取获得外科手术机会, 也是一个选择。
陈晓明:经过介入治疗后残留的病灶, 经SBRT治疗缩小之后, 再行外科切除是否可行?放疗对肿瘤周围组织结构有无影响?
金浩生:放疗是门脉癌栓重要的治疗方式。虽然会对周围组织造成影响, 但同样可以达到降期的目的。肿瘤的降期包括:肿瘤体积下降、门脉癌栓体积下降、剩余肝脏体积增大。与此同时, 放疗也会带来组织粘连、容易出血等术中、术后并发症。
陈晓明:肿瘤降期后再治疗的选择, 需要把握什么原则?
吴一龙(肿瘤学教授):肿瘤的降期, 是前几年新辅助治疗所追求的目标, 通过降期给外科手术创造机会。自从免疫治疗发展[12, 13, 14]之后, 大家的观念有所改变。新辅助治疗的目的不再是单纯地创造手术机会, 更多的是通过免疫治疗、新辅助治疗把微小的转移病灶彻底消灭, 从而提高患者长期生存机会。自从这个概念提出之后, 我们在新辅助治疗之后, 有更多的治疗选择。目前患者已取得降期效果, 选择局部治疗方案有几个原则:第一, 使患者获得长期的生存时间; 第二, 保证患者的生存质量, 避免带来较大负担; 第三, 对每个局部治疗手段进行充分的评估。目前需要解决的问题在于:如果继续进行全身治疗, 能否达到肿瘤继续缩小的目的?能不能提供比较好的外科手术机会?如果患者此前的治疗已处在相对稳定的状态, 根据全身治疗经验, 肿瘤进一步缩小概率不大, 需要及时进行局部干预。如果患者治疗持续有效, 就有继续缩小的可能性, 需要重新评估过去疗效与远期效应。
时丰:从影像学角度看, 肿瘤变化不大。考虑残留病灶是否存在其它血管供血?有待进一步血管造影查证, 如存在其它肿瘤供血血管, 则计划进行局部针对性的灌注治疗。
吴一龙:对于这种情况, 可在全身治疗的基础上, 考虑针对残留病灶增加SBRT治疗, 之后再次评价能否进行手术。
陈晓明:目前, 单药免疫治疗是肝癌二线治疗手段, 阿替利珠单抗(T药)+贝伐单抗(A药)的“ A+T” 方案已被NCCN列入一线治疗方案[1]。是否将免疫治疗纳入后续治疗方案?
吴一龙:许多地方已在开展肝癌的免疫新辅助治疗, 在前期治疗取得疗效的基础上, 增加免疫治疗, 联合放疗、介入, 有可能产生意想不到的疗效。在前期治疗未能进一步突破时, 免疫治疗可作为相应的补充手段。
谢松喜:在其它癌种中, 免疫治疗联合放疗具有协同作用。如考虑免疫治疗作为进一步治疗的主要手段, 加上放疗也是值得尝试的做法, 可能在肝癌取得较好的协同作用, 对接下来治疗方案的探索有新的思路。
吴一龙:总的来说, 第一, 患者前期的治疗已取得明显疗效, 但目前仍不是局部治疗最好的时机, 争取在此基础上结合其他治疗方案, 做到锦上添花。第二, 需不需要增加免疫治疗?外科切除、消融、靶向药物等, 并不是完全性杀灭肿瘤, 仍可能出现残存的肿瘤及复发转移。而免疫治疗通过调动自身自体免疫, 对残留的病灶有消除作用, 所以能获得更高的生存率, 甚至治愈, 值得认真考虑。第三, SBRT对肝、肾上腺的治疗, 已改变我们过去对放疗的认识, 对于局部晚期的肿瘤患者, 可以考虑结合免疫治疗和放疗, 争取取得更好的疗效。
总结:患者诊断肝细胞癌, BCLC分期C期, 动脉灌注化疗(FOLFOX方案)及靶向治疗(仑伐替尼)治疗后降至BCLC分期A期, 残存病灶仍有活性。此例患者肝细胞癌降期治疗后根治性策略, 动脉灌注化疗及靶向治疗效果明确, 应继续进行; 在此基础上, 积极与患者、家属沟通是否进行免疫治疗和放疗, 争取获得根治性治疗或局部治疗机会。
后记:患者及家属因经济原因, 拒绝进行免疫治疗和放疗。考虑患者肿瘤体积较大、以及消融可能取得根治性治疗获益, 遂制定对肿瘤活性区域进行消融、术后定期影像学复查的治疗策略。于2020-07-16局麻下行肝病损微波消融术, 2020-09-17上腹部MR提示:增强扫描病灶及余区未见明确强化。嘱患者3个月后再次复查, 追踪病情变化。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|