| 杨梅,广东省人民医院乳腺肿瘤科副主任医师,硕士生导师,外科学博士,香港大学博士后,美国耶鲁大学访问学者,广东省人民医院杰出青年培育人才。兼任中国抗癌协会遗传性肿瘤专业委员会常务委员,中国医师协会外科分会乳腺外科委员会青年委员,中国医药教育协会乳腺疾病专业委员会委员,广东省女医师协会整形美容专业委员会委员,广东省精准医学应用学会乳腺肿瘤分会委员。 专业特长为乳腺癌的早期诊断和手术治疗、整形美容修复、规范化疗、内分泌治疗、靶向治疗,乳腺肿瘤良性肿瘤微创手术,患者心理辅导干预等。视患者如亲人,对患者倡导全局整体观,在国内率先开展乳腺癌的遗传风险诊断与遗传抵抗力评估、癌症早期诊断和综合治疗、个性化乳腺整形手术和全程管控。对乳腺癌保乳、良性肿瘤微创切除、精细手术结合人文美学均有独特的见解和造诣。 广泛开展国际国内交流合作,主持国家级、省级、市级课题4项,参与多项国家级、省级课题,发表国际学术论著15篇,获得国外专利3项,国内专利3项。 |
文献一:Schmid P, Rugo HS, Adams S, et al. Atezolizumab plus nab-paclitaxel as first-line treatment for unresectable, locally advanced or metastatic triple-negative breast cancer (IMpassion130): Updated efficacy results from a randomized, double-blind, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2020, 21(1):44-59.
文献二:Emens LA, Adams S, Barrios CH, et al. LBA16 IMpassion130: Final OS analysis from the pivotal phase Ⅲ study of atezolizumab + nab-paclitaxel vs placebo + nab-paclitaxel in previously untreated locally advanced or metastatic triple-negative breast cancer[J]. Ann Oncol, 2020, 31(4S):S1148.
1b。
局部晚期或转移性三阴性乳腺癌(triple- negative breast cancer, TNBC)预后较差, 国际指南推荐其一线治疗为单药紫杉烷类或蒽环类的化疗, 中位总生存期(overall survival, OS)约为18个月或更短。TNBC患者程序性死亡配体1(programmed cell death ligand 1, PD-L1)阳性比例高, 肿瘤浸润性淋巴细胞比例高, 因此PD-L1抑制剂阿替利珠单抗(atezolizumab)可能是一个有效的治疗策略。研究选择白蛋白紫杉醇(nab-paclitaxel)作为联合伴侣, 免除了传统注射用紫杉醇应用前需用激素预处理的过程, 从而避免激素影响免疫治疗效果, 且既往研究已经评估了阿替利珠单抗联合白蛋白紫杉醇的安全性和疗效。
探索PD-L1抑制剂阿替利珠单抗联合白蛋白紫杉醇对比白蛋白紫杉醇单药化疗能否改善晚期TNBC患者的生存, 并评估其安全性。
• 研究条件:全球41个国家246个研究机构902例患者参与的IMpassion130研究(NCT02425891)。
• 研究方法:国际多中心、随机、双盲、安慰剂对照的Ⅲ 期临床研究。
• 研究时间:2015年6月23日至2020年4月14日。
• 研究对象:18岁或以上, 经组织病理学确诊的转移性或不可切除的局部晚期TNBC, PD-L1表达状态可评估, 既往没有针对晚期TNBC的治疗, 既往放/化疗洗脱期≥ 12个月, ECOG PS 0~1分。排除标准为未经治疗的中枢神经系统转移, 有自身免疫性疾病史, 既往免疫调节剂、糖皮质激素使用史。分层因素包括:既往紫杉烷类药物使用史(是vs.否), 肝转移(是vs.否), PD-L1状态[阳性(≥ 1%) vs. 阴性(< 1%)]。
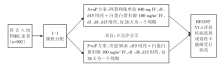
• 干预措施:入组患者1:1随机分组, 分别接受阿替利珠单抗联合白蛋白紫杉醇(A+nP)方案或安慰剂联合白蛋白紫杉醇(P+nP)治疗, 研究设计见图1。若出现不可耐受毒性, 白蛋白紫杉醇至少用药6周期, 可减量至75 mg/m2, 50 mg/m2到停药, 阿替利珠单抗不可减量。
• 评价指标:主要评估人群包括意向性治疗(intent-to-treat, ITT)分析集人群和PD-L1阳性人群; 主要终点为研究者评估的无进展生存期(progression-free survival, PFS)和OS; 次要终点包括客观反应率(objective response rate, ORR)、客观反应持续时间(duration of objective response, DoR)及安全性。
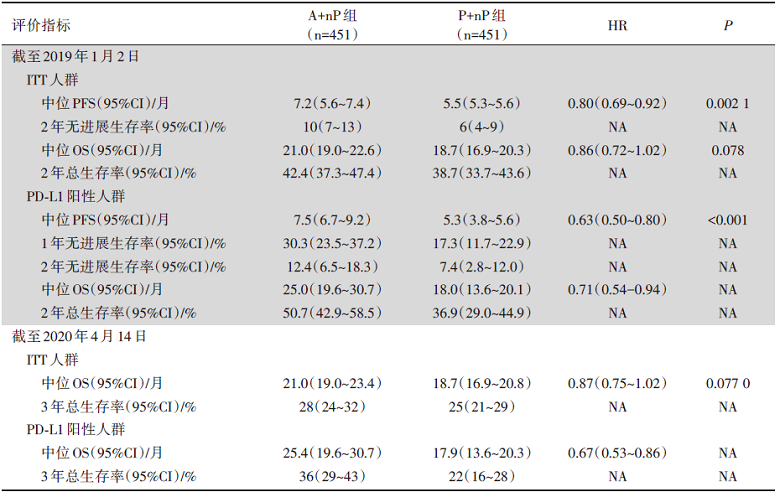
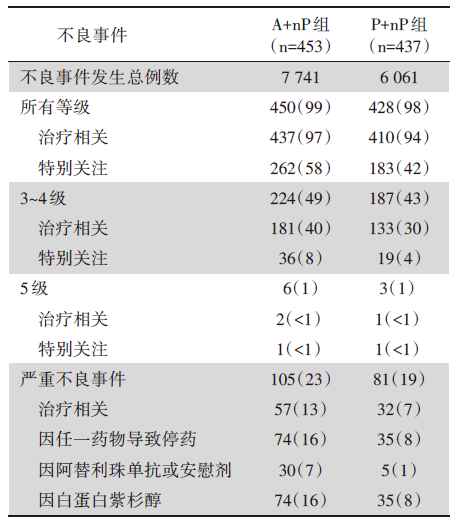
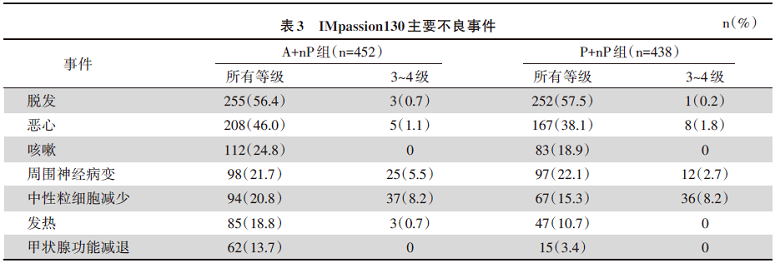
2015年6月至2017年5月, 研究共入组902例患者(ITT人群), 试验组与对照组各451例, 两组患者基线特征平衡。试验组与对照组中PD-L1阳性患者分别为185例和184例, 共占总人群40.9%, 其基线特征与ITT人群一致。截至2020年4月14日的中位随访时间为18.8个月。A+nP组中位PFS明显长于P+nP组, 7.2个月 vs. 5.5个月; 且在PD-L1阳性患者中差异更明显, 7.5个月 vs. 5.3个月。试验组和对照组的OS无显著差异, 但A+nP组的OS数值上更长。研究的主要终点结局见表1。在毒副反应方面, 截至2019年1月2日, A+nP组和P+nP组的特别关注的不良事件(主要为免疫相关不良反应)发生率分别为58%和42%, 其中皮疹、甲减、甲亢以及肺炎的发生率分别为:34% vs. 26%, 18% vs. 5%, 5% vs. 1%, 4% vs. < 1%, 停药的首要原因是周围神经病变。安全性总结见表2, 主要不良事件见表3。
| 表1 IMpassion130主要终点结局 |
| 表2 IMpassion130安全性总结 n(%) |
| 表3 IMpassion130主要不良事件 n(%) |
抗PD-L1单抗阿替利珠单抗联合白蛋白紫杉醇方案对比白蛋白紫杉醇单药方案治疗晚期三阴性乳腺癌, 可以显著延长ITT人群和PD-L1阳性亚组人群的PFS。阿替利珠单抗联合白蛋白紫杉醇的应用具有良好的耐受性, 其安全性数据与既往研究一致。
转移性TNBC生存期短, 预后差, 治疗上目前仍是化疗为主, 临床科学家一直在探索更优的治疗模式。IMpassion130是针对转移性TNBC患者, 在白蛋白紫杉醇标准化疗基础上, 联合免疫检查点抑制剂阿替利珠单抗/安慰剂的大样本、随机、双盲、对照Ⅲ 期临床研究。白蛋白紫杉醇d1/d8/d15给药, 阿替利珠单抗d1/d15给药, 4周为一个周期。观察终点是总患者人群和PD-L1阳性患者群的OS和PFS。研究中PD-L1阳性的阈值定为≥ 1%, 约41%的患者呈现肿瘤浸润性免疫细胞PD-L1阳性(immune cell positive, PD-L1 IC+), 这一人群PFS延长了2.5个月, OS延长了9.5个月, 对于转移性TNBC来说疗效获益非常大, 和PD-L1 IC-人群相比差异明显。所以在这项研究中, PD-L1 IC+成为标准化疗方案白蛋白紫杉醇加用阿替利珠单抗疗效的最好的预测因素。安全性方面, 特别关注的不良反应在阿替利珠单抗+白蛋白紫杉醇组高于对照组(58%和42%), 严重不良事件两组发生率分别为23%和19%。2018年欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)年会公布IMpassion130结果后, 2019、2020年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)年会发布了更新数据和安全性分析, 夯实了阿替利珠单抗联合白蛋白紫杉醇在晚期TNBC中的疗效和安全性。所以IMpassion130是免疫疗法治疗晚期TNBC的首个Ⅲ 期临床研究阳性结果, 最令人惊艳的是OS的改善, 给免疫治疗带来了曙光, 然而也由此引发诸多思考。这里我们结合几个免疫检查点抑制剂应用的临床研究, 讨论一下晚期TNBC免疫-化疗联合治疗的几个问题。
首先, 对于免疫惰性的TNBC, 免疫治疗的策略如何?在肿瘤免疫治疗中, 不可忽略免疫表型(免疫炎症型和免疫沙漠型), 只有在恰当的免疫表型中探索免疫治疗才是正确的方向。多组学技术(包括基因组、表观遗传、转录组、蛋白组学等)让我们更加深入的理解和认识TNBC肿瘤本身和微环境, 根据肿瘤微环境的异质性和免疫逃逸机制, 邵志敏团队提出TNBC患者个体化免疫治疗策略:对“ 免疫炎症型(热肿瘤)” 的患者应用免疫检查点抑制剂; 对“ 免疫沙漠型(冷肿瘤)和先天免疫失活” 的患者, 则主张将“ 冷肿瘤” 转化为“ 热肿瘤” , 再结合免疫检查点抑制剂的应用。因此我们需要根据免疫表型来制定策略和选择治疗方案, 在晚期TNBC中进行筛选分类再进行后续治疗。
那么, 在晚期TNBC患者中如何筛选和富集获益人群?在IMpassion130研究中, PD-L1 IC+是疗效预测最好的指标, 但是在该研究中也仅有部分PD-L1 IC+人群从免疫治疗中获益; 在KEYNOTE-086研究中, 尽管PD-L1阳性表达对PD-1/PD-L1抑制剂的疗效有一定的预测趋势, 但仍没有达到预期[1]。另外, PD-L1阳性表达在各临床研究的定义模式尚不统一:IMpassion130研究中, PD-L1定义为肿瘤浸润性免疫细胞的阳性表达(PD-L1 IC+); KEYNOTE-086研究的PD-L1的阳性表达定义为综合阳性评分(combined positive score, CPS), 即所有PD-L1阳性的肿瘤细胞+淋巴细胞+巨噬细胞的总和占肿瘤细胞总数的百分比≥ 1; KEYNOTE-355研究中, PD-L1的表达计算也为CPS, 阳性表达也定义为CPS≥ 1, 但是PD-L1 CPS> 10的患者PFS延长最多[2]。显然, 综合各项研究来看, PD-L1尚未满足临床的需求。因此除PD-L1外, 我们需要寻找并验证新的疗效预测指标, 并且需要统一的规范来定义预测指标以便于大规模推广和联合分析。既往研究发现肿瘤突变负荷(tumor mutation burden, TMB)可作为免疫治疗的选择指标, 肿瘤浸润淋巴细胞、中性粒细胞[3]和免疫检查点分子是近年来出现的疗效预测指标[4]。TOP2A突变和CD8免疫组化评分也显示出具有TNBC免疫治疗疗效的预测能力[5]。然而这些单个指标虽然都表现出预测潜力, 仍未能满足需求而被广泛使用。因此, 结合肿瘤本身、肿瘤微环境和患者临床特点等因素综合考虑, 包含影像组学在内的多因素结合的预测模型可能是未来的发展方向。
此外, IMpassion130研究中, 免疫检查点抑制剂在白蛋白紫杉醇的基础上将PD-L1 IC+的晚期TNBC人群OS延长了9个月; 并且相比于化疗组的1.1%, 在免疫联合化疗组有10.3%的患者获得了完全缓解。这是否提示了免疫检查点抑制剂单药的疗效呢?遗憾的是这一研究没有设置免疫单药治疗组来回答这个疑问, 我们只能从其他临床研究获得一些信息。KEYNOTE-119研究比较了帕博利珠单抗单药和研究者定的化疗方案在晚期TNBC≥ 2线的治疗疗效, 结果显示帕博利珠单抗单药和化疗相比不能延长生存[6]。提示化疗的诱导在免疫联合化疗的方案中具有重要作用。TONIC Ⅱ 期临床研究比较纳武利尤单抗(PD-1抑制剂)使用前不诱导, 以及用化疗药物或放疗诱导后, 转移性TNBC的疗效。总体反应率(overall response rate, ORR)为20%, 主要有反应的患者集中在顺铂(ORR 23%)和阿霉素(ORR 35%)诱导后使用纳武利尤单抗的患者。并且在顺铂和阿霉素诱导的患者中观察到了与PD-1、PD-L1和T细胞信号通路相关的基因上调[7]。KEYNOTE-355研究用帕博利珠单抗(PD-1单抗)联合不同的化疗方案(白蛋白紫杉醇/紫杉醇/吉西他滨+卡铂)[2]在晚期TNBC的一线治疗中也获得了PFS的延长。这些临床研究显示, 化疗增强了免疫治疗的作用, 机制可能是化疗药物使抗原暴露, 诱导了更强的免疫反应。而免疫检查点抑制剂单药的疗效则需要更多的研究来评估, 也需要寻找更加适合的患者人群。
IMpassion130在晚期TNBC中展现了免疫+化疗联合方案的潜力, 在PD-L1 IC+患者中OS的延长极大增强了对特定人群免疫治疗的信心, 2020美国综合肿瘤网络(National Comprehensive Cancer Network, NCCN)指南将阿替利珠单抗+白蛋白紫杉醇联合方案作为PD-L1 IC+晚期TNBC一线治疗的推荐方案, 指导临床医生的用药。对获益人群特征的深入分析和疗效预测模型的研发将指导我们更加精准的对晚期TNBC患者的分类治疗。虽然前路曲折, 但是晚期TNBC免疫治疗的春天已悄悄靠近!
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|