| 宋传贵,福建医科大学附属协和医院乳腺外科行政副主任,主任医师、教授、博士生导师,复旦大学肿瘤学博士毕业,获复旦大学优秀博士论文奖,于美国安德森肿瘤中心高级访修。兼任中国抗癌协会乳腺癌专业委员会常务委员、中国肿瘤学会(CSCO)乳腺癌专家委员会委员、中华医学会肿瘤分会乳腺学组委员、中国抗癌协会精准靶向专业委员会委员。参编《乳腺肿瘤学》、《HER2阳性乳腺癌》及《精准时代的乳腺肿瘤学》等专著,为《中国抗癌协会乳腺癌诊治指南和规范》以及《中国临床肿瘤协会乳腺癌诊疗指南》的编写组成员;参与多部业内治疗共识的制定。 |
Mittendorf EA, Zhang H, Barrios C H, et al. Neoadjuvant atezolizumab in combination with sequential nab-paclitaxel and anthracycline-based chemotherapy versus placebo and chemotherapy in patients with early stage triple-negative breast cancer (IMpassion031): A randomized, double-blind, phase 3 trial[J]. Lancet, 2020, 396(10257):1090-1100.
1b。
早期三阴性乳腺癌(triple-negative breast cancer, TNBC)首选的新辅助治疗方案包括以蒽环类和紫杉类为基础的化疗。然而随着免疫治疗的迅猛发展, 免疫联合治疗方案成为未来的研究方向。KEYNOTE-522是免疫治疗在早期TNBC首个公布结果的研究。研究结果显示, 早期TNBC在铂类新辅助化疗中添加帕博利珠单抗可使病理完全缓解率(pathological complete response rate, pCR)(ypT0/Tis ypN0)提高13.6%, 无事件生存率(effect-free survival, EFS)提高了6%且与程序性死亡配体1(programmed death ligand 1, PD-L1)状态无关。同时, Ⅱ 期临床试验I-SPY2研究也证实, 与单纯化疗相比, 帕博利珠单抗联合新辅助化疗可明显改善TNBC患者的pCR。然而早期TNBC免疫新辅助治疗一路高歌前进时却遇到了打击。在Ⅲ 期临床试验NeoTRIPaPDL1研究中, 与单用新辅助化疗相比, 在新辅助化疗的基础上加入PD-L1抑制剂阿替利珠单抗未能显著提高TNBC患者的pCR。
评估阿替利珠单抗联合白蛋白紫杉醇序贯多柔比星+环磷酰胺新辅助治疗TNBC的疗效和安全性。
• 研究条件:在13个国家共75个研究中心参与的IMpassion031研究(NCT03197935)。
• 研究时间:2017年7月7日至2020年4月3日。
• 研究方法:多中心、Ⅲ 期、随机对照、开放性临床试验。
• 研究对象:初治Ⅱ ~Ⅲ 期TNBC患者, 年龄≥ 18岁, 肿瘤直径> 2 cm。cT2-cT4cN0-cN3cM0, 免疫组化确定PD-L1状态, ECOG PS 0~1分。
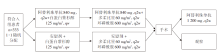
• 干预措施:共入组333例患者, 随机分配到试验组(165例)和对照组(168例), 具体见图1。
• 评价指标:主要终点为意向性治疗(intent-to-treat, ITT)人群和PD-L1阳性患者的pCR。次要终点为EFS和安全性。
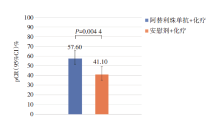
在数据截止日期, 阿替利珠单抗联合化疗组中位随访时间为20.6个月(8.7~24.9), 安慰剂联合化疗组中位随访时间为19.8个月(8.1~24.5)。阿替利珠单抗联合化疗组95例患者达到病理完全缓解[pCR 58%, 95%可信区间(confidence interval, CI)50~65], 安慰剂加化疗组69例患者获得病理完全缓解(pCR 41%, 95%CI 34~49)。阿替利珠单抗联合化疗组pCR较对照组提高17%[95%CI 6~27; 单侧P=0.004 4(P< 0.018 4)], 具体见图2。
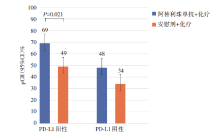
PD-L1阳性患者与ITT人群pCR获益一致(68.8% vs. 49.3%, P=0.021); 即使是PD-L1阴性患者, 其pCR仍然有获益的趋势(47.7% vs. 34.4%), 具体见图3。
严重不良事件(adverse effect, AE)发生率分别为30% vs. 18%。常见严重AE包括发热性中性粒细胞减少、肺炎和发热。发生特殊不良事件分别为115例(70%)和101例(60%), 最常见的是皮疹、甲状腺功能减退、输液相关反应。
阿替利珠单抗联合化疗的新辅助治疗方案能给早期TNBC患者带来有临床意义的pCR获益, 而且不论PD-L1的表达状态如何。同时, 此方案且具有可接受的安全性。
三阴性乳腺癌(TNBC)是一类特殊亚型的乳腺癌, 具有侵袭能力强、预后差、治疗靶点少等特点。随着新辅助治疗理念的更新和适应证的不断扩展, 三阴性乳腺癌也成为新辅助化疗相对优先选择的目标人群[1]。在新辅助化疗后获得病理学完全缓解的患者可以获得更为良好的长期生存[2, 3]。
近些年来, 免疫治疗始终是肿瘤治疗领域的研究热点。但乳腺癌作为免疫源性较低的瘤种, 一直被视为免疫治疗的“ 荒漠” 。尽管如此, 学者们对其在该领域进行的探索从未停止。IMpassion130研究首次证实PD-L1抑制剂阿替利珠单抗联合白蛋白结合型紫杉醇一线治疗晚期三阴性乳腺癌可以显著提高患者的无进展生存期和PD-L1阳性患者的总生存期(OS), 推开了免疫治疗在乳腺癌临床应用的大门[4]。而在早期新辅助治疗阶段的探索中, 相关临床研究例如KEYNOTE-522以及NeoTRIPaPDL1却获得了并不一致的结果[5, 6]。IMpassion031的研究结果则再次证实了免疫治疗在三阴性乳腺癌患者新辅助治疗中的优势[7]。该研究是一项多中心、随机、双盲的Ⅲ 期临床研究, 共入组333例患者, 1:1随机接受阿替利珠单抗联合化疗(白蛋白紫杉醇序贯多柔比星+环磷酰胺)或安慰剂联合化疗。主要研究终点包括意向性治疗(ITT)人群和PD-L1阳性人群的病理学完全缓解率(pCR), 次要终点包括无事件生存期(EFS)、无病生存期(DFS)、OS和药物的安全性。在数据截止日期, 试验组与安慰剂组中位随访时间分别为20.6个月和19.8个月, ITT人群中试验组pCR提高17%(58% vs. 41%, P=0.004 4), 而PD-L1阳性患者pCR提高19.5%(68.8% vs. 49.3%, P=0.021)。亚组分析则提示, 即便是PD-L1阴性患者, 其pCR仍然有获益的趋势(47.7% vs. 34.4%)。在生存方面, 不管是EFS、DFS还是OS, 都观察到了新辅助免疫治疗获益的趋势, 但目前数据尚不成熟。而在安全性方面, 试验组与安慰剂组治疗相关3~4级不良反应发生率分别为57%和53%, 发生率相似。
进一步分析该研究结果。首先, 与之前获得阴性结果的NeoTRIPaPDL1研究入组了更多高危患者(N+:87%, T3/T4:46%)不同的是, IMpassion031研究入组了更多临床病理特征较为低危(N+:34%, T3/T4:30%)的患者。而在同样获得阳性结果的KEYNOTE-522研究中, 这一比例分别是52%及26%。从临床特征看, 似乎分期更低的患者反而能从免疫治疗中获益, 这可能与肿瘤负荷较高的患者机体免疫状态相对较为低下, 而负荷较低的肿瘤对免疫微环境影响较弱有关。对于异质性较大的三阴性乳腺癌来说, 究竟什么类型的肿瘤其免疫源性可能更强, 未来还需要进一步探索有效的预测分子标志物以筛选潜在的获益人群。其次, 目前免疫治疗在三阴性乳腺癌新辅助治疗阶段的配伍化疗方案仍值得探讨。与NeoTRIPaPDL1研究相比, IMpassion031研究在配伍化疗方案方面最显著的差异便是有无联合蒽环类方案。蒽环类药物作为乳腺癌的基石方案, 不仅对肿瘤具有直接的细胞毒作用, 也可以更好的通过刺激免疫源性从而诱导肿瘤细胞死亡。既往的TONIC研究提示, 短期应用多柔比星以及顺铂可以诱导更为有利的肿瘤免疫微环境, 从而提高PD-1抑制剂纳武利尤单抗在晚期三阴性乳腺癌中的治疗效果[8]。因此, 如何选用更为合适的化疗配伍方案, 从而提高肿瘤的抗原免疫应答, 将“ 冷肿瘤” 转变为“ 热肿瘤” , 也将成为乳腺癌新辅助免疫治疗的新方向。再次, 尽管本研究证实阿替利珠单抗的加入给试验组患者带来了显著的pCR获益, 且在EFS、DFS及OS的生存数据中也看到了可能获益的趋势。但由于该数据尚不成熟, 目前仍不清楚使用阿替利珠单抗后pCR的改善对远期生存获益的影响, 两者之间的关系仍需要等待更长时间的随访。最后, 将免疫治疗推向早期阶段的同时也需要特别关注免疫不良事件的发生。在本研究中, 尽管总体安全性良好可控, 但值得注意的是试验组中仍有7%的患者出现了不同程度的甲状腺功能减退。未来如何探寻潜在风险人群, 挖掘免疫不良反应的早期监测指标亦是免疫治疗在新辅助治疗阶段顺利开展的关键。
在三阴性乳腺癌新辅助治疗阶段采用免疫治疗目前仍面临着诸多挑战, 期待后续更多研究可以进一步揭示相关预测指标、最佳联合方案以及获益人群等, 从而使三阴性乳腺癌患者获得更为科学合理的临床诊治, 提高患者的生存水平。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|