作者简介:
罗梅(1979-),女,新疆乌鲁木齐人,主任医师,医学博士,研究方向为心血管疾病治疗。
目的 分析过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma, PPARγ)启动子甲基化与心肌梗死的相关性。方法 将研究对象分为心肌梗死组(110例)及对照组(102例),甲基化特异性实时荧光定量聚合酶链技术(methylation-specific real-time fluorescence quantitative polymerase chain technology,qMSP)分析两组 PPARγ基因启动子甲基化水平,对比分析其与心肌梗死的相关性。结果 心肌梗死组与对照组一般资料比较,差异均无统计学意义( P>0.05)。心肌梗死组中血糖,总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白(low density lipoprotein,LDL-c)显著高于对照组( P<0.05)。心肌梗死组 PPARγ启动子甲基化率显著高于对照组。无论甲基化发生在CpG-1或CpG-2,甲基化组的PPARγ mRNA表达水平均显著低于非甲基化组。心肌梗死组中 PPARγ基因启动子区甲基化水平与TC、TG、LDL-c、脂蛋白a呈正相关,与高密度脂蛋白(high density lipoprotein,HDL-c)呈负相关,差异具有统计学意义( P<0.05);对照组中 PPARγ基因启动子区甲基化水平与年龄呈正相关,且有统计学意义( P<0.05)。心肌梗死组的糖尿病患者中, PPARγ基因启动子区甲基化水平与狭窄程度呈正相关,且有统计学意义( P<0.05)。结论 PPARγ启动子甲基化与心肌梗死存在相关性,其下降可能对心肌梗死起到保护作用,有望作为心肌梗死治疗的一个新靶点。
Objective To analyze the correlation between peroxisome proliferator-activated receptor gamma ( PPARγ) promoter methylation and myocardial infarction.Methods The research subjects were divided into myocardial infarction group (110 cases) and control group (102 cases). Methylation-specific real-time fluorescence quantitative polymerase chain technology (qMSP) was used to analyze the methylation level of PPARγ gene promoter in the two groups and analysis its correlation with myocardial infarction.Results There was no significant difference in the general data between the myocardial infarction group and the control group ( P>0.05). The blood glucose, total cholesterol (TC), triglyceride (TG) and low density lipoprotein (LDL-c) in the myocardial infarction group were significantly higher than those in the control group ( P<0.05). The methylation rate of PPARγ promoter in the myocardial infarction group was significantly higher than that in the control group. Regardless of whether methylation occurs in CpG-1 or CpG-2, the expression level of PPARγ mRNA in the methylated group was significantly lower than that in the unmethylated group. In the myocardial infarction group, the methylation level of PPARγ gene promoter region was positively correlated with TC, TG, LDL-c, lipoprotein(a), and negatively correlated with high density lipoprotein (HDL-c). In the control group, the methylation level of PPARγ gene promoter region was positively correlated with age and was statistically significant ( P<0.05). Among diabetic patients in the myocardial infarction group, the methylation level of the PPARγ gene promoter region was positively correlated with the degree of stenosis, and was statistically significant ( P<0.05).Conclusions There was correlation between PPARγ promoter methylation and myocardial infarction, and its decrease may play a protective role in myocardial infarction, and it may be a new target for the treatment of myocardial infarction.
心肌梗死(myocardial infarction, MI)是世界范围内最常导致死亡的疾病之一。心肌梗死治疗最常用手段是经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI), 其在改善心功能、提高患者预后生活质量等方面优于溶栓治疗。心肌纤维化是心肌梗死后常见的病理变化, 典型的心肌纤维化特征是心肌成纤维细胞(cardiac fibroblast, CF)过度增殖和细胞外基质(extracellular matrix, ECM)蛋白在心肌的沉积[1, 2]。研究表明, 多种因素与心肌梗死的发生和发展有关, 如血脂浓度、血压、吸烟、糖尿病和局部炎症等[3, 4]。因此寻找有效的治疗靶点并以此研发新的治疗手段十分重要。心肌梗死的发病率逐年增加, 但是, 该病的病因尚未明确。通过对该疾病的遗传学进行深入研究可以阐明心肌梗死的分子机制。
过氧化物酶增殖体激活受体γ (peroxisome proliferator-activated receptor gamma, PPARγ )是由配体激活的核受体转录因子超家族的成员。PPARγ 在脂肪组织中分布最为丰富[5]。PPARγ 信号通路对于心血管系统中各种生物过程的调节至关重要[6]。同时, PPARγ 在结肠、脾脏和巨噬细胞中大量表达, 并被认为通过对基因转录发挥作用, 进而调节脂肪细胞分化、脂质代谢和葡萄糖稳态[7]。多项研究表明, PPARγ 是心肌纤维化过程中的一个抑制因子。此外, 还发现PPARγ 具有抑制炎症和损伤的作用, PPARγ 合成激动剂能提高糖尿病合并心肌梗死患者炎性因子水平[8]。这些结果表明PPARγ 可能是一种抗炎介质, 在炎症性疾病中起到保护作用。
因此, 本研究旨在确定心肌梗死患者PPARγ 启动子甲基化模式及其与血浆炎症细胞因子水平相关性, 探讨PPARγ 在心肌梗死进展中的作用, 并探讨其作为监测生物标志物的可能性。
选取2016年12月至2018年6月在新疆医科大学第五附属医院心血管内科住院治疗的全部符合纳入和排除标准的急性心肌梗死患者110例作为病例组(行急诊PCI患者为76例), 同期选取性别和年龄匹配的102例参加体检且诊断结果为无心血管疾病人群作为对照组。该方案经新疆医科大学医学伦理委员会批准, 患者及健康体检人群均签署知情同意书。
纳入标准:符合我国2019年《急性ST段抬高型心肌梗死诊断和治疗指南》以及2012年美国心脏病学会基金会/美国心脏协会(American College of Cardiology Foundation, ACCF/American Heart Association, AHA)《不稳定心绞痛— — 非ST段抬高心肌梗死患者管理指南》[9]的诊断标准; 进行首次PCI手术且成功植入支架者; 入院前均未服用过抗血小板药物, 性别不限, 入院时为首诊的患者; 病历资料和术后随访资料完整真实。排除标准:先天性心脏病、短暂性脑缺血发作、精神障碍、蛛网膜下腔出血、非心脏性胸痛或无心肌梗塞的充血性心力衰竭、慢性阻塞性肺病、免疫系统疾病和肿瘤患者。
诊断标准:ST抬高型心肌梗死或非ST抬高型心肌梗死的定义, 除了有记录的心肌缺血或损伤的心电图或酶学证据外, 还应符合与急性冠脉综合征相一致的临床体征或症状[10]:(1)有典型的缺血性胸痛的临床症状; (2)心电图有典型的急性心肌梗死动态演变图形; (3)肌酸激酶同工酶(creatine kinase-MB, CK-MB)或心肌肌钙蛋白T(cardiac troponin T, cTnT)超过正常上限2倍并呈动态变化。必须同时具备上述标准中的两条或两条以上方能入选。
所有研究对象入院后均予以测量相关指标并计算体质量指数(body mass index, BMI)=体质量(kg)/身高平方(m2), 记录所有入组研究对象的年龄、性别、血压, 询问并记录吸烟史、2型糖尿病史、高血压史等病史资料。患者均在入院后第2日空腹状态下执行血生化检测, 主要包括:空腹血糖、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白(low density lipoprotein, LDL-c)、脂蛋白a[lipoprotein(a), LP(a)]、高密度脂蛋白(high density lipoprotein, HDL-c)、同型半胱氨酸(homocysteine, Hcy)等检验指标, 均统一采用贝克曼生化LX20全自动生化分析仪, 由新疆医科大学第五附属医院检验科进行检验。
DNA提取参照DNA提取试剂盒(TIANGEN)说明书进行, 提取后的DNA置于-20 ℃冰箱中冻存备用, 提取后使用Nanodrop 2000紫外分光光度计和琼脂糖凝胶电泳进行定量及浓度鉴定。
按照亚硫酸氢钠修饰纯化试剂盒(Epigentek)说明书进行DNA甲基化修饰, 之后进行甲基化特异性实时荧光定量聚合酶链技术(methylation-specific real-time fluorescence quantitative polymerase chain technology, MSP), PPARγ 甲基化引物(上游:5′ -TATCCAATTCAAGCCCAGTCCTTTC-3′ , 下游:5′ -GACTAAAAATCCTAACTACGCGCT-3′ ), PPARγ 非甲基化引物(上游:5′ -TATTTTTGTTGAGGAGGA GGTTTT-3′ , 下游:5′ -TACAACTAAAAATCCTAAC TACACACT-3′ ), 以SssI修饰的人外周血DNA作为甲基化阳性对照, 聚合酶链技术(polymerase chain technology, PCR)反应条件(95 ℃预变性3 min, 95 ℃变性30 s, 54.5 ℃退火30 min, 60 ℃延伸30 s, 共40个循环; 最后72 ℃延伸10 min)。
数据表示为平均值± 标准差($\bar{x}±s$), 并通过SPSS 22.0软件进行分析。使用单向方差分析(ANOVA)中的Student's t检验进行组间比较。然后进行Dunnett的多重比较测试; 相关分析用Spearman直线相关。结果如果P< 0.05, 则视为差异有统计学意义。
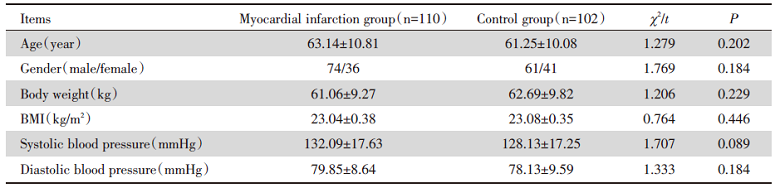
对两组患者的一般资料进行比较, 年龄、性别、体质量、BMI、收缩压和舒张压之间比较, 差异均无统计学意义(均为P> 0.05), 见表1。
| 表1 心肌梗死组与对照组患者临床基线资料比较 Tab.1 Comparison of clinical baseline data between myocardial infarction group and control group($\bar{x}±s$) |
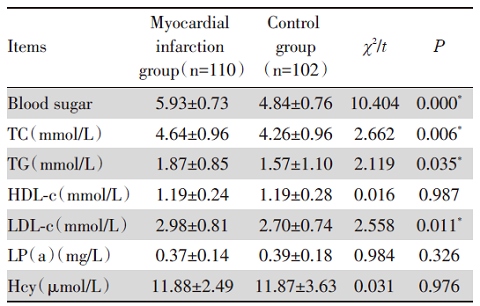
实验室检查指标中心肌梗死组中血糖、TC、TG、LDL-c显著高于对照组(P< 0.05), 其余各项指标均无显著性差异, 表明血糖、TC、TG、LDL-c可能是心肌梗死的危险因素, 见表2。
| 表2 两组患者血浆生化指标比较 Tab.2 Comparison of plasma biochemical indexes of the two groups of patients ($\bar{x}±s$) |
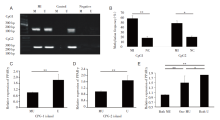
由于基因启动子会发生甲基化的状态改变, 而其改变通常会对基因的转录活性造成一定的影响, 因此我们检测了两组患者的PPARγ 的表达水平。结果表明心肌梗死组PPARγ 启动子甲基化率显著高于对照组。无论甲基化发生在CpG-1或CpG-2, 甲基化组的PPARγ mRNA表达水平均显著低于非甲基化组。随着甲基化CpG数量叠加, PPARγ mRNA降低趋势更明显, 见图1。
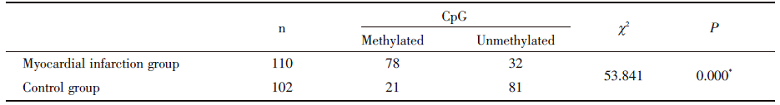
在两组患者中均检测了PPARγ 启动子中两个CpG岛的甲基化状态, 心肌梗死组PPARγ 启动子甲基化率显著高于对照组, 差异有统计学意义(P< 0.05), 见表3。
| 表3 心肌梗死组与对照组CpG岛的甲基化水平比较 Tab.3 Comparison of CpG island methylation level between myocardial infarction group and control group (n) |
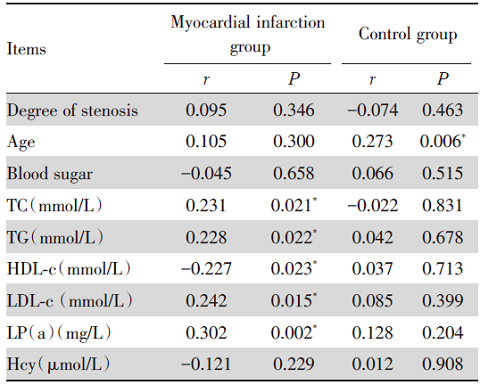
相关分析结果显示:在心肌梗死组中, PPARγ 基因启动子区甲基化水平与TC、TG、LDL-c、LP(a)呈正相关, 与HDL-c呈负相关, 且差异有统计学意义(P< 0.05)。在对照组中PPARγ 基因启动子区甲基化水平与年龄呈正相关, 且有统计学意义(P< 0.05), 见表4。
| 表4 两组患者PPARγ 甲基化和临床特征相关性 Tab.4 The correlation between PPARγ methylation and clinical characteristics of the two groups of patients |
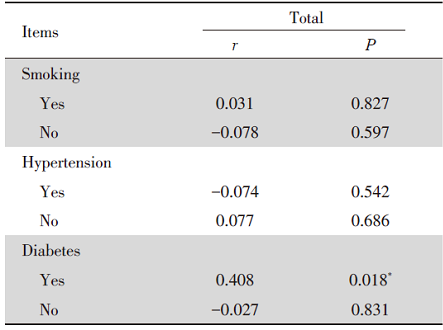
在心肌梗死组的糖尿病患者中, PPARγ 基因启动子区甲基化水平与狭窄程度呈正相关, 且有统计学意义(P< 0.05), 见表5。
| 表5 在心肌梗死组患者中PPARγ 甲基化和冠脉狭窄程度评分相关性 Tab.5 Correlation between PPARγ methylation and coronary artery stenosis score in patients with myocardial infarction |
心肌梗死是多种因素共同作用导致的冠状动脉急性、持续性缺血缺氧病变。大量的炎症细胞和炎症介质参与了心肌梗死病变发生与发展的整个过程。故抗炎症和抗氧化反应是治愈这种疾病的重点[11, 12]。本研究中, 心肌梗死组中血糖、TC、TG、LDL-c水平均高于对照组, 进一步证实了细胞及炎症因子在心肌梗死中的作用。PPARγ 基因是一类非常具有代表性的脂质代谢调控基因, 人心脏和缺血后重塑中的能量稳态取决于脂肪酸氧化(fatty acid oxidation, FAO)和葡萄糖利用之间的平衡, 并受PPAR控制。研究表明, PPARγ 激动剂能够发挥非常显著的抗炎症作用, 并且表现出抗氧化应激的功能价值, 对动脉粥样硬化的病人能够起到十分显著的治疗作用[13]。除此之外, 有证据表明, PPAR在肥大或缺血性心肌功能障碍的发展中具有关键作用, 在多种心脏疾病中, PPAR被下调或上调[14]。这些研究都表明PPARγ 基因能够发挥抗动脉粥样硬化的效果。本研究对心肌梗死患者和对照组PPARγ 启动子区甲基化水平进行测定, 结果发现, 心肌梗死组PPARγ 基因启动子区甲基化水平显著高于对照组。由此推测, 机体可能通过提高PPARγ 启动子区甲基化水平来抑制PPARγ 基因表达, 从而参与心肌梗死患者细胞及炎症因子调节。DNA甲基化是一种长期相对稳定的表观遗传修饰, 甲基基团通常共价结合在哺乳动物基因组CpG双核苷酸链序列的胞嘧啶5′ 端碳原子上。在细胞中DNA甲基化与印记作用、X染色体失活和形成有关, 也在抑制基因重复序列和转座子转录过程中起重要作用[15]。在心血管疾病中也存在全基因组和特异基因的DNA甲基化的改变, 但是它们的功能仍不清楚。
表观遗传中基因表达调控方式如DNA甲基化、RNA编辑等出现异常, 必然会对基因表达形成负面影响, 进而造成疾病进一步恶化。在本研究中, 我们首次报道了心肌梗死患者中PPARγ 启动子甲基化状态和基因表达的变化, 结果表明甲基化率的降低与心肌梗死患者PPARγ 表达水平的升高有关。CpG岛是指CpG含量丰富的DNA片段, CpG岛通常位于启动子中[16, 17]。基因启动子中CpG岛的甲基化是基因表达的重要调控模式, 通常导致基因沉默[18]。本研究对两个CpG岛所对应的甲基化状态进行了测定, 得到的结果表明, 无论甲基化发生在CpG-1或CpG-2, 甲基化组的PPARγ mRNA表达水平均显著低于非甲基化组。而此类抑制作用通常会伴随CpG岛的叠加而持续加强。并且患病组甲基化水平相对较高, 这表明PPARγ 甲基化有较大的概率影响心肌梗死的发生。
对两组间生化指标进行对比分析发现, 心肌梗死组TC、TG、LDL-c水平明显高于对照组, 而HDL-c低于对照组; 心肌梗死组内PPARγ 基因启动子区甲基化水平与多种因素存在正相关关系, 其中包括TC、TG、LDL-c、LP(a)等; 另外, 其甲基化水平与HDL-c之间主要表现出负相关关系。表明血糖、TC、TG、LDL-c可能是心肌梗死的危险因素。而PPARγ 通过脂肪细胞进行分泌, 其功能是加速脂肪细胞合成的速率, 对血脂代谢能够发挥非常显著的调节作用[19]。PPARγ 能够对脂肪的存贮展开有效的调控, 从而使人体的能量代谢保持相对平衡的状态, 并且在血管的炎性反应中发挥非常关键的作用[20]。故对PPARγ 启动子甲基化的水平进行检测, 可能为研究高血脂导致的心血管疾病提供重要的依据。尽管心血管系统表观遗传标记的功能仍不清楚, 但是人们对DNA甲基化和组蛋白修饰调节的基因转录进行了大量研究。因而开展表观遗传标志物的研究对理解心血管疾病中调控基因表达的分子机制有重要作用。
本研究还证实在心肌梗死组中, 糖尿病患者的PPARγ 启动子甲基化水平与冠脉血管狭窄程度呈正相关, PPARγ 启动子甲基化可作为糖尿病合并心肌梗死的可能因素之一, PPARγ 启动子甲基化水平的下调也许能降低心肌梗死合并2型糖尿病患者的血管堵塞程度。相关实验结果显示, 2型糖尿病患者患冠心病的几率达到较高的水平, 其大概为非2型糖尿病人群的4倍[21]。Emdin等的研究结果表明, 2型糖尿病患者的促炎性Th细胞基线水平大幅度增加, 导致糖尿病性心血管病出现的几率明显攀升[22]。综上所述, PPARγ 启动子甲基化与心肌梗死存在相关性, 其下降可能对心肌梗死起到保护作用, 对患者血清中PPARγ 启动子甲基化的检测可以指导临床对病情的判断, 还可以对高危人群提前进行预防干预, 从而减少心血管不良事件的发生, 有望作为心肌梗死治疗的一个新靶点。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|