作者简介:
黄玲(1985-),女,湖北荆州人,主治医师,医学硕士,主要研究方向为T细胞淋巴瘤的靶向及免疫治疗。
男性患者, 37岁, 于2020-08-21因“ 腹胀2月余, 双下肢水肿1月余, 活动后气促20天” 入院。患者于2020年6月无明显诱因出现腹胀, 7月出现双下肢水肿, 晨起时明显, 至广东省人民医院心内科门诊就诊, 2020-07-29心脏彩超示:考虑缩窄性心包炎, 建议结合心脏CT检查; 轻度二尖瓣返流; 中度三尖瓣返流; 中度肺高压; 少-中量心包积液。2020年8初患者出现活动后气促, 2020-08-12心脏CT示:心脏起搏器置入术后改变。心包、心脏及肺动脉周围弥漫性病变, 考虑恶性肿瘤性病变, 建议进一步18F-FDG-PET/CT检查及穿刺活检; 大量心包积液, 腹腔积液。2020-08-18行PET/CT示:(1)房室沟、心缘、下腔静脉入口旁软组织影, 双侧胸膜病变、右侧肺门淋巴结、多处骨质病变, 以上病变糖代谢增高, 考虑淋巴瘤并以上浸润。(2)大量心包积液, 大量腹腔积液, 下腔静脉入口管腔扩张, 提示心包填塞可能, 注意心功能情况。(3)18F-FDG-PET/CT体部扫描余部位未见恶性肿瘤代谢影像。(4)心脏起搏器置入术后。心脏占位及骨质改变见图1。
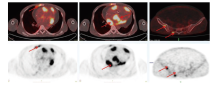 | 图1 2020-08-18 PET/CT检查心脏占位及骨质改变Fig.1 PET/CT examination of cardiac mass and bone lesions (2020-08-18) |
既往史:(1)17年前诊断肺结核, 予抗痨治疗(具体不详), 自诉痊愈。(2)2018年6月因“ 活动后气促” 在我院心内科就诊, 诊断为高度房室传导阻滞、心房颤动、限制性心肌病, 于2018-06-15行心脏起搏器置入术; 术后常规起搏器门诊复诊, 院外长期予地高辛0.25 mg qd, 利伐沙班10 mg qd抗凝治疗, 于2020-08-19自行停用利伐沙班及地高辛。无吸烟史、饮酒史及肿瘤家族史。
体格检查:T:36.2 ℃, P:67 bpm, Bp:110/83 mmHg, 体质量51 Kg, 身高164 cm, 体表面积1.54 mm2, PS评分为1分。神志清晰, 皮肤黏膜无黄染, 无皮下出血点, 无肝掌、蜘蛛痣。全身浅表淋巴结未触及肿大, 头面部无水肿, Horner征阴性, 上腔静脉压迫综合征阴性。双侧颈静脉怒张, 肝颈静脉征阴性。胸壁静脉正常, 双肺叩诊无异常, 心界向左下方增大。右侧肺呼吸音正常, 左侧肺呼吸音弱, 双下肺可闻及粗湿啰音, 未闻及胸膜摩擦音。心音低, 心率67 bpm, 为起搏律, 各瓣膜区未闻及杂音, 未闻及心包摩擦音。腹部膨隆, 腹壁静脉无曲张, 全腹无压痛及反跳痛, 未触及包块, 肝脾触诊不满意, 移动性浊音阳性。双下肢中度凹陷性水肿。神经系统检查无异常。
入院后相关检查:2020-08-21行腹腔穿刺置管术, 腹水常规:黄色, 混浊, 粘蛋白定性阳性, 红细胞3+, 凝固物阴性, 白细胞计数101× 106/L, 淋巴细胞50%, 多核细胞50%。腹水生化:氯97.6 mmol/L, 葡萄糖7.14 mmol/L, 总蛋白48.3 g/L, 乳酸脱氢酶(lactate dehydrogenase, LDH)253 U/L, 腺苷脱氨酶(adenosine deaminase, ADA)5.9 U/L。病原学:无细菌、真菌, 未发现抗酸杆菌。2020-08-26腹水细胞学示:(腹水)TCT制片及沉淀物包埋切片, 见间皮细胞、中性粒细胞及淋巴细胞, 未见明确肿瘤细胞。2020-08-27心包积液常规:黄色, 微浊, 粘蛋白定性弱阳性, 红细胞0~3, 凝固物阴性, 白细胞计数555× 106/L, 淋巴细胞48%, 多核细胞52%。心包积液生化:氯103.0 mmol/L, 葡萄糖6.39 mmol/L, 总蛋白20.1 g/L, LDH 601 U/L, ADA 5.5 U/L。病原学:无细菌、真菌, 未发现抗酸杆菌。2020-08-28心包积液细胞学示:(心包积液)TCT制片, 见间皮细胞、中性粒细胞及淋巴细胞, 未见明确肿瘤细胞。
2020-08-31在肺二科行全麻胸腔镜下心包活检(右侧进胸)+心包开窗引流+胸膜黏连松解术。术中送检胸骨后心包组织、后纵隔组织及肋膈角组织, 冰冻均可见恶性肿瘤。2020-09-10(病理)荧光原位杂交(fluorescence in situ hybridization, FISH):Cmyc基因有断裂, BCL2/IGH基因无融合, BCL6、BCL2、ALK基因无断裂; MYD88 p.L265P未检测到突变。2020-09-10病理:(肋膈角组织)非霍奇金淋巴瘤, B细胞性, 伯基特淋巴瘤。2020-09-09骨髓细胞学:骨髓增生尚活跃, 以粒系增生为主, 分类不明细胞占0.5%, 可见吞噬现象。2020-09-10骨髓病理:(骨髓活检)送检骨髓增生较活跃, 脂肪约占髓腔面积30%, 粒红系比例大致正常, 均以中晚幼阶段细胞为主, 巨核细胞不少, 形态未见明显异常。未见肿瘤。肿瘤组织二代测序提示:BCL7A、SGK1、TNFRSF14、ACTB、BTG1、DTX1、DUSP2、FBXO11、GNA13、HIST1H1E、IKBKE、LMO2、MCL1、RRM 1、SOCS1、SOX2、STXBP2突变。
2021-08-21血液学检查示白蛋白35.9 g/L, 总胆红素33.1 μ mol/L, 结合胆红素14.5 μ mol/L, LDH 399 U/L, 血钠132.9 mmol/L, 血氯91.7 mmol/L, N端脑利钠肽前体2 737 pg/mL, C反应蛋白92.97 mg/L; 血常规、丙氨酸氨基转移酶、门冬氨酸氨基转移酶、肌酐、肌酸激酶、肌酸激酶同工酶、抗核抗体谱、血管炎指标、肝炎标志物、梅毒、HIV均无异常。
入院后治疗:结合PET/CT、病理、骨穿结果, 诊断为伯基特淋巴瘤, Ⅳ B期, 国际预后指数(international prognostic index, IPI)4分。于2020-09-07开始予甲强龙40 mg qd减瘤治疗。于2020-09-11予CDOP(cyclophosphamide, pegylated liposomal doxorubicin, vincristine, prednisone, 环磷酰胺、盐酸多柔比星脂质体、长春新碱、泼尼松)(50%)化疗。后续于2020-09-27、2020-10-23、2020-11-18分别予CD20单抗(利妥昔单抗)联合CODOXM-A(cyclophosphamide, vincristine, epirubicin, methotrexate, 环磷酰胺, 长春新碱, 盐酸多柔比星脂质体, 甲氨蝶呤)、CODOXM-B(ifosfamide, etoposide, cytarabine, 异环磷酰胺, 依托泊苷, 阿糖胞苷)、CODOXM-A方案治疗。因浆膜腔积液为使用大剂量甲氨喋呤禁忌症之一, 患者持续存在大量腹水, A方案中以替莫唑胺替代甲氨喋呤。根据方案每疗程行腰椎穿刺+鞘内注射预防中枢侵犯。2周期化疗后复查PET/CT(2020-11-18)示:心脏及纵隔大血管周围病变明显缩小, 糖代谢减低(SUVmax 2.0); 双侧胸膜病变及右肺门淋巴结代谢较前减低(SUVmax 1.5), 多处骨代谢增高灶未见显示; 心包积液, 心脏增大, 双心房明显; 右侧胸腔积液; 大量腹腔积液, 下腔静脉入口管腔扩张。靶病灶达完全缓解, 但患者持续存在大量腹水。心脏及纵隔大血管病变见图2。
黄玲(淋巴瘤科医师):汇报病史特点:青年男性患者, 因“ 腹胀2月余, 双下肢水肿1月余, 活动后气促20天” 入院。入院时心脏多发占位, 大量心包积液、腹腔积液, 病情重, 进展快, 活检困难。2020-08-31行全麻胸腔镜下心包活检(右侧进胸)+心包开窗引流+胸膜黏连松解术, 诊断为伯基特淋巴瘤, Ⅳ B期, IPI 4分。化疗3程后气促明显缓解, 2周期后PET/CT评估靶病灶完全缓解(complete response, CR), 但患者持续存在大量腹水。提出讨论要点:(1)心脏淋巴瘤的影像学特征; (2)心脏多发占位性病变, 如何诊断?(3)2周期治疗后PET/CT提示靶病灶CR, 但患者持续大量腹水, 腹水的原因:肿瘤性?心源性?其他?
瘤和继发性肿瘤。原发性心脏淋巴瘤不仅位于或主要位于心脏和心包的淋巴瘤, 可以发生于心脏的任何部位, 以右心尤以右房多见, 肿瘤可向心腔内生长, 可累及心肌、心包, 引起心律失常和心包积液, 也可侵犯心脏临近大血管, 包括上、下腔静脉, 导致回流障碍, 需与肉瘤相鉴别。而转移性心脏肿瘤最常累及心包, 其次为心肌, 也可累及心内膜。该患者基线PET/CT提示病灶主要位于心肌, 累及部分心包, 代谢水平明显升高, 考虑恶性, 需与肉瘤相鉴别。
魏小娟(淋巴瘤科主治医师):原发性心脏淋巴瘤是一种罕见的恶性肿瘤, 仅占原发心脏肿瘤的1%, 占结外淋巴瘤的0.5%[1, 2], 病情进展快, 病灶主要位于心脏, 早期诊断困难, 治疗手段主要以化疗为主, 其他治疗手段包括放疗、免疫治疗和手术[2, 3], 年龄及化疗是影响预后的独立因素[4]。多数患者经抗肿瘤治疗后存活, 总生存期超过5年, 未经治疗的患者往往在1个月内死亡[5], 死亡的主要原因是未能明确诊断。
吴一龙(肿瘤学教授):患者2018年出现缩窄性心包炎, 病程持续, 至目前出现心脏多发占位性病变, 缩窄性心包炎是否因淋巴瘤引起?
黄玲:两年前该患者诊断缩窄性心包炎, 目前发生了心脏占位, 恶性淋巴瘤可以引起缩窄性心包炎, 但发生时间是淋巴瘤在前, 缩窄性心包炎在后, 目前没有证据说明缩窄性心包炎与淋巴瘤的关系, 基于两年前诊断缩窄性心包炎时并未出现心脏占位性病变, 当时未行心包活检, 未能证实恶性淋巴瘤的发生。而且, 病理诊断为伯基特淋巴瘤, 病程短(以周计), 侵袭性强, 进展快, 死亡的主要原因是未能及时获得病理诊断而延误治疗时机, 患者往往在起病1~2周内死亡。从病程来看, 该患者两年前不可能发生伯基特淋巴瘤。不过, 不能完全排除两年前发生了惰性淋巴瘤, 从而引起缩窄性心包炎, 后续病理类型发生转化, 但目前并没有惰性淋巴瘤转化为伯基特淋巴瘤的相关报道。
吴一龙:患者基线PET/CT提示房室沟、心缘、下腔静脉入口旁软组织, 双侧胸膜、右侧肺门淋巴结及多处骨质病变并糖代谢增高, 并大量心包积液及腹腔积液, 为明确诊断, 病理活检应该遵循从无创到有创的原则, 存在胸膜病变, 可行胸膜活检, 为何通过创伤性较大的全麻胸腔镜下的心包活检术进行活检?
黄玲:在病理活检方面应该严格遵循从无创到有创的原则。该患者合并大量心包积液、腹腔积液, 我们先后行腹腔积液及心包积液病理细胞学检查, 但均未见肿瘤。虽然双侧胸膜病变, 但SUVmax仅3.3, 胸膜活检获得阴性结果的可能性大, 患者病情重, 进展快, 不可耽误诊疗时机, 需要从最可能获得阳性结果的病灶处进行活检, 以快速而精准的诊断, 为患者争取治疗时机。该患者心脏病变糖代谢最高, 但心内科及心外科无法行心脏病理活检, PET/CT提示肋膈角组织糖代谢明显增高, 明确诊断的可能性大, 于是请肺二科行全麻胸腔镜下的心包活检+心包开窗引流术进行活检, 术中取得胸骨后心包组织、肋膈角组织, 病理明确诊断伯基特淋巴瘤, 临床诊断为伯基特淋巴瘤, Ⅳ 期, 高危组。
陈晓明(介入科主任医师):该患者全身多发骨质病变, 糖代谢增高, 可考虑行局麻下病变骨穿刺活检以明确诊断。
魏小娟:原发心脏淋巴瘤中B细胞淋巴瘤占92.7%[6], 约80%患者病理诊断为弥漫大B细胞淋巴瘤[7], 该患者诊断为伯基特淋巴瘤, 病理诊断是否准确?
张芬(病理科医师):伯基特淋巴瘤需与伯基特样的高级别B细胞淋巴瘤相鉴别。虽然形态学未见到典型的星空现象, 但免疫组化示:CD20(+++), CD79a(+++), 提示B细胞淋巴瘤, CD10(+++), 提示生发中心来源, Ki67几乎100%阳性, TdT阴性, 提示非母细胞来源, Bcl2阴性, Cmyc(90%+), FISH示Cmyc基因有断裂(64%), Bcl2/IGH无融合, Bcl2、Bcl6基因无断裂, 伯基特淋巴瘤诊断明确。
吴一龙:该患者经治疗后仍存在大量腹水, 如何进行疗效评价。
旁述:根据美国国立综合肿瘤网络(National Comprehensive Cancer Network, NCCN)指南, 高危伯基特淋巴瘤首选CODOXM-A/IVAC(cyclophosphamide, doxorubicin, vincristine, methotrexate/ifosfamide, etoposide, high dose cytarabine, 环磷酰胺、阿霉素、长春新碱、甲氨蝶呤/异环磷酰胺、依托泊苷、高剂量阿糖胞苷)联合CD20单抗交替治疗4程, 年轻患者经化疗后预后好, 客观缓解率(objective response rate, ORR)达93%, 完全缓解率(complete response rate, CRR)达91%, 3年总生存率达76%[8]。该患者2周期治疗后PET/CT提示心脏及纵隔大血管周围病变明显缩小(图2), SUVmax 2.0, Deauville评分3, 虽然仍有大量腹水, 但多次腹水病理细胞学并未见肿瘤, 腹水与肿瘤无关。按照2014 Lugano评价标准[9], 疗效评价CR, 且外周血ctDNA检测阴性。
杨衿记(肺内科主任医师):患者既往有肺结核病史, 缩窄性心包炎可能由结核引起; 化疗后免疫力低下, 反复出现腹水, 可能与再发结核有关。
江本元(肺外科医师):反复腹水可能为特殊病原菌感染, 可送腹水病原学基因检测, 以明确有无特殊病原体感染。
魏小娟:已多次送腹水常规、生化、病原学、细胞学检查, 未发现病原体感染, 未见肿瘤细胞。目前肿瘤控制良好, 患者持续存在腹水、双下肢水肿, 是否与心功能不全有关?
刘洋(心内科医师):患者左室射血分数60%, 左心功能良好。缩窄性心包炎影响心脏的舒张功能, 引起心输出量下降, 可引起体循环淤血, 甚至肝淤血, 引起腹水, 腹水性质为漏出液。该患者活动后气促, 乏力, 颈静脉怒张, 下腔静脉入口明显扩张, 肝肿大, 反复腹水及双下肢水肿, 临床表现符合缩窄性心包炎, 腹水性质符合漏出液, 考虑反复腹水与缩窄性心包炎有关, 为避免腹水的发生, 需要治疗缩窄性心包炎, 目前针对缩窄性心包炎最有效的办法是进行心包切除术。
吴一龙:临床工作中, 病理活检应遵循从无创到有创的原则, 以最易执行、最经济的方式诊断。目前该患者缩窄性心包炎的病因仍不明确。患者持续存在腹水, 可能与缩窄性心包炎有关, 当排除肿瘤、特殊病原体感染后, 应请心外科会诊是否可行心包切除术治疗缩窄性心包炎。
后记:讨论结束后再次送腹水常规、生化、病原学及细胞学检查, 未见特殊病原体感染, 未发现肿瘤细胞。完善腹水病原学基因检测, 尚未发现特殊病原体感染。患者已于广州市胸科医院排除结核感染, 考虑腹水与病原菌感染无关, 与肿瘤无关, 缩窄性心包炎与结核感染关系不大。目前患者已完成4疗程化疗, 待PET/CT进行疗效评价。考虑伯基特淋巴瘤复发高峰期在治疗结束后1年内, 建议患者治疗结束1年后至心外科处理缩窄性心包炎, 期间口服利尿药减轻腹水。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|



