| 周清,肿瘤学博士,主任医师,博士研究生导师,广东省肺癌研究所副所长,广东省肺癌转化医学重点实验室副主任,广东省人民医院肿瘤中心肺三科主任。兼任国际肺癌协会(IASLC)国际事务委员会委员,中国临床肿瘤学会(CSCO)副秘书长,广东省临床试验协会(GACT)/中国胸部肿瘤研究协作组(CTONG)副会长兼秘书长,中国抗癌协会第一届国际医疗交流分会副主任委员,中国女医师协会第二届临床肿瘤专业委员会副主任委员,广东省女医师协会肺癌专业委员会主任委员,广东省基层医药学会肺癌专业委员会主任委员。获聘南方医科大学、华南理工大学医学院、汕头大学博士/硕士研究生导师。 师从肿瘤学家吴一龙教授,主攻以分子靶向治疗、免疫治疗为主的肺癌多学科综合治疗,对生物标志物指导下的肺癌精准治疗、靶向治疗耐药机制和克服耐药策略研究方面有深入研究,熟练掌握肺癌的最新国际诊疗规范和前沿进展,参加100余项国际、国内多中心临床研究。主持国家十三五重点研发计划项目、国家自然科学基金面上项目、广东省自然科学基金、广州市珠江科技新星专项、吴阶平医学基金肿瘤专项、广东省医学科研基金以及广东省高水平建设医院登峰计划项目共10余项。获国家科学技术进步奖二等奖,中华医学奖一等奖,广东省科技进步一等奖两项、二等奖两项。作为主译出版译著《抗肿瘤药物I期临床研究实践指南》。发表SCI论文113篇,其中第一作者或通讯作者27篇。 |
Wu YL, Zhang L, Fan Y, et al. Randomized clinical trial of pembrolizumab vs chemotherapy for previously untreated Chinese patients with PD-L1-positive locally advanced or metastatic non-small-cell lung cancer: KEYNOTE-042 China Study[J]. Int J Cancer, 2021, 148(9):2313-2320.
1b。
KEYNOTE-042全球研究(NCT02220894)证实, 与化疗相比, 帕博利珠单抗可显著改善初治程序性死亡蛋白配体1(programmed cell death ligand 1, PD-L1)阳性, 且无EGFR/ALK基因突变的局部晚期/转移性非小细胞肺癌(non-small cell lung cancer, NSCLC)患者的总生存期(overall survival, OS)。现报道KEYNOTE-042全球研究和中国扩展研究(NCT03850444; 方案与全球研究相同)的中国人群结果。
确定帕博利珠单抗在中国单药一线治疗NSCLC患者的OS结果是否与全球数据一致。
• 研究条件:中国的27家研究中心。
• 研究时间:2016年8月26日至2020年2月21日。
• 研究方法:全球、前瞻性、随机、开放标签、Ⅲ 期临床试验。
• 研究对象:无EGFR/ALK基因突变的局部晚期/转移性NSCLC患者。
• 干预措施:入组患者按1:1随机分组, 并按以下标准分层:东部肿瘤协作组体能状态评分(Eastern Cooperative Oncology Group, ECOG)PS评分0 vs. 1、鳞癌vs. 非鳞癌、PD-L1肿瘤比例评分(tumor proportion score, TPS)≥ 50% vs. 1%~49%。帕博利珠单抗组, 接受200 mg Q3W, 最多为35个周期的治疗; 化疗组的治疗方案由研究者选择卡铂加紫杉醇或培美曲塞Q3W, 4~6个周期。鼓励非鳞癌患者选择培美曲塞维持治疗。
• 评价指标:主要终点是PD-L1 TPS ≥ 50%、≥ 20%和≥ 1%患者的OS。
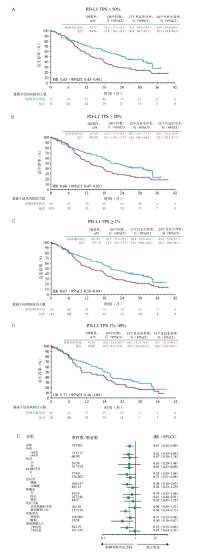
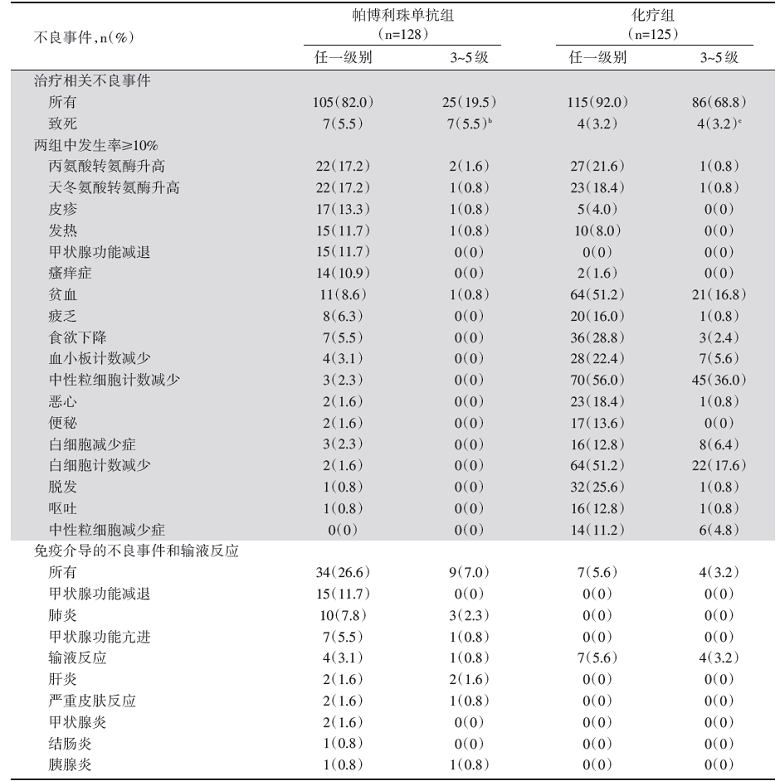
共有262例中国患者入组(帕博利珠单抗组, n=128; 化疗组, n=134)。数据截止时间为2020年2月21日, 中位随访33.0个月(范围:25.6~41.9), 与化疗相比, 帕博利珠单抗可改善PD-L1 TPS ≥ 50%[风险比(hazard ratio, HR)0.63, 95%可信区间(confidence interval, CI)0.43~0.94)]、≥ 20%(HR 0.66, 95%CI 0.47~0.92)和≥ 1%(HR 0.67, 95%CI 0.50~0.89)的患者的OS(图1)。帕博利珠单抗组3~5级治疗相关不良事件(adverse events, AE)的发生率比化疗组低(19.5% vs. 68.8%)(表1)。共有22例患者完成了35个周期的帕博利珠单抗的治疗, 客观缓解率为77.3%, 且缓解持续时间的中位值为27.6个月。
| 表1 接受治疗人群的不良事件 |
与KEYNOTE-042全球研究结果一致, 本研究证实与化疗相比, 帕博利珠单抗可改善PD-L1 TPS ≥ 1%的局部晚期/转移性NSCLC中国患者的OS, 支持一线应用帕博利珠单抗单药治疗PD-L1阳性的晚期/转移性NSCLC的中国患者。
免疫检查点抑制剂是近年火热的抗肿瘤疗法, 以其代表的免疫治疗打破了传统的肿瘤治疗模式, 并改变了驱动基因阴性晚期NSCLC的标准治疗方案, 其中, 对于PD-L1阳性、驱动基因阴性的晚期NSCLC患者一线治疗可以采用免疫治疗单药治疗, 这一方案的依据是KEYNOTE-042的研究结果。KEYNOTE-042是一项国际性、随机、开放标签的Ⅲ 期研究, 旨在比较帕博利珠单抗单药与标准铂类化疗治疗局部晚期或转移性PD-L1阳性(肿瘤比例评分TPS ≥ 1%)NSCLC患者的疗效[1]。
吴一龙教授主持的KEYNOTE-042中国研究与全球研究设计相同, 目的是确定帕博利珠单抗在中国单药一线治疗NSCLC患者的OS结果是否与全球数据一致[2]。患者按1:1随机分组, 接受帕博利珠单抗(200 mg, Q3W)治疗最多35个周期, 或紫杉醇/培美曲塞+卡铂最多6个周期, 后续可选择培美曲塞维持治疗(仅限非鳞NSCLC)。研究主要终点仍是PD-L1 TPS ≥ 50%、≥ 20%和≥ 1%患者的OS。该研究评估了262例中国患者的临床结局(全球研究中n=92; 中国扩展研究n=170), 研究中有146例(55.7%)患者TPS ≥ 50%, 204例(77.9%)患者PD-L1 TPS ≥ 20%。数据截止至2020年2月21日, 中位随访时间为33.0个月。研究结果表明, 帕博利珠单抗对比化疗显著改善了PD-L1 TPS ≥ 50%、≥ 20%和≥ 1%的患者OS。并且对于完成了35个周期帕博利珠单抗治疗疗程的患者, 客观缓解率可达77.3%, 且中位缓解持续时间为27.6个月, 提示完成疗程的患者有长久的生存获益。在安全性上无论中国研究还是全球研究都非常一致, 并未发现如肝功能损伤、免疫性肺炎这类严重的免疫相关的不良反应, 在≥ 3级不良事件的发生率方面, 帕博利珠单抗远低于化疗。该研究结果与全球研究的主要终点保持一致, 支持帕博利珠单抗在中国一线用于PD-L1阳性晚期/转移性NSCLC。
KEYNOTE-042的全球研究和中国研究结果都进一步巩固了KEYNOTE-024的研究结果, 即对于无驱动基因突变且PD-L1 TPS ≥ 50%的NSCLC患者, 一线使用帕博利珠单抗可以显著临床获益[3]。早在2016年欧洲肿瘤内科年会(European Society for Medical Oncology, ESMO)首次公布了KEYNOTE-024研究的结果, 结果显示帕博利珠单抗相比化疗, 无进展生存期(progression-free survival, PFS)延长了近4个月(10.3个月vs. 6.0个月, HR 0.50, P< 0.001); 2017年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)进一步更新了PFS2和OS结果。该研究结果直接颠覆了以往化疗在驱动基因阴性晚期NSCLC治疗中的霸主地位。随后美国食品药品监督管理局(Food and Drug Administration, FDA)就批准了帕博利珠单抗用于治疗PD-L1高表达(≥ 50%)的晚期NSCLC患者的一线治疗。然而, 对于大量PD-L1 TPS ≤ 50%的无EGFR或ALK突变的转移性NSCLC患者来说, 化疗仍然是绕不过去的选择。KEYNOTE-042研究不仅扩大患者样本量, 且PD-L1 TPS也放宽至≥ 1%, 其全球研究和中国研究的阳性结果也得到了监管机构的认可。在2019年中国国家药品监督管理局(National Medical Products Administration, NMPA)批准帕博利珠单抗单药用于一线治疗PD-L1阳性的晚期NSCLC后, 临床实践中面对初治NSCLC患者实际已有不同的治疗策略可以选择。无论鳞状还是非鳞状NSCLC, 对于PD-L1 TPS ≥ 50%的患者, 帕博利珠单抗单药的疗效明显优于化疗。而对于PD-L1 TPS 1%~49%这部分患者, 既可以选择免疫单药治疗, 亦可以选择免疫治疗联合化疗[4, 5, 6]。尽管KEYNOTE-042的PD-L1 TPS 1%~49%的获益没有统计学差异, 但帕博利珠单抗的安全性还是明显优于化疗。因此, 如不能够、不愿接受化疗或体力状况较弱的患者, 可以考虑帕博利珠单抗单药治疗, 其效果不劣于化疗, 甚至优于化疗。可以说, KEYNOTE-042研究的重要意义之一就是使PD-L1阳性、驱动基因阴性晚期NSCLC患者有了新的“ 去化疗” 的治疗选择, 这部分患者可以选择免疫单药治疗, 也能选择免疫联合化疗, 某种程度上, 一线单纯使用化疗的时代已经结束了。
该研究目的为评估中国患者在此用药方案中与全球数据是否一致, 其结果出色的完成了评估的目的, 而且从研究结果来看, 在PD-L1表达程度不同的各亚组患者中, 中国亚组数据均优于全球数据:不仅PD-L1 TPS ≥ 50%、≥ 20%、≥ 1%患者的中位OS均在20个月以上, 而且整组患者HR值为0.61~0.67, 这说明整组患者减少死亡风险近40%, 而KEYNOTE-042全球数据为TPS ≥ 50%患者降低死亡风险近40%; TPS < 50%的患者死亡风险虽逐渐升高, 但TPS ≥ 1%患者的HR为0.81, 这与中国患者数据相一致, 但在中国患者中倾向于具有更好疗效。而且从现有数据来看, 该研究结果在一定程度上也提示, 免疫治疗在东西方人群中也许存在一定疗效差异, 尤其是PD-L1低表达的患者, 这非常值得未来进一步探索。
综上所述, KEYNOTE-042中国研究作为第一个针对中国人群PD-L1阳性、驱动基因阴性晚期NSCLC患者, 评价免疫单药一线治疗疗效与安全性的Ⅲ 期研究, 接近3年的随访数据提示帕博利珠单抗单药对于中国人群能够提高生存获益, 较化疗有着更好的耐受性, 且完成2年的患者有着持久的获益, 同时, 还有几个未来需要继续探索的问题:一, 对于免疫治疗持久获益且未复发的患者, 其整体的免疫特征如何?能否发现某些规律从而扩大免疫治疗的获益人群?二, 在研究中发现治疗早期存在部分患者不获益, 针对这些免疫治疗原发性耐药的患者应该如何优化治疗模式?三, 对于进行过免疫治疗且进展的患者, 后续的最佳治疗模式是什么?相信随着医、研的共同努力, 这些问题会在不久的将来有答案。
致谢:感谢默沙东(中国)投资有限公司郑尧杰和延艳为本文翻译提供学术支持, 感谢上海北翱医药科技有限公司为本文提供辅助编辑工作, 及默沙东(中国)投资有限公司的支持。
编者说明:本文原文“ Randomized clinical trial of pembrolizumab vs chemotherapy for previously untreated Chinese patients with PD-L1-positive locally advanced or metastatic non-small-cell lung cancer: KEYNOTE-042 China Study” , 首次发表在《Int J Cancer》, 2021, 148(9):2313-2320, 本次二次发表已取得首次发表期刊的版权转让书, 对原文摘要以及图表进行翻译, 不涉及一稿多投及侵犯版权等问题。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|