| 黄诚,福建省肿瘤医院首席专家,二级主任医师,教授。擅长各系统肿瘤的内科治疗及综合治疗,尤其擅长胸部肿瘤(肺癌、食管癌、纵隔肿瘤)的诊断和多学科治疗。 参加40多项国际的多中心临床研究项目,主持省部级课题3项,在核心刊物发表学术论文70多篇,获省级科技成果2项。目前担任《中国肺癌临床指南》、《中国肺癌杂志》常务编委,《临床肿瘤学杂志》、《中国肿瘤临床与康复》编委;兼任中国抗癌协会肺癌专业委员会常务委员、中国抗癌协会癌症康复与姑息治疗专业委员会副主任委员、中国抗癌协会肿瘤临床化疗专业委员会副主任委员、中国抗癌协会肿瘤药物临床研究专业委员会委员、中国临床肿瘤学会(CSCO)常务理事、CSCO小细胞肺癌专业委员会副主任委员、CSCO中国肿瘤驱动基因分析联盟常务委员、CSCO血管靶向治疗专业委员会委员、生物标志物专业委员会委员、中国南方肿瘤临床研究协会(CSWOG)肺癌专业委员会主任委员、吴阶平基金会肿瘤多学科专业委员会副主任委员、中国药学会肿瘤药物专业委员会委员、福建省抗癌协会常务理事、福建省抗癌协会肺癌专业委员会名誉主任委员、福建省抗癌协会肿瘤内科专业委员会名誉主任委员、福建省抗癌协会肿瘤免疫治疗专业委员会主任委员。 |
Borghaei H, Langer CJ, Paz-Ares L, et al. Pembrolizumab plus chemotherapy versus chemotherapy alone in patients with advanced non-small cell lung cancer without tumor PD-L1 expression: A pooled analysis of 3 randomized controlled trials[J]. Cancer, 2020, 126(22):4867-4877.
1b。
在晚期/转移性非小细胞肺癌(non-small cell lung cancer, NSCLC)初治患者中, 无论肿瘤程序性死亡蛋白配体1(programmed death ligand 1, PD-L1)表达水平如何, 帕博利珠单抗联合铂类为基础的化疗已证实比单纯化疗更能改善临床预后。
本研究汇总了3项随机对照试验的数据, 用以评估帕博利珠单抗联合化疗与单纯化疗在PD-L1阴性[肿瘤比例评分(tumor proportion score, TPS)< 1%]的晚期/转移性NSCLC患者中的预后。
• 研究条件:分别从KEYNOTE-021研究队列(非鳞状; NCT02039674), KEYNOTE-189研究(非鳞状; NCT02578680和NCT03950674)和KEYNOTE-407研究(鳞状; NCT02775435)中汇总个体病例数据。
• 研究时间:患者于2014年11月25日至2017年12月28日期间被纳入三个研究队列。
• 研究方法:3项随机对照试验的汇总分析。
• 研究对象:PD-L1阴性(TPS< 1%)的晚期/转移性NSCLC患者。
• 干预措施:治疗包括帕博利珠单抗联合化疗(培美曲塞和铂类治疗非鳞状NSCLC, 卡铂和紫杉醇/白蛋白结合型紫杉醇治疗鳞状NSCLC)或单纯化疗。
• 评价指标:根据实体肿瘤疗效评估标准(Response Evaluation Criteria in Solid Tumors, RECST) v1.1, 通过盲态独立中心审查的方式评估疗效。在KEYNOTE-021研究G队列中, 主要疗效终点是客观缓解率(objective response rate, ORR), 关键次要终点是无进展生存期(progression-free survival, PFS)。在KEYNOTE-189研究和KEYNOTE-407研究中, 共同主要终点是PFS和总生存期(overall survival, OS), 关键次要终点是ORR和缓解时间(duration of response, DOR)。
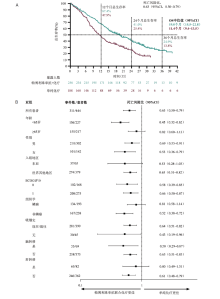
在3项试验纳入的1 328例患者中, 共有444例(33.4%)是PD-L1阴性肿瘤患者, 其中, 帕博利珠单抗联合化疗组256例(非鳞状, n=155; 鳞状, n=94; 其他, n=7), 单纯化疗组188例(非鳞癌, n=83; 鳞状, n=99; 其他, n=6)。从患者随机开始至数据截止日的中位时间为28.0个月(14.7~55.4个月)。与单纯化疗相比, 帕博利珠单抗联合化疗改善了患者OS[风险比(hazard ratio, HR)0.63; 95%可信区间(confidence interval, CI)0.50~0.79](图1)和PFS(HR 0.68; 95%CI 0.56~0.83)(图2)。帕博利珠单抗联合化疗组的16例患者完成了2年的治疗, ORR为87.5%(95%CI 61.7%~98.4%), 3年总生存率是100%。帕博利珠单抗联合化疗组和单纯化疗组中, 不良事件(adverse events, AE)发生率分别为99.2%和98.9%; 3~5级AE发生率分别为71.4%和72.0%; 免疫介导的AE和输液反应发生率分别为29.0%和12.4%。
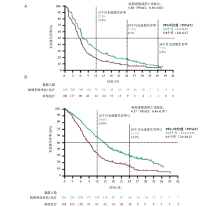 | 图2 PD-L1不表达(TPS< 1%)患者PFS的Kaplan-Meier生存曲线 注:(A)分别接受帕博利珠单抗联合化疗与单纯化疗患者的PFS; (B)分别接受帕博利珠单抗联合化疗与单纯化疗患者的PFS-2。PFS-2, 无进展生存期2, 定义为随机至开始二线治疗后进展或死亡的时间 |
在PD-L1阴性肿瘤患者中, 帕博利珠单抗联合化疗组的ORR(50.0%; 95%CI 43.7%~56.3%)高于单独化疗组(29.8%; 95%CI 23.4%~36.9%)。中位DOR分别为8.5个月(1.1+至46.0个月)和6.9个月(1.4+至30.1+个月)。
在PD-L1阴性的晚期/转移性NSCLC患者中, 与单纯化疗相比, 帕博利珠单抗联合化疗可改善患者疗效和生存, 且安全性可控。无论PD-L1表达水平如何, 帕博利珠单抗联合化疗都是晚期NSCLC患者一线的标准治疗。
NSCLC是肺癌中最常见的病理类型, 大多数NSCLC患者在确诊时已经是晚期[1, 2]。近年来, 肿瘤免疫治疗发展迅速, 免疫检查点抑制剂(immune checkpoint inhibitors, ICI), 尤其是以程序性死亡蛋白-1(programmed cell death protein-1, PD-1)/PD-L1为靶点的ICI在驱动基因突变阴性的NSCLC治疗中取得了突破性的进展, 为患者带来了生存获益, 改变了NSCLC的治疗格局, 显示出越来越重要的地位[3]。
肿瘤组织PD-L1的表达可用于挑选PD-1/PD-L1抑制剂治疗的优势人群。对于PD-L1表达≥ 50%的驱动基因阴性的晚期NSCLC, KEYNOTE-024研究结果显示帕博利珠单抗一线治疗效果优于化疗[3]。后续的KEYNOTE-042研究验证了这一结果, 同时KEYNOTE-042研究把帕博利珠单抗的获益人群扩大到PD-L1≥ 1%[4]。在驱动基因阴性NSCLC all comer人群中, KEYNOTE-021研究G队列、KEYNOTE-189研究、KEYNOTE-407研究表明无论PD-L1表达, 免疫联合化疗的疗效均优于化疗, 包括了PD-L1阴性人群[5, 6, 7]。
2020年世界肺癌大会(World Conference on Lung Cancer, WCLC)上公布的Express Ⅱ 研究中表明, 中国真实世界中PD-L1阴性人群占驱动基因阴性NSCLC患者的48.2%, 这一数据与之前公布的国际多中心EXPRESS Ⅰ 研究的趋势基本一致[8]。PD-L1阴性的人群代表着非常大的患者群体, 因此这部分患者的治疗是临床医生非常关心的话题。美国综合肿瘤网络(National Comprehensive Cancer Network, NCCN)指南和中国非小细胞肺癌免疫检查点抑制剂治疗专家共识(2020年版)中都推荐对于包括PD-L1阴性人群在内的all comer人群优先推荐免疫联合化疗, 其中不管是鳞癌还是非鳞癌, 都以帕博利珠单抗联合含铂双药化疗作为一级推荐。而仅针对PD-L1阴性人群尚无大型的Ⅲ 期临床研究来证实免疫治疗的疗效。
一项汇总了KEYNOTE-021研究G队列, KEYNOTE-189研究, KEYNOTE-407研究中个体患者数据的汇总分析初步回答了这个问题[9]。这三项研究都是使用免疫联合化疗的治疗方案。化疗已证明具有免疫调节特性, 因此与免疫疗法相结合可能会增强抗肿瘤免疫和协同活性, 有些化疗药物可以针对免疫抑制细胞(间接免疫刺激), 有些则可以针对免疫效应细胞本身(直接免疫刺激), 因此采用合理设计的联合免疫治疗的策略, 可以最大限度地提高PD-L1表达阴性人群免疫治疗的成功率。
在这项针对阴性人群的最大样本的汇总分析中, PD-L1阴性NSCLC患者接受一线帕博利珠单抗联合铂类双药化疗与单独化疗相比具有显著的临床获益和可控的安全性。帕博利珠单抗联合化疗显著降低了死亡风险, 中位OS分别为19.0个月对比11.4个月, 较对照组提高了约8个月, HR为0.63; 3年总生存率分别为24.9%对比13.8%。即使对于PD-L1阴性人群, 帕博利珠单抗联合化疗治疗的患者3年总生存率也优于化疗, 提高患者的长期生存。此外, 这一治疗方案还提高了PFS(6.9个月 vs. 5.8个月, HR 0.68)、ORR(50.0% vs. 29.8%)和DOR(8.5个月 vs. 6.9个月)[9]。
除了OS、PFS和ORR的改善外, 与单独化疗相比, 帕博利珠单抗联合化疗改善了PFS-2(14.5个月 vs. 9.1个月, HR 0.57), 这表明一线帕博利珠单抗联合化疗的临床获益在后线治疗中得以保持。尽管在最初接受单独化疗的患者中, 抗PD-(L)1治疗的交叉率很高(57.4%), 但PFS-2的HR(0.57)低于PFS(0.68); 这支持在PD-L1阴性NSCLC中优先使用一线帕博利珠单抗联合化疗。随着时间的推移, 两条PFS曲线的早期和持续分开表明, 使用帕博利珠单抗联合化疗进行早期疾病控制对于实现长期临床获益很重要。此外, 从化疗到帕博利珠单药治疗的研究交叉后观察到的OS和PFS适中(分别为约6个月和约3个月), 这进一步支持帕博利珠单抗作为一线治疗的必要性[9]。
此外, 足疗程治疗的患者获益是更加明显的, 帕博利珠单抗联合化疗组中有16例患者完成了2年的治疗。这一部分患者的ORR为87.5%(95%CI 61.7%~98.4%), 3年总生存率是100%。且所有患者在数据截止时仍然存活。因此应该鼓励患者尽量完成足疗程足剂量的帕博利珠单抗治疗, 以期获得最佳的治疗获益。
在免疫治疗时代之前, BEYOND研究表明, 贝伐珠单抗联合化疗与单纯化疗相比, 能够延长晚期非鳞状NSCLC患者的OS, 但是抗血管联合化疗并未提高患者的长期生存率[10], 因此, 免疫治疗, 特别是帕博利珠单抗, 所提供的获益程度明显比其他药物更为显著。
安全性方面, 帕博利珠单抗加化疗的免疫相关不良反应(immune-related adverse events, irAE)是可控的, 帕博利珠单抗联合化疗组和单纯化疗组任何级别的AE的发生率分别是99.2%和98.9%; 3~5级AE的发生率分别为71.4%和72.0%; 免疫介导的AE以及输注反应分别为29.0%和12.4%。虽然帕博利珠单抗联合化疗组中5级治疗相关AE的比例高于单独化疗组, 但是并未观察到新发的AE类型。
这种对个体患者数据的汇总分析, 为评估帕博利珠单抗联合化疗在PD-L1阴性人群中的疗效和安全性提供了大量数据。首先, 在纳入的三项研究中, PD-L1都是前瞻性评估的分层因素; 其次, 尽管研究之间的化疗方案不同, 但每项研究都包括根据NSCLC组织学推荐的标准铂类方案; 再次, 在KEYNOTE-189研究, KEYNOTE-407研究和KEYNOTE-021研究G队列的亚组分析中也表明, PD-L1表达阴性人群是能够从帕博利珠单抗联合化疗治疗中获益的。总之, 这项汇总分析显示, 在PD-L1阴性晚期NSCLC患者中, 帕博利珠单抗联合化疗与单独化疗相比, OS、PFS和ORR具有临床意义的疗效改善和可控的安全性。帕博利珠单抗联合化疗是晚期鳞状或非鳞状NSCLC患者(包括PD-L1阴性人群)的标准治疗一线疗法。
致谢:感谢默沙东(中国)投资有限公司支蔷和延艳为本文翻译提供学术支持, 感谢上海北翱医药科技有限公司为本文提供辅助编辑工作, 及默沙东(中国)投资有限公司的支持。
编者说明:本文原文“ Pembrolizumab plus chemotherapy versus chemotherapy alone in patients with advanced non-small cell lung cancer without tumor PD-L1 expression: A pooled analysis of 3 randomized controlled trials” , 首次发表在《Cancer》, 2021, 126(22):4867-4877, 本次二次发表已取得首次发表期刊的版权转让书, 对原文摘要以及图表进行翻译, 不涉及一稿多投及侵犯版权等问题。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|