作者简介:
卓俊城(1992-),男,广东深圳人,医学硕士,主要研究方向为抗肿瘤药物临床研究。
近年来,新辅助治疗备受人们关注,除了使不可切除肿瘤病变降期、提高保乳率等已明确的获益外,临床实践还发现,新辅助治疗对研发新药有潜在优势。术前治疗为评估生物等效性效应提供机会,使新药可能在初治的、更敏感人群中进行测试。此外,早期疗效替代指标,如病理完全缓解(pathological complete response,pCR)和残余肿瘤负荷,可提供长期预后相关的近似指标,从而潜在地缩短寻找有效辅助治疗的时间。目前,为促进抗肿瘤药物的研发,国内已陆续颁布了一系列用于指导抗肿瘤药物临床试验研究终点设计的指导原则,旨在希望能加速识别有治疗前景的新疗法,但pCR准确预测及长期预后的能力尚缺乏高级别的证据,仍需要进行反复验证。
In recent years, neoadjuvant therapy has attracted much attention. It can not only reduce the stage of unresectable tumor and improve the breast conserving rate, but also has some potential advantages in the development of new drugs. Preoperative treatment provides an opportunity to assess biological effects, making it possible for new drugs to be tested in more sensitive, untreated populations. In addition, early therapeutic alternatives, such as pathological complete response (pCR) and residual tumor burden, can provide approximate indicators related to long-term prognosis, thus potentially shortening the time to find effective adjuvant therapy. At present, in order to promote the research and development of anti-tumor drugs, a series of guidelines have been issued in China to guide the end-point design of these clinical trials. However, the ability of pCR to accurately predict and long-term prognosis is still lacking of high-level evidence, which still needs to be repeatedly verified.
历来, 早期抗肿瘤的药物注册试验设计为术后使用或不使用一种新药进行标准全身治疗。无事件生存(event free survival, EFS), 无疾病生存(diseases free survival, DFS)和总生存(overall survival, OS)定义明确、客观稳健, 是反映患者生存获益的金标准, 但试验耗时长且需较大样本量, 这样的试验设计使得用于早期癌症的潜在治疗药物的审批延迟了10年或更长时间。监管部门为加速药品上市、改善治疗可及性, 对难治疾病背景下具有突出临床获益的药物实施加速审批, 即允许使用可合理预测临床获益的替代终点, 如:病理完全缓解(pathological complete response, pCR), 客观缓解率(objective response rate, ORR)和无进展生存(progression free survival, PFS), 能极大地降低社会资源成本。
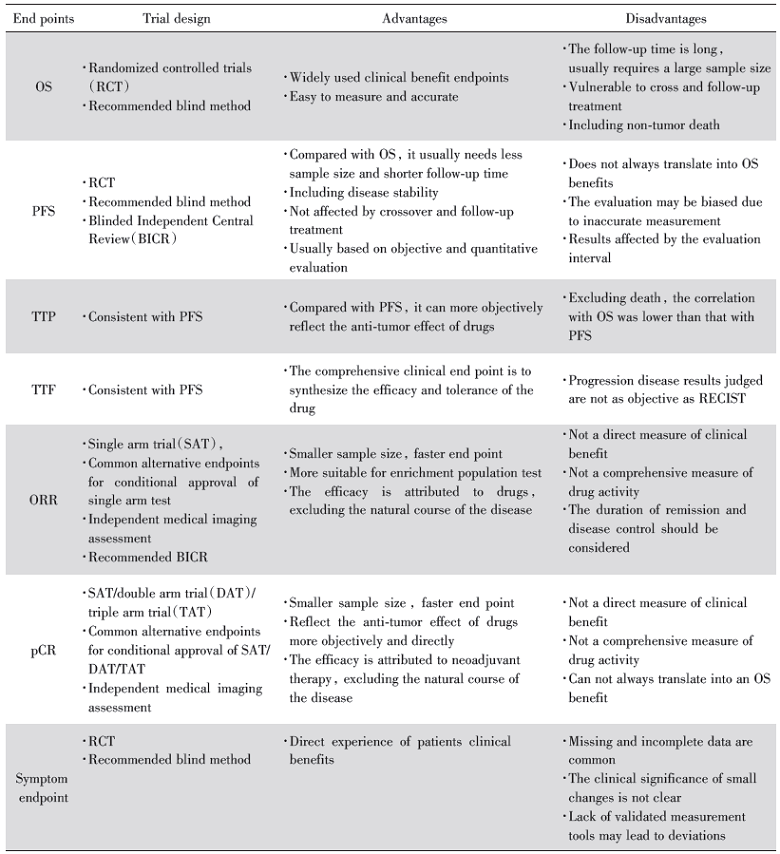
我们借鉴《晚期非小细胞肺癌临床试验终点技术指导原则》整理了临床常见的终点在表1中。抗肿瘤药物临床试验常用的终点依据来源可分为三类:基于死亡事件的终点, 如OS及OS率; 基于肿瘤测量的终点, 如采用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)评估的ORR, 或基于RECIST和访视的至进展时间(time to progression, TTP)、PFS和至治疗失败时间(time to treatment failure, TTF)等; 基于症状评估的终点如疼痛的减轻、生活质量(quality of life, QoL)等患者报告结果(patient report outcome, PRO)。
| 表1 晚期抗肿瘤药物常用临床试验终点比较 Tab.1 Comparison of common clinical trial endpoints of advanced anti-tumor drugs |
近些年, 有研究表明, 新辅助化疗后达到pCR是远期生存获益的一个重要的预后因素。在2007年, Mieog和van der Hage进行了一项meta分析, 包括14项对比新辅助化疗和辅助化疗在5 500名可手术乳腺癌患者中的临床试验。结果显示, 获得pCR的患者的死亡风险是未获得pCR的患者的一半[1]。并且, pCR相较于OS, DFS与EFS等指标, 能更快达到终点, 可以更早地把握抗肿瘤药物的研发潜力, 提高新药的研发效率。
2012年, 美国食品和药物监督管理局(Food and Drug Administration, FDA)发布了乳腺癌新辅助药物的批准指南。在指南中, pCR被定义为“ 乳腺和腋窝无侵袭性疾病” , 即Chevallier标准所描述的“ ypT0/is, ypN0” 。在随后的分析中使用了这一定义, 发现与病理检查时有残留疾病的患者相比, DFS和OS的相关性更好[1], 并建议将pCR(ypT0/is, ypN0)作为生存的替代终点[2]。同年5月, FDA批准pCR作为替代终点用于药物加速审批。FDA认为pCR是预测EFS、DFS和OS的有效指标。NeoSphere研究帕妥珠单抗将pCR由21.5%提高至39.3%[3], 据此帕妥珠单抗成为FDA第一个批准用于乳腺癌新辅助治疗的药物, 但迄今仍未看到帕妥珠单抗新辅助治疗改善生存的数据。
因此, 为了进一步论证pCR与生存获益的相关性, 近几年国内外越来越多的临床实践与临床试验都热衷于论证pCR与生存终点的相关性, 旨在为其提供充分详实的证据。这一观点同时也为研究其他抗肿瘤药物的临床试验与临床实践提供了一些新的视角。本文通过收集整理近些年pCR与生存率相关性的临床试验, 梳理pCR对临床试验设计的指导思想, 旨在能为抗肿瘤药物临床试验生存终点提供一些参考。
新辅助化疗在局部晚期乳腺癌中的有益作用, 已在许多Ⅲ 期临床试验中得到证实。新辅助治疗的优势, 在于可以给不能手术的肿瘤患者创造可手术的机会, 尤其是给乳腺癌患者增加保乳手术的机会, 并最终提高生存率。von Minckwitz等在2012年的一项研究发现, 有不良因素的患者从新辅助治疗中获益最多。乳腺癌复发的不良因素包括HER-2表达、激素受体(hormone receptor, HR)阴性[雌激素受体(estrogen receptor, ER)和孕激素受体(progestogen receptor, PR)阴性]和肿瘤分期较晚[4]。
在HannaH的研究中, pCR, 特别是总病理完全缓解率(total pathological complete response, tpCR), 和无事件生存率(EFS)以及长期疗效和安全性之间的关系, 有可能预测临床效益。该研究是一项Ⅲ 期开放随机的非劣性研究, 目的是评估固定剂量下新辅助曲妥珠单抗皮下注射治疗HER-2阳性早期乳腺癌在血药浓度和pCR方面不低于标准体重静脉输注。
结果显示, 皮下注射曲妥珠单抗的3年EFS发生率为76%, 静脉注射曲妥珠单抗的3年EFS发生率为73%。皮下注射曲妥珠单抗的三年OS率为92%, 静脉注射曲妥珠单抗的三年OS率为90%。pCR与EFS事件风险降低相关:皮下注射组风险比(hazard ratio, HR)为0.38, 静脉注射组HR为0.32。亚组的结果相似, 包括ER状态。该结果表明, 长期疗效支持皮下注射曲妥珠单抗的非劣效性, 其安全性与已知的静脉注射一致。HannaH的每个治疗组中, tpCR与EFS的改善相关, 这进一步证明了tpCR与HER-2阳性早期乳腺癌患者在新辅助治疗后临床获益的相关性[5]。
在另一项HER-2阳性早期乳腺癌的研究中, Schneeweiss论述了tpCR与DFS和PFS的相关性。该研究的目的是评估HER-2阳性早期乳腺癌患者接受新辅助的双靶治疗(帕妥珠单抗+曲妥珠单抗)联合蒽环类或非蒽环类化疗的长期疗效和心脏安全性结果。结果发现, 治疗组之间, 患者的远期DFS和PFS相似, 但达到tpCR的患者DFS有明显的改善, 同时也没有发现新的心脏安全信号[6]。
既往研究表明, pCR的获益是由基因驱动的。为了确证不同乳腺癌的分子分型对新辅助治疗后pCR的预测价值, 研究者们做了很多回顾性研究, 其中有两项代表性的临床试验对此作了深入分析。
涂刚等对214例经4周期多西他赛/表柔比星/环磷酰胺(TEC)新辅助化疗的乳腺癌患者的临床病理资料进行回顾性分析, 根据ER、PR、HER-2、Ki67的表达情况将乳腺癌分为4种分子分型:Luminal A、Luminal B、HER-2过表达型和三阴性乳腺癌。分析不同的临床病理指标、不同分子分型与pCR的相关性。结果显示, 4周期TEC新辅助化疗后tpCR率为14.0%; 单因素分析:ER、PR、Ki67、乳腺癌分子分型与pCR均具有显著相关性(P< 0.05); 乳腺癌分子分型各组间显示pCR率不同, 具体如下:Luminal A < Luminal B < HER-2过表达型< 三阴性乳腺癌; 多因素分析显示与pCR具有显著相关性的分类变量为ER和Ki67。得出的结论是ER、PR、Ki67以及乳腺癌分子分型可能是TEC新辅助化疗后乳腺癌pCR的预测指标[7]。
另一项研究是由von Minckwitz发起, 目的是探讨pCR对乳腺癌固有亚型生存的预后影响。对数据分析后, 发现在Luminal B/HER-2阴性(P=0.005)、HER-2阳性/非Luminal(P< 0.001)和三阴性(P< 0.001)肿瘤中, pCR与DFS改善相关, 但在Luminal A(P=0.39)或Luminal B/HER-2阳性(P=0.45)乳腺癌中与DFS改善无关。HER-2阳性(非Luminal)和三阴性肿瘤的pCR与良好预后相关。von Minckwitz认为, pCR是Luminal B/HER-2阴性、HER-2阳性(非Luminal)和三阴性疾病患者的合适替代终点, 但不适用于Luminal B/HER-2阳性或Luminal A肿瘤患者[4]。
在证实了pCR与生存获益的相关性后, 越来越多治疗HER-2阳性乳腺癌药物的临床试验纷纷都以pCR作为预后的指标。Clinical Trial在2020年9月公布了一项关于双靶治疗(帕妥珠单抗联合曲妥珠单抗)加化疗的新辅助真实世界研究, 旨在进一步验证pCR在真实世界的适用性[8]。
在这项多中心回顾性研究(n=243), 主要终点为pCR, 一共纳入243例可评价的HER-2阳性早期乳腺癌患者。对收集的信息进行统计分析, 接受蒽环类和紫杉类药物治疗患者的pCR为71%, 接受单药紫杉类药物治疗患者的pCR为59.3%, 接受铂类药物患者的pCR为48.6%。乳腺癌受体亚组内评估发现, HR阴性肿瘤的tpCR率(80.9%)高于HR阳性肿瘤(55.4%)(P< 0.001)。67.6%的患者获得了乳腺pCR。同时, 在143例放射完全缓解(radiological complete response, rCR)患者中, 有78.3%患者也达到pCR。磁共振成像(magnetic resonance imaging, MRI)对rCR的评估显示, 预测pCR的阴性预测值(negative predictive value, NPV)最高(83.5%)。58.7%的患者进行了保乳手术。3级和4级毒性分别有33例(18.2%)和12例(6.6%)。没有导致死亡的毒性报告。这项真实世界的分析表明, HER-2阳性的早期乳腺癌具有较高的tpCR, 新辅助的双靶治疗和化疗取得了与临床试验相当甚至更高的pCR。HR阴性肿瘤的pCR获益更高。MRI对rCR的预测能力最强。此外, 这种新辅助策略提供了可接受的安全性。
目前, 关于pCR是否可用于鉴定治疗药物降低早期乳腺癌患者复发或死亡的风险仍存在争议, 但不仅在乳腺癌, 而且在肺癌、膀胱癌和直肠癌等瘤种中, 多个新辅助随机试验已经计划或正在进行[9, 10, 11, 12]研究。这些探索性的回顾分析与思考将有助于指导不同时期临床试验生存终点的设计, 但从相关性走向替代性仍需要时间。
2016年, Milleron论证了pCR在非小细胞肺癌(non-small cell lung cancer, NSCLC)中研究应用的必要性。他认为组织学完全反应或化疗后存活肿瘤细胞的百分比可能与生存率相关, 并且有成为替代标准的可能。如果这一点能得到证实, 对NSCLC患者的获益是明显的, 可缩短术前化疗的临床研究, 使患者在围手术期更快地获得治疗[13]。
Lococo团队今年发表了一篇meta分析, 旨在整理分析NSCLC患者生存率和预后因素。在343例NSCLC患者中, 有279例接受手术治疗, 其中62例进行了pCR检测。pCR组临床分期为Ⅱ B 3例, Ⅲ A 28例, Ⅲ B 31例。结果分析发现, 术后诱导放化疗后获得pCR的患者能获得明显的长期疗效。N2单位点突变疾病和术后辅助治疗似乎与较好的预后相关, 而肺切除术与较差的预后相关[14]。
Akyil等为了进一步探讨新辅助治疗后pCR的相关因素, 并探讨pCR在NSCLC手术切除患者中的预后价值, 开展了一项meta分析[15]。根据病理报告中肿瘤的存在, 将112例患者分为pCR组和非pCR组, 分析pCR的预测因素及其预后意义。其中30例(27%)获得pCR。反应组肿瘤缩小率明显高于对照组, 是独立于T和N因素的病理完全反应的预测因子(P=0.004)。随访中30例肿瘤复发。pCR组仅1例复发, 非pCR组29例复发或转移, 有pCR应答患者的生存期也明显长于无应答患者, NSCLC新辅助治疗后肿瘤缩小率是病理完全应答的预测因素。
与此同时, 免疫检查点抑制剂(immune checkpoint inhibitor, ICI)作为诱导治疗在可切除的早期或局部晚期NSCLC患者中显示出令人鼓舞的活性和良好的安全性。在单臂临床试验中, 尤其是在免疫治疗与新辅助化疗相结合的情况下, 表现出了前所未有的病理反应率和减期率[16]。正在进行的随机Ⅱ /Ⅲ 期免疫治疗加化疗诱导的临床试验旨在验证pCR作为生存获益的替代标志物, 并证明这种治疗策略可以提高Ⅱ ~Ⅲ 期NSCLC患者的治愈率[17]。
Petrelli团队认为, 根治性膀胱切除术前的新辅助化疗是治疗肌肉浸润性膀胱癌(muscle-invasive bladder cancer, MIBC)的首选方案。与直肠癌和乳腺癌一样, OS率增加与是否达到pCR有关[18]。同时, 他们通过meta分析也论证了新辅助化疗后达到pCR的膀胱癌患者较未达到pCR的患者有更好的OS和RFS。4年后, Pignot和他的团队在这项基础上做了进一步的研究, Pignot认为膀胱癌的分子分析可能有助于在不久的将来更加准确地预测新辅助治疗预后的反应。pCR与RFS和OS的良好预后相关。尽管如此, 仍有10%~15%的病例出现疾病复发, 这说明即使在这些患者中, 局部治疗和密切随访也很重要[19]。
其实, pCR用于评价MIBC的研究和试验已经十分成熟。近期, Choi等建立并验证一个基于放射组学的模型, 用于预测MIBC患者对新辅助化疗的pCR[20]。基于影像学特征、肿瘤形态、肿瘤大小和临床分期的模型, 该方法在两种试验中均显示出良好的pCR预测性能, 在决策曲线分析中提供了更大的净收益。基于影像学的模型显示pCR阳性似然比(1.91)高于影像学和组织学预测因子(1.33~1.63)。以放射组学为基础的模型, 使用基线CT图像可以预测MIBC患者对新辅助化疗的pCR。该方法极具借鉴意义, 可对其他适合用pCR作为评价的瘤种提供参考。
局部晚期直肠癌的治疗标准是新辅助放化疗和根治性手术, pCR也被认为与更好的预后相关。在这一共识下, Rayn发现新辅助放化疗的反应因患者而异, 只有约8%~20%的患者在手术时实现pCR[21]。同时, 他认为由于缺乏足够的敏感性和特异性, 临床病理和放射学特征的应用受到限制。分子生物标志物有可能在早期预测新辅助治疗的病理反应, 但目前距离应用到临床还有一段距离。
为了确定接受新辅助治疗和标准辅助治疗的患者在pCR、DFS和OS、保留括约肌手术和回肠造口术的比率方面的差异, Kasi组织开展了系统性综述和荟萃分析。结果表明, 新辅助治疗是治疗局部晚期直肠癌的一种有前途的策略, 与常规治疗相比, pCR阳性率更高。然而, 对疾病复发和总生存率的长期影响仍需要在未来的研究中探讨[22]。
紧随其后, Petrelli在2020年对局部晚期直肠癌新辅助治疗的疗效进行了系统的回顾。共有28项研究纳入最终分析, 包括了3项回顾性研究和25项前瞻性研究, 共3 579例患者, 其中2 688例接受新辅助治疗治疗, 891例接受新辅助放化疗。在所有接受新辅助治疗(total neoadjuvant therapy, TNT)的患者中, 合并pCR率为22.4%。在比较研究中, 发现新辅助治疗可使pCR的几率增加39%。在标准新辅助放化疗的基础上加用诱导或巩固化疗可提高pCR率。并且, 有pCR应答的患者的DFS和OS也有明显的延长[23]。
中国人民解放军总医院近期发表的一篇研究也与之一致, 他们发现162例晚期直肠癌患者中, 经过新辅助放化疗后, 有28例获得pCR, 占比为17.3%。同时, 研究者们发现肿瘤占位、肿瘤最大直径、新辅助放化疗与手术间隔时间, 可以预测直肠癌的pCR, 从而间接预测患者的生存获益[24]。
综合其他文献综述, pCR对于直肠癌的生存获益已得到初步的判断, 但仍需进一步高级的证据来论证其相关性。同时, 用于预测pCR的分子生物标志物也需要在未来的临床试验中得到论证。在临床中积累足够的证据后, 方可建立合理的评价体系, 以促进直肠癌治疗药物的研发。
为指导我国抗肿瘤生物类似药的临床研发, 提供可参考的技术标准, 在国家药品监督管理局(National Medical Products Administration, NMPA)的部署下, 秉承《抗肿瘤药物临床试验终点技术指导原则》和《抗肿瘤药物临床试验技术指导原则》的指导, 近几年, NMPA陆续公布了NSCLC、肝癌、非霍奇金淋巴瘤和乳腺癌等生物类似药临床试验指导原则[25, 26, 27]。
NMPA正在形成一种共识, 即主要研究终点的选择应基于能敏感甄别出候选药与参照药的临床疗效差异, 而肿瘤新药临床试验中常用的疗效终点, 如PFS、OS, 并不是最敏感的指标。上述的指导原则均强调, 将ORR作为研究终点, 可以缩短观察药物疗效与安全性, 适用于大多数抗肿瘤药物临床试验。
在2020年7月与2021年4月, 药审中心分别制定了注射用曲妥珠单抗和帕妥珠单抗的类似药临床试验指导原则。在这两项原则中, NMPA首次建议将pCR作为研究终点, 应用于HER-2阳性早期乳腺癌新辅助治疗和转移性乳腺癌一线治疗的敏感的疗效终点指标[28]。
该原则明确表示, 欧洲药品管理局(European Medicines Agency, EMA)推荐选择可直接反映药物作用活性的临床终点如ORR或pCR[29]。曲妥珠单抗的临床试验数据的荟萃分析也提示, pCR和ORR分别为HER-2阳性早期乳腺癌新辅助治疗和转移性乳腺癌一线治疗的敏感的疗效终点指标, 可作为曲妥珠单抗生物类似药临床有效性比对研究的主要终点。选择HER-2阳性早期乳腺癌新辅助治疗适应证, 可以pCR作为等效性评价的主要疗效终点, 在获得pCR结果后, 建议继续开展辅助治疗研究, 同时提供EFS、DFS等次要终点指标作为支持。
早期疗效替代指标, 如pCR、ORR和残余肿瘤负荷, 可提供长期预后相关的近似指标。在抗肿瘤药物的生物等效性试验中, 能较早观察到终点, 缩短药物研发时间, 降低社会资源成本。随着对患者从新药中获益的更深入了解, 随后的试验可以在更具针对性的人群中对术前药物进行评估。同时, 新辅助治疗后残留的疾病应被视为早期肿瘤临床试验中患者选择的重要生物标志物。
目前, pCR在抗肿瘤药物生物等效性试验的应用较少, NMPA制定的指导原则为pCR应用在评价生物等效性试验提供了技术支持, 同时给予探索研究终点的临床试验与临床实践高度的认可。在临床试验的早期, 如将pCR纳入生物等效性试验, 能够为抗肿瘤药物后期临床试验的研究终点提供有价值的参考, 也为验证其生存获益的相关性预留出论证的空间。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|