作者简介:
刘思阳(1991-),女,黑龙江双鸭山人,医学博士,主要研究方向为肺癌免疫治疗预测性生物标志物。
2020年突如其来的新冠肺炎疫情为医疗界带来了前所未有的挑战,但晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的研究依旧如火如荼。其中多项重磅级临床研究引领了临床实践的变革,如:ADAURA研究显示第三代EGFR酪氨酸激酶抑制剂在NSCLC患者辅助治疗中发挥显著的疗效;Lung ART研究得出结论,不推荐适形放疗作为完全切除ⅢA N2期NSCLC患者术后常规治疗;MET抑制剂、RET抑制剂为具有相关靶点的晚期NSCLC患者提供了新的精准治疗方法。此外,无论是对于早期还是晚期NSCLC,靶向治疗与免疫治疗都有重要的临床研究进展。可以预见,在未来的十年间,NSCLC将迎来前所未有的治疗变革。
The COVID-19 outbreak of 2020 presents unprecedented challenges for the medical community. However, non-small cell lung cancer (NSCLC) research remains in full swing. Several of these important advances have led changes in clinical practice, such as the ADAURA study showing significant efficacy of third-generation EGFR- tyrosine kinase inhibitor in the adjuvant treatment of NSCLC patients, the Lung ART study concluding that conformal radiotherapy is not recommended as routine postoperative treatment for patients with completely resected stage ⅢA N2 NSCLC, MET inhibitors and RET inhibitors provide new precision therapies for patients with advanced NSCLC with relevant targets. In addition, there are important clinical research advances in targeted therapy and immunotherapy for both early and advanced NSCLC. It is foreseeable that in the next decade, there will be unprecedented therapeutic changes in NSCLC.
2020年世界卫生组织全球癌症监测数据显示, 肺癌依旧高居我国癌症发病率、死亡率首位[1]。非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌总病例数约80%, 且确诊时多为晚期[2]。作为主要的肺癌类型, NSCLC的治疗一直以来都是临床研究与探索的热点。与10年前相比, NSCLC治疗发生了突飞猛进的变革, 分子学诊断的实施及靶向药物的应用大幅提升了驱动基因阳性人群的临床获益; 程序性死亡受体1(programmed death 1, PD1)和程序性死亡配体1(programmed death ligand 1, PD-L1)抑制剂为代表的免疫治疗横空出世, 相关高级别循证医学证据不断涌现, 在为NSCLC提供了更佳治疗选择的同时, 亦填补了NSCLC的某些治疗空白; 更多治疗选择让NSCLC真正进入全程管理、长期获益时代。
2020年突如其来的新冠肺炎疫情为医疗界带来了前所未有的挑战, 但NSCLC的研究依旧如火如荼:多项重磅级临床研究引领了临床实践的变革, 针对罕见突变类型的新型靶向药物研发呈井喷之势, 国产免疫治疗药物百花齐放。可以预见的是, 在未来的十年, NSCLC将迎来前所未有的治疗变革。
大型Ⅲ 期FLAURA临床研究给予三代表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors, EGFR-TKI)奥希替尼一线治疗强有力的循证支持, 奥希替尼单药中位无进展生存期(progression-free survival, PFS)、中位总生存期(overall survival, OS)达18.9个月、38.6个月, 对比一代TKI组为10.2个月、31.8个月[3, 4]。基于此, 奥希替尼在EGFR突变NSCLC患者辅助治疗中能否发挥更好的疗效引起广泛关注, 2020年公布的ADAURA研究对此给出了明确答案。
ADAURA研究是一项国际多中心、随机化、双盲、安慰剂对照Ⅲ 期临床研究, 纳入682例接受根治性手术的Ⅰ B/Ⅱ A/Ⅲ A期NSCLC患者, 伴外显子19缺失或L858R型EGFR突变, 接受或不接受辅助化疗。受试者1:1随机分为两组, 分别口服奥希替尼或安慰剂治疗, 直至疾病复发、完成治疗周期或符合停药标准。研究主要终点为研究者评估的Ⅱ /Ⅲ A期患者无病生存期(disease free survival, DFS), 假设DFS的风险比(hazard ratio, HR)为0.70。次要终点为总人群DFS、无病生存率、OS、安全性及健康相关生活质量。研究计划治疗时间3年, 计划随访至5年。研究实施过程中由于研究组的显著疗效, 独立数据监测委员会建议提前揭盲。根据研究中期分析结果, Ⅱ /Ⅲ A期人群与总体人群奥希替尼中位DFS尚未达到, DFS获益仍在持续。Ⅱ /Ⅲ A期人群奥希替尼组无病生存率为90%, 对比安慰剂组44%, 疾病进展风险降低83%[HR 0.17, 99.06%可信区间(confidence interval, CI)0.11~0.26, P< 0.001], 与总人群DFS风险降低(80%)一致。此外, 奥希替尼可降低72%的脑转移风险(HR 0.18, 95%CI 0.10~0.33)。OS数据尚未成熟, 还需等待更多数据披露[5]。因ADAURA中期分析所呈现出的显著疗效, 美国食品药品监督管理局(Food and Drug Administration, FDA)已批准奥希替尼术后辅助治疗适应证, 中国国家药品监督管理局药品评审中心(Center for Drug Evaluation, CDE)也给予优先审评资格。
为降低根治术后患者复发风险, 改善患者长期生存, 术后放疗(postoperative radiotherapy, PORT)曾被认为是可选方案之一。1998年《Lancet》发表的系统性回顾及荟萃分析显示, 接受PORT患者对比无PORT患者死亡风险增加21%, 相当于2年生存率绝对数值降低7%。亚组分析显示, 这一效应在N0~N1人群中最为明显, 但PORT对N2患者生存结局的负面影响不明确。这项荟萃分析虽然成为否定早期患者PORT的定论性研究, 但N2患者是否需要PORT仍需进一步探明[6]。加之如今新辅助/辅助治疗药物种类日趋多元化, 外科术式、放疗方式相比20年前均有大幅改进与提升, N2患者PORT的临床价值需要通过更新、更大规模的随机对照试验(randomized controlled trial, RCT)进行验证。
欧洲大型多中心Ⅲ 期Lung ART临床研究应运而生。该研究纳入501例经组织或细胞学证实淋巴结侵犯的N2期NSCLC患者, 根治术后1:1随机分为两组, PORT组接受适形放疗(54 Gy/27~30 F), 无PORT组为对照, 主要终点DFS, 中位随访4.8年。96%受试者接受新辅助/辅助化疗。研究显示, PORT组中位DFS为30.5个月, 对照组为22.8个月, 虽然在数字上似乎降低了15%的疾病复发风险(HR 0.85, 95%CI 0.67~1.07), 但无显著性差异(P=0.16)。分析DFS事件类型发现, PORT组纵隔复发率相较对照组有大幅下降(25.0% vs. 46.1%), 但同时发现, PORT组死亡事件发生率高于对照组(14.6% vs. 5.3%)。次要终点3年总生存率两组患者相近, PORT组66.5%对比对照组68.5%。分析比较两组患者死亡原因发现, 虽然PORT因疾病进展或复发致死的比例有所降低, 但伴随着心肺事件、第二原发瘤、放疗或化疗相关毒性致死比例的升高, 尤其是心肺事件致死, PORT组为16.2%, 是对照组的8倍(2.0%)。反映在治疗安全性方面, PORT组早发、迟发≥ 3级放疗毒性发生率为12.8%、15.8%, 高于对照组7.7%、9.7%; PORT组放疗相关毒性事件以3/4级迟发性心肺毒性最为明显, 发生率为10.8%, 而对照组仅为4.9%。因此, Lung ART研究结论认为, 不推荐适形放疗作为完全切除Ⅲ A N2期NSCLC患者术后常规治疗[7]。
1.3.1 MET14外显子跳读突变
间质-上皮细胞转化因子(mesenchymal-epithelial transition factor, MET)14外显子跳跃突变可导致MET基因降解减少, 进而上调MET信号通路, 导致肿瘤发生; 该类变异在NSCLC人群中的报道比例为2%~4%, 常见于老龄患者。METΔ 14不仅与更差的OS相关, 还可作为MET-TKI疗效的负向预测因子, 尤其是在肺肉瘤样癌中[8]。
Capmatinib治疗METΔ 14与MET扩增NSCLC患者的Ⅱ 期临床研究(GEOMETRY mono-1)中显示, 在METΔ 14患者中, capmatinib后线治疗69例患者可实现41%客观缓解, 在初治患者中客观缓解率(objective response rate, ORR)可达68%, 两类人群中位缓解持续时间为9.7个月与12.6个月。Capmatinib已被FDA批准用于NSCLC MET14外显子跳读突变的晚期患者[9]。
Tepotinib治疗METΔ 14 NSCLC患者的单臂、开放性Ⅱ 期临床研究纳入152例患者, 99例患者至少随访9个月。独立评审ORR达46%, 中位缓解时间11.1个月。该研究还探讨了不同取样形式所明确的METΔ 14患者接受tepotinib的疗效:液体活检患者ORR为48%, 组织活检患者ORR达50%。3级以上药物相关不良反应为外周水肿, 发生率约7%[10]。Tepotinib也已被美国FDA和日本批准用于NSCLC MET14外显子跳读突变的晚期患者。
1.3.2 RET融合
RET(rearranged during transfection)相关通路可激活MAPK(mitogen-activated protein kinase)、PI3K-AKT(phosphatidylinositol 3-kinase-protein kinase B)等信号通路, 从而促进癌症发生发展。RET融合发生于RET基因与不相关的伴侣基因形成融合基因, 后者表达蛋白可使RET通路发生非配体依赖性激活; 最为常见的融合形式为KIF5B-RET(kinesin family member 5B -RET)、CCDC6-RET(coiled-coil domain-containing protein 6-RET)等。RET融合在NSCLC人群中的报道比例为1%~2%[11], 且与更高的脑转移风险相关[12]。
RET融合NSCLC患者治疗选择较为有限。一项全球多中心RET注册研究显示, RET融合患者对于含铂双药化疗方案相对敏感, 但疗效较为有限, 一线治疗最佳缓解率为52%, 中位PFS为6.6个月[13]。早期研究曾尝试使用非选择性多激酶抑制剂治疗RET融合NSCLC患者, 但疗效有限, 且脱靶效应带来的不良反应较为明显[11]。
随着高选择性RET抑制剂的开发, RET融合NSCLC的临床治疗迎来了新机遇。2020年两项Ⅰ /Ⅱ 期临床研究揭示了RET抑制剂的疗效与安全性特征。LIBRETTO研究连续纳入105例经铂类治疗及39例未经治疗RET融合NSCLC患者, 给予selpercatinib单药治疗, 两类人群ORR分别为64%、85%。最常见的≥ 3级不良反应为高血压(14%)、ALT升高(12%)、AST升高(10%)、低钠血症(6%)、淋巴细胞减少(6%)[14]。2020年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)大会公布的ARROW研究中, pralsetinib治疗RET融合患者, 在缓解评估人群中, 初治患者ORR达73%、经治患者ORR为61%。该研究特别关注了中枢神经系统(central nerves system, CNS)疗效, 在9例存在CNS可测病灶中, 5例患者实现客观缓解, 3例患者完全缓解[15]。Selpercatinib与pralsetinib现已被美国FDA批准用于RET融合的晚期NSCLC患者。
约30%的NSCLC患者可接受根治性手术, 但尽管如此, 术后5年生存率依旧不尽如人意, Ⅰ A期患者为73%, 而Ⅲ A期患者仅为25%[16], 疾病复发是导致治疗失败的主要因素。辅助化疗虽然改善了这一部分患者的整体生存, 但获益有限。LACE协作组2008年的汇总分析显示, 基于顺铂方案的术后化疗, 可为NSCLC患者带来5.4%的总生存率绝对获益[17]。因此, 术后辅助治疗人群的治疗获益仍有较大提升空间。
2.1.1 EGFR突变NSCLC患者的辅助治疗
与非EGFR人群相比, EGFR突变NSCLC患者术后发生脑转移、骨转移风险更高[18], 因而需要疗效更佳的辅助治疗方案以降低疾病复发风险。EGFR-TKI用于辅助治疗的临床价值近些年来一直在持续探索中。早期RAIDIANT研究, 未限制治疗人群EGFR突变状态, 因而总体人群并未呈现出DFS获益; 但在EGFR突变亚组中, 厄洛替尼单药治疗的DFS风险降低。随后开展的Ⅲ 期CTONG1104研究[19]和Ⅱ 期EVAN研究[20], 首次明确证实了一代TKI单药用于EGFR突变NSCLC患者的辅助治疗可显著降低DFS风险, ADAURA研究则将辅助治疗DFS获益拓展至第三代TKI。
2020年ASCO大会公布了CTONG1104研究的更新结果, 吉非替尼单药辅助治疗DFS获益依旧显著, 意向性治疗(intended-to-treat, ITT)人群中位DFS为30.8个月, 对比化疗组19.8个月, HR 0.56(95%CI 0.40~0.79, P=0.001)。本次更新重点为最终OS结果:ITT人群吉非替尼组中位OS为75.5个月, 对比化疗组62.8个月(HR 0.92, 95%CI 0.62~1.36), 两者差异不显著(P=0.674)。结果提示吉非替尼组的DFS优势并未成功转化为OS获益, 但考虑到总体生存受后线治疗影响因素, CTONG1104研究相比以往历史研究数据, 依旧实现了极长的OS。通过事后分析发现, 吉非替尼治疗持续时间可能是影响OS获益的重要因素。治疗< 18个月的患者中位OS为35.7个月, 而≥ 18个月的患者中位OS仍未达到, 仅有41.7%患者发生OS事件, 提示生存获益仍在持续; 吉非替尼长疗程治疗可显著降低62%的死亡风险(P< 0.001)[21]。考虑到目前EGFR-TKI辅助治疗相关共识推荐疗程为≥ 2年[22], 这也意味着在规范实施靶向辅助治疗的前提下, 存在实现显著OS获益的可能。
毋庸置疑的是, EGFR-TKI用于EGFR突变NSCLC患者术后辅助治疗的策略已纳入中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)、美国国家综合肿瘤网络(National Comprehensive Cancer Network, NCCN)等中外诊疗指南, 但也由此为临床实践带来新的思考:
(1)TKI是否取代化疗成为EGFR突变NSCLC患者根治术后辅助治疗的首选?在辅助化疗作为完全切除患者临床实践标准的年代, TKI尚未广泛用于临床治疗。如今, 无论是以往的EVAN、CTONG1104研究, 还是如今的ADAURA研究, TKI辅助治疗相比辅助化疗的临床优势显而易见。除此之外, ADAURA研究的亚组分析显示, 接受辅助化疗患者的DFS获益反而不及未接受辅助化疗患者[5], 这些结果提示, 在靶向治疗时代, 需要对辅助化疗以往的标准治疗地位进行再审视。
(2)一代、三代TKI共存于辅助治疗推荐方案, 该如何选择尚未有定论。目前尚无临床研究直接比较一代与三代TKI辅助治疗疗效, 而奥希替尼对比一代TKI的一线治疗优势同样无法外推至辅助治疗人群。从全程管理、长期获益的角度来思考根治手术后NSCLC治疗策略, 综合患者疾病情况、分子学特征、治疗可负担性等情况为患者选择辅助治疗方案实为合理思路。
2.1.2 免疫治疗用于新辅助治疗
多项PD-1/PD-L1单抗用于Ⅰ B~Ⅲ A期可切除NSCLC患者新辅助、围手术期(新辅助+术后辅助)治疗的临床研究已完成入组, 部分研究已初步显现研究组方案的疗效。目前, 免疫治疗相关新辅助/围手术期治疗方案主要分为免疫单药, 以及与化疗、放化疗联合治疗方案。
(1)免疫单药新辅助治疗:免疫治疗单药相关研究开展相对较早, 如CheckMate 159(纳武利尤单抗)[23]、LCMC3(阿替利珠单抗)[24]、NEOSTAR系列研究(纳武利尤单抗± 伊匹木单抗)[25]等, 这些研究的主要病理缓解率(major pathological response, MPR)在19%~45%之间。
国产PD-1单抗信迪利单抗用于NSCLC患者新辅助治的Ⅰ b期临床研究于2020年发表, 该研究纳入40例未经治疗的可切除Ⅰ A~Ⅲ B期患者, 接受2个疗程信迪利单抗治疗后, 37例患者接受根治性切除。8例患者实现影像学部分缓解, ORR为20%。MPR为40.5%, 鳞癌患者MPR略高, 为48.4%[26]。
借鉴晚期NSCLC的治疗研究与经验, 免疫单药一般需要借助PD-L1作为疗效预测标志物来明确获益患者人群[27]。因此PD-1/PD-L1单抗单药辅助治疗的研究也延续了这一思路。上述信迪利单抗Ⅰ b期研究发现, 基线原发部位间质细胞PD-L1表达水平与病理缓解存在显著相关性(P=0.047 1)[26]。
(2)基于免疫治疗的联合方案用于新辅助治疗:上述免疫单药新辅助治疗的MPR几乎均在50%以下, 术前缩瘤效果有限。MPR作为现阶段新辅助治疗的重要替代终点, 与患者生存期存在显著相关性[28]。通过联合化疗、同步放化疗是提升新辅助治疗病理性缓解的合理思路, 2020年公布了几项免疫联合方案用于辅助治疗的临床研究。
NAMID研究[29]与SAKK16/14研究[30]设计相似, Ⅲ A期可切除NSCLC患者接受化疗联合免疫治疗3个疗程后实施手术, 术后接受免疫治疗单药辅助治疗至1年。NAMID研究使用免疫治疗药物为纳武利尤单抗, 而SAKK16/14则采用度伐利尤单抗。疗效方面, NAMID研究MPR为83%, 完全病理缓解率为63%; SAKK16/14研究MPR为60.0%, 完全病理缓解率为18.2%。
NSCLC是首个迈入靶向治疗变革门槛的实体瘤, 肺腺癌驱动基因的发现与研究直接推动了TKI靶向药物的开发与应用[31]。2020年《N Engl J Med》刊登的一篇美国大型真实世界研究突出了靶向治疗为NSCLC带来的变革性意义。通过大量人群数据比对发现, 自2001-2016年期间, NSCLC死亡率持续呈现下降趋势; 从不同时间段来看, 2013-2016年下降趋势较其他时间段更为迅猛, 而2013年这一时间点恰巧与FDA批准NSCLC一线靶向治疗的时间相吻合[32]。之后针对NSCLC靶向治疗的探索并未就此放缓, 越来越多的新型驱动基因不断被发现, 并成为药物可作用的靶点[33]。在临床实践中, NSCLC靶向治疗依旧存在许多未被满足的需求, 其中最为突出的问题之一是TKI的耐药[34]。2020年, 大量针对罕见靶点的靶向药物研究数据在ASCO、欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)等大型学术会议公布, 部分研究已刊载于高质量学术期刊。针对EGFR、间变淋巴瘤激酶(anaplastic lymphoma kinase, ALK)等经典靶点的TKI不断推陈出新, 在多项临床研究中显现出优异疗效。
2.2.1 MET扩增治疗曙光初现
携带罕见靶点人群在NSCLC总体患者中占比较低, 二代测序(next generation sequencing, NGS)技术日臻成熟, 大幅改善了NSCLC罕见靶点的临床检测便利性。如今, CSCO、NCCN指南已将基于NGS的相关诊疗推荐纳入NSCLC规范诊疗体系[35, 36]。除了上述改变临床实践的MET14外显子突变和RET融合基因外, 一些新靶点也处在黎明前的曙光阶段。
MET扩增在NSCLC人群中的报道比例为2%~5%, 常见于吸烟患者。MET扩增不仅为一类肿瘤驱动基因, 还被认为是EGFR-TKI重要耐药机制。一代TKI治疗后, 5%~22%患者出现MET扩增, 三代TKI耐药患者中MET扩增占15%~19%[8, 37]。在EGFR突变人群MET扩增致耐药的治疗方面, 国内外研究者开拓了MET-TKI+EGFR-TKI双阻断的治疗思路。国际多中心Ⅰ b/Ⅱ 期INSIGHT临床研究, 在Ⅱ 期阶段纳入55例受试者接受tepotinib联合吉非替尼治疗, 对照组接受化疗治疗。双TKI方案在MET过表达[免疫组化(immunochemistry, IHC)3+]人群及MET扩增人群中显示出PFS、OS获益:MET-IHC 3+人群双TKI对比化疗降低65%疾病进展风险(中位PFS 8.3个月vs. 4.4个月)及67%死亡风险(中位OS 37.3个月vs. 17.9个月), MET扩增人群双TKI对比化疗降低87%疾病进展风险(中位PFS 16.6个月 vs. 4.2个月)及92%死亡风险(中位OS 37.3个月 vs. 13.1个月)。双TKI组主要≥ 3级不良反应为淀粉酶升高(16%)、脂肪酶升高(13%)[38]。同系列研究INSIGHT-2正在进行中, 旨在考查tepotinib联合奥希替尼治疗MET扩增致EGFR-TKI获得性耐药NSCLC患者的疗效与安全性[39]。其他双TKI方案, 如奥希替尼联合沃利替尼治疗MET扩增EGFR突变NSCLC患者在Ⅰ b期TATTON研究中呈现出48%~64%的ORR, 因是否接受过奥希替尼治疗以及T790M突变状态而异[40]。
Capmatinib治疗MET扩增, 疗效见于拷贝数≥ 10的人群, 一线治疗ORR 40%, 后线治疗ORR 29%。常见不良反应为外周水肿与恶心, 多为1/2级[9]。
2.2.2 KRAS突变治疗砥砺前行
KRAS属于人类RAS家族成员, 编码膜结合GTP酶, 通过结合GTP并转化为激活态, 介导下游ERK/MAPK、PI3K/AKT等通路, 促进肿瘤发生。KRAS突变后, 处于组成性GTP结合状态, 持续激活下游信号通路。
KRAS突变在西方肺腺癌人群的报道比例为20%~25%, 亚洲人群为10%~15%。虽然临床占比较高, 但KRAS激酶抑制剂的研发道路却极为曲折[41]。KRAS曾被认为是不适合成药的靶点, 因经典的激酶抑制剂竞争性结合ATP, 而KRAS突变对于GTP呈高度亲和性(亲和力是ATP的1 000倍), 以往许多直接作用于KRAS-GTP的药物设计思路均以失败告终[42]。
GDP-RAS复合物中一个新的变构调控口袋结构的发现带来了转机。40%的KRAS存在12位甘氨酸向半胱氨酸的突变, 即KRASG12C, 使用KRASG12C抑制剂可使RAS持续处于GDP结合非激活态, 从而抑制其向激活态的转变[42]。基于这一机制, KRASG12C抑制剂sotorasib、adagrasib相继被开发并进入临床研究。
Ⅰ 期临床CodeBreaK100研究在129例KRAS突变的晚期实体瘤患者中考察了sotorasib的疗效与安全性, 其中59例为NSCLC患者。NSCLC亚组中, 32.2%患者实现客观缓解, 88.1%患者实现疾病控制。总体患者11.6%发生3/4级不良反应[43]。另外一项KRAS突变患者临床Ⅰ /Ⅱ 期研究NSCLC队列结果显示, adagrasib治疗经确认的客观缓解率达43%(6/14)[44]。
从药物研发进程来看, KRAS抑制剂获批用于临床治疗仍有一段距离。但值得庆幸的是, KRAS突变患者可能是目前免疫治疗的优势获益人群。KEYNOTE-042、KEYNOTE-189两项大型Ⅲ 期RCT的探索性分析结果显示, KRAS突变患者往往PD-L1表达水平更高, 提示KRAS患者接受免疫治疗可能具有更好疗效。研究结果显示, PD-L1阳性患者接受帕博利珠单抗单药治疗, 伴KRAS突变或KRAS G12C突变相比KRAS野生型患者ORR更高(56.7% vs. 66.7% vs. 29.1%), 且PFS获益富集于KRAS突变或KRAS G12C人群; 对于不区分PD-L1状态患者, 对比KRAS野生型患者, KRASG12C 人群同样能在帕博利珠单抗联合化疗中实现更高ORR(50.0% vs. 47.6%), 以及更长的PFS(11个月 vs. 9个月)[45, 46]。因此, 对于KRAS突变人群, 免疫治疗不失为合理的选择。
2.2.3 ALK阳性治疗药物争相竞逐
自ALEX研究将ALK阳性NSCLC患者中位PFS刷新至34.8个月, ALK融合/突变已成为公认的“ 钻石突变” , 通过合理的TKI治疗可实现极长生存。然而, 已有的治疗获益并未减缓ALK-TKI药物的开发速度:阿来替尼、布加替尼二代TKI临床研究数据持续更新, 劳拉替尼、恩沙替尼等三代TKI临床疗效已崭露头角。
阿来替尼对比克唑替尼用于ALK阳性NSCLC一线治疗的大型Ⅲ 期ALEX临床研究五年长生存数据于2020年ASCO大会公布。阿来替尼组中位随访已达48.2个月, 克唑替尼组23.3个月。由于阿来替尼的长生存效应, 截止至2019年11月29日, ITT人群记录到37%的OS事件, OS数据仍不成熟。阿来替尼5年生存率为62.5%, 克唑替尼组为45.5%[47]。
布加替尼对比克唑替尼一线治疗Ⅲ 期ALTA-L1临床研究公布了既定二次中期分析结果。此次分析ITT人群记录到150次PFS事件, 布加替尼组中位随访24.9个月。布加替尼对比克唑替尼的PFS依旧显著, 盲态独立评审(blinded independ review committee, BIRC)中位PFS 24.0个月 vs. 11.0个月, 相当于降低51%疾病进展风险。BIRC-PFS亚组数据分析发现, 亚裔、基线脑转移患者是PFS获益优势人群。亚裔对比非亚裔PFS风险降低分别为62%、46%, 基线脑转移对比无脑转移患者PFS风险降低分别为75%、35%[48]。
三代ALK-TKI劳拉替尼、恩沙替尼于2020年相继公布了各自Ⅲ 期临床研究的中期分析。Ⅲ 期CROWN临床研究显示, 劳拉替尼一线治疗晚期ALK阳性NSCLC的1年无病生存率显著高于克唑替尼(78% vs. 39%, P< 0.001), PFS风险降低72%, 研究组中位PFS仍未达到。基线具可测脑转移病灶患者, 劳拉替尼颅内缓解率为82%, 高于克唑替尼23%[49]。我国自主研发三代TKI恩沙替尼在前期Ⅰ /Ⅱ 期研究中显示出一线及后线治疗ALK阳性NSCLC的显著疗效, 2020年世界肺癌大会(World Conference on Lung Cancer, WCLC)公布了恩沙替尼对比克唑替尼一线治疗ALK阳性NSCLC的Ⅲ 期eXalt3研究中期分析。研究结果显示, ITT组恩沙替尼组中位BIRC-PFS是克唑替尼组的2倍(25.8 个月vs. 12.7个月), 疾病风险降低49%[50]。
2.2.4 国产新型EGFR-TKI锋芒初露
阿美替尼是我国自主研发的第3代EGFR-TKI, 对于EGFR敏感型突变及T790M NSCLC具有良好疗效。2020年美国癌症研究学会(American Association for Cancer Research, AACR)更新了阿美替尼后线治疗T790M NSCLC患者的Ⅱ 期临床APOLLO研究。研究结果显示, 阿美替尼后线治疗仍可实现68.9%的ORR, 疾病控制率达93.4%。经确认的CNS ORR、疾病控制率(disease control rate, DCR)达60.9%、91.3%。CNS中位PFS为10.8个月(成熟度47.8%)[51]。APOLLO研究所呈现的疗效与AURA研究中奥希替尼后线治疗T790M患者相近[52], 而后者一线治疗地位已由FLAURA研究所确立, 让人不禁期待阿美替尼正在进行的一线治疗Ⅲ 期临床研究相关结果。
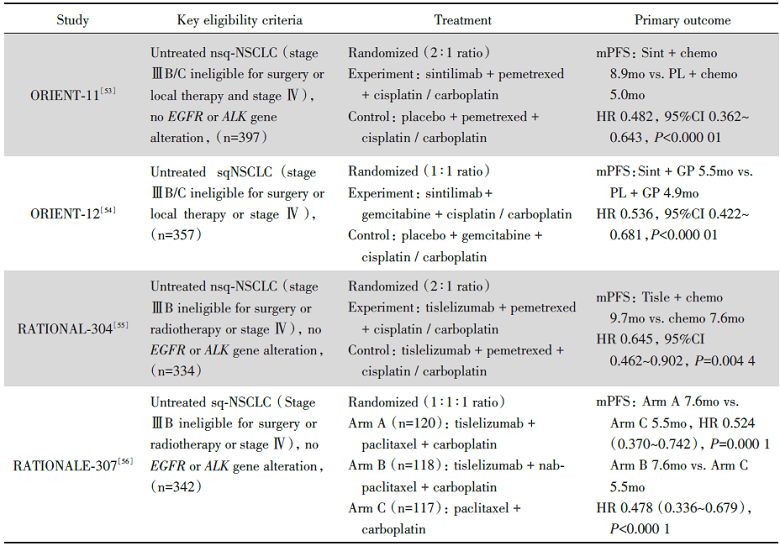
2020年, 中国自主研发PD-1/PD-L1单抗多项大型Ⅲ 期RCT研究亮相国内外大型学术会议(见表1)。从临床数据上来看, 与以往国际大型Ⅲ 期RCT如KEYNOTE-407研究(鳞状NSCLC)、KEYNOTE-189研究(非鳞状NSCLC)呈现出的PFS获益相近。KEYNOTE系列研究由于开展较早, 已观察到显著的OS获益。OS获益一直以来被公认为抗肿瘤临床疗效的金标准, 国产PD-1/PD-L1单抗能否实现最终的OS获益, 需要更长的研究随访。
| 表1 2020年中国自主研发PD-1/PD-L1单抗主要大型Ⅲ 期临床研究结果更新 Tab.1 2020 crucial phase Ⅲ trials of independently developed PD-1/PD-L1 inhibitor in China |
同时, 反观这些研究的设计思路, 亦与KEYNOTE-407、KEYNOTE-189等研究如出一辙, 但中国NSCLC患者临床特征、治疗策略、治疗需求可能与欧美人群存在差异, 因此在后续研究的设计中有待加入创新性思路。
从以上选取的2020年NSCLC治疗领域重要研究, 可以管窥未来NSCLC临床研究与药物研发趋势。一方面, 免疫治疗已成为晚期NSCLC治疗基石, 在此基础上, 更多新方案、新疗法将不断刷新临床疗效, 拓展获益人群。另一方面, NGS技术推动了NSCLC人群的不断细分, 未来将有更多的靶向治疗药物用于晚期NSCLC治疗。
PACIFIC研究代表着免疫治疗在局部晚期NSCLC最初的成功尝试[57], 但研究方案中, 免疫治疗介入时机较晚, 即在同步放化疗后。KEYNOTE-799研究采用免疫+化疗→ 免疫+同步放化疗→ 免疫单药的三步治疗策略, 设立鳞癌、非鳞癌两个队列, 采用不同化疗方案。2020年ASCO大会公布了该研究的初步结果, 鳞癌、非鳞癌队列ORR分别为64.3%、52.8%, 从数值上比较, 高于PACIFIC研究28.4%的ORR, 值得期待未来更为成熟的研究结果[58]。
除PD-1/PD-L1、细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen 4, CTLA-4)外, 越来越多的免疫检查点分子在药物研发中被作为免疫靶点。CheckMate 227研究证实了双免疫检查点抑制剂无化疗方案在NSCLC一线治疗中的疗效与安全性, 且FDA于2020年批准该方案相关适应证。在此基础上, 2020年ASCO年会公布的Ⅱ 期临床研究CITYSCAPE研究, 利用阿替利珠单抗联合tiragolumab, 后者为抗TIGHT人源化单抗, 可封闭T细胞/NK细胞TIGHT, 并促进此二类细胞活化。这一联合方案用于NSCLC一线治疗可实现31%的ORR, 两倍于安慰剂+阿替利珠单抗组(16%), 并降低43%疾病进展风险[59]。基于这一思路, 未来PD-1/PD-L1单抗有望与更多新型免疫检查点抑制剂联合用于NSCLC一线治疗的探索。
NSCLC作为个体化精准治疗的范本瘤种, 已进入高度人群细分的治疗时代。NSCLC庞大的人群基数也使其具备罕见突变研究基础。如今NGS等高通量、深度测序技术的应用日趋广泛, 加之FDA等监管部门对于分子伴随诊断的重视, 未来基于NGS的分子学检测将成为NSCLC诊断的重要组成部分。一方面是日趋精细化的分子学分型, 另一方面是针对NSCLC罕见突变的靶向药物依旧不足。欧洲一项多中心前瞻性研究发现, 在2 579例转移性癌症患者中, 虽然有近三分之一的患者接受分子学检测, 但仅有6%的患者接受与分子学检测相匹配的治疗方案[60]。
为了发掘更多罕见突变类型患者的有效治疗方案, 相关学者从临床研究设计方法上进行创新, 如篮子试验、伞形试验设计被广泛用于相关靶向药物的临床研究, 以加速药物研发进程。其中典型的例子之一为美国多中心Lung-MAP项目, 该项目针对目前驱动基因发掘严重不足的肺鳞癌, 设立生物标志物驱动方法学, 突破传统临床研究设计思路, 以篮子研究、伞形研究为两大基本框架, 详细规划了Ⅱ /Ⅲ 期系列临床研究[61]。
致谢:感谢默沙东(中国)投资有限公司医学部郑尧杰对本文提供的数据整理及文稿校对的支持。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|