林俊涛(1990-),男,广东揭阳人,医师,医学硕士,主要研究方向为肺癌的基础及临床研究。
患者, 男, 55岁, 既往吸烟者, 15包年, 戒烟6年, PS=0。主诉:“ 左上肺腺癌切除及治疗后6年余” 。
患者于2014年11月体检发现左上肺两个结节, 长径分别约2.5 cm及1.5 cm, 考虑肺恶性肿瘤, 未见纵隔淋巴结肿大及远处转移征象。2014-11-24于外院行左上肺切除术+纵隔淋巴结清扫术, 术后病理及分期:左上肺腺癌, pT3satN0M0, Ⅱ B期(按第八版分期), EGFR 19del(+)。术后行培美曲塞+卡铂辅助化疗4周期, 化疗后复查CT示双肺多发小结节影, 考虑转移。2015年4月开始口服吉非替尼。
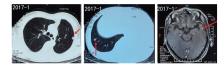
患者于2015年8月来我院门诊, 复阅术前及术后CT, 对比发现双肺结节术前即已存在(术前CT, PET/CT均未报), 予停用吉非替尼。后续定期复查CT, 发现肺内结节逐渐增大。2017年1月行头颅MR提示左侧颞叶结节, 大小约0.7 cm, 考虑转移(见图1)。诊断:左上肺腺癌, cT4N0M1b(双肺、单发脑), Ⅳ A期。
讨论1:此刻的诊治方案?
杨衿记(肺内科主任医师):该患者术后发现双肺结节, 实际术前已经存在, 却因术前影像学未报双肺结节, 同时双肺结节性质难以确定, 因此术前诊断为Ⅱ B期, 按可手术患者进行肺癌根治术+术后辅助化疗。术后发现双肺结节, 对比术前CT及PET-CT, 病灶较前增大, 考虑术前即已存在双肺转移, 首诊诊断修正为Ⅳ A期, 术后辅助治疗实际为一线治疗。而2015年4月开始口服吉非替尼为二线治疗。后续于2015年8月停药, 目前出现颅内病灶, 需明确患者是否存在症状、病灶数量、最大病灶的大小, 需注意是否使用3T MR排除脑膜转移。同时完善腰穿及脑脊液上清液二代测序(next generation sequencing, NGS), 血液NGS。
旁述:在脑膜转移的非小细胞肺癌(non-small cell lung cancer, NSCLC)患者中, 相比脑脊液沉渣, 脑脊液上清在检测驱动基因具有优势, 对于有驱动基因的患者, 脑脊液上清驱动基因检出率为100%; 且相比血液及脑脊液沉淀, 基因拷贝数扩增主要从脑脊液上清中检出[1]。同时, 脑脊液NGS对于接受奥希替尼治疗的脑膜转移患者的治疗效果及耐药谱具有一定作用[2]。
林俊涛(肺外科住院医师):该患者颅内单发病灶、无症状、最大7 mm、无脑膜转移。2017年1月发现颅内转移病灶时, 未完善腰穿及脑脊液、外周血NGS。
周清(肺内科主任医师):该患者2015年8月开始停用吉非替尼, 需明确其无进展生存期(progression-free survival, PFS)的计算。患者靶病灶已切除, 剩余双肺小结节为非靶病灶, 按照实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)1.1[3], 非靶病灶是否进展, 由研究者判断, 未出现脑病灶之前, 其余双肺结节均为缓慢进展, 肺部病灶可判断为非靶病灶, 非完全缓解(complete response, CR)、非疾病进展(progression disease, PD), 总疗效可判断为:非PD。而出现颅内新病灶, 则可准确评估为进展。从停药开始计算, PFS为17个月。
旁述:RECIST 1.1关于非靶病灶的评价如下:(1)当非靶病灶为可测量病灶时, 定义非靶病灶明确进展需要非靶病灶存在实质性的恶化, 即使靶病灶为部分缓解(partial response, PR)/疾病稳定(stable disease, SD), 但总的肿瘤负荷已增长到需要停止当前的治疗, 才可评为非靶病灶PD。(2)当患者仅有不可测量病灶时, 基本原则与上述第1点相似。但是在这种情况下, 无法明确量化肿瘤负荷。此类患者定义进展需其总肿瘤负荷的增长量级与可测量病灶相似。比如:以体积来代表肿瘤负荷, 需增加73%(等同于可测量病灶大小增加20%)。具体例子如胸腔积液从微量变为大量, 淋巴管炎从局限性变成弥漫性, 或像研究方案里面规定的非靶病灶变化达到需要改变治疗方案的程度。
李伟雄(放疗科主任医师):患者肺部病灶随访过程中逐渐增大, 但进展缓慢, 目前无需放疗。颅脑病灶小, 转移可能性大, 未来可出现多发脑转移。若此时行放疗, 放疗结束后出现多发转移, 则治疗相对棘手, 患者目前存在EGFR 19del(+), 因此建议靶向治疗, 暂不行放疗。
旁述:BRAIN研究[4]对比了全脑放疗及埃克替尼在脑转移患者中的疗效, 中位颅内PFS分别为4.8个月及10个月。对于此类人群, 埃克替尼可能为更好的治疗方式。
周清:既往钟文昭主任关于术中发现偶然M1a肺癌的文章[5]发现, 如其余部位无转移, 仅胸膜、肺裂等位置出现转移, 此类患者可存在基因突变, 生长缓慢, 出现肺外转移相对较晚。目前患者已观察约1年半, 颅内出现新转移, 病灶影像学为较典型的转移瘤, 已由无脑转移进展为脑转移, 而肺部病灶仍然较为稳定。而对于肺癌患者, 一旦出现脑转移, 则预后差, 建议此时积极治疗。考虑患者目前颅内仅有1个转移病灶, 建议可行伽马刀。肺部病灶则可观察。
旁述:对于术前评估为早期可手术的NSCLC, 而术中发现为胸腔播散的pT4-M1a Ⅳ A期患者[5]。患者人群女性比例、年轻患者及贴壁样生长模式(55%)更多见, 基本为腺癌患者, EGFR突变率为80%, 淋巴结转移少见。与行手术治疗的R1/R2切除患者对比, pT4-M1a Ⅳ A患者的PFS(18个月vs. 9个月)及总生存期(overall survival, OS)(45个月vs. 15个月)更长, 且为OS的独立预测因素。
吴一龙(肿瘤学教授):患者于停药后观察17个月, 期间未行治疗。随访行头颅MR提示颅内单发转移, 此时的决策十分具有挑战。既往回顾性研究[6]显示, 原发灶控制良好的孤立性脑转移患者行体部立体定向放射治疗(stereotactic body radiotherapy, SBRT), 预后优于原发灶未控制的患者。该患者原发灶已切除, 双肺多发转移病灶, 这例患者病史长, 在出现单发脑转移前, 病灶增长缓慢, 生物学行为偏惰性, 可考虑继续观察, 根据病灶的变化情况决定是否治疗。
旁述:既往一项多中心回顾性研究[6]纳入孤立性脑转移(1~4个转移病灶)的肺癌患者。将患者分成两组, 第一组为SBRT治疗脑转移病灶, 且此时原发灶已控制良好, 第二组SBRT治疗脑转移病灶, 同时需手术或放疗或同步化放疗控制原发灶。结果显示, 原发灶已控制良好的患者, OS为41个月, 5年总生存率为18.6%; 而原发灶需局部治疗的患者, 中位OS为18个月, 5年总生存率为0%。
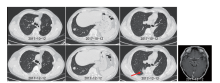
按照MTD讨论意见, 虽然已发现颅内转移结节, 但肿瘤生长非常缓慢, 转移病灶不足1 cm, 遂予继续观察。2017-10-12复查CT及头颅MR提示肺内结节无变化, 左颞叶病灶约7 mm, 9个月观察随访没有变化, 继续随访不加干预。2017-12-12行CT提示新发右下肺结节, 大小约2.0 cm, 肺部其余结节无变化, 头颅MR提示左颞叶结节0.8 cm(见图2)。
讨论2:是否需要改变治疗方案?
涂海燕(肺内科副主任医师):患者2017-12-12复查, 相较既往胸部CT及头颅MR, 仅新发右下肺, 其余肺部结节无明显变化, 自首次发现脑转移至今已11个月, 期间未行治疗, 为无治疗间期, 颅内病灶由7 mm增大至8 mm。因右下肺新发病灶, 增长速度快, 且性质未明, 建议行肺穿刺明确病理。
杨衿记:患者截止2017年12月, 颅内病灶仍为单发, 无症状脑转移, 较前仅增大1 mm, 可认为无明显变化。建议观察, 而右下肺行肺穿刺。
潘燚(放疗科副主任医师):患者2017年12月CT提示新发右下肺病灶, 由原先无明显病灶到目前约2.0 cm, 实际病灶倍增速度非常快, 生物学行为与其他病灶存在明显区别, 肿瘤出现异质性, 目前需干预, 建议肺穿刺。即使该病灶存在T790M, 仍可考虑切除该病灶, 后续继续观察。
吴一龙:患者从停药开始至2017年12月, 无治疗间期达28个月, 随访过程中出现两个标志性变化, 一为出现脑转移病灶, 二为新发右下肺结节。观察过程中我们发现, 颅内病灶及双肺病灶增长缓慢, 而后续观察中出现右下肺新发病灶, 此时病灶增长速度快。因此此时不再犹豫, 直接使用一代靶向药物吉非替尼。但需关注, 如患者酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)耐药后脑部行SBRT, 可能增加颅内放射性坏死的可能, 影响患者生活质量。
旁述:对于接受TKI治疗及非TKI治疗的患者, 在后续行SBRT治疗脑转移病灶(1~4个), 颅内放射性坏死的发生率为18.6%。接受TKI治疗的患者, 发生率高于非TKI治疗的患者(29.2% vs. 6.0%, P< 0.001)[7]。
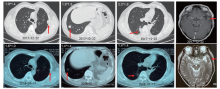
患者于2017-12-22开始口服吉非替尼, 1个月后复查提示双肺结节及左颞叶病灶明显缩小(见图3), 疗效评价SD(-23%), 后续定期复查, 病灶继续缩小, 最佳疗效PR(-74%)。
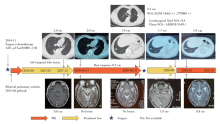
2019-06-17复查CT示左下肺病灶增大, 疗效评价PD, 考虑缓慢进展, 继续口服吉非替尼。2020-05-27行CT示左下肺病灶较前增大, 约2.3 cm(见图4)。
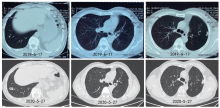 | 图4 吉非替尼治疗中发现左下肺结节逐渐增大Fig.4 Gradual increase in size of left lower lobe nodule during gefitinib exposure |
讨论3:此时肺部病变应该如何处理?
周清:患者肺部多发病灶均缓慢增大, 颅内仍未见明显病灶。需明确患者进展类型。
杨衿记:患者目前病灶逐渐增大, 左下肺及右下肺病灶增大为主, 如干预需处理两个病灶, 这不属于局部进展模式; 患者2017年12月开始用药至2020年5月, 约30个月, 症状无加重, 肺部结节逐渐增大, 颅内病灶未见显示, 按照靶向药物治疗后进展模式, 该患者属于缓慢进展, 可继续用药[8]。患者后续可能出现继续增大至进展, 可穿刺明确耐药基因, 目前已有第三代TKI, 可针对T790M突变导致的耐药。
潘燚:患者双肺病灶缓慢增大, 以左下肺病灶增大最为明显, 左下肺病灶偏外周, 肺穿刺或手术都相对容易, 建议可肺穿刺或楔形切除。
刘思旸(肺外科住院医师):该患者按照RECIST 1.1应该算PD, 按照靶向药物治疗后进展模式为缓慢进展, 按照目前治疗方式, 倾向于继续口服TKI, 同时检测循环肿瘤DNA(circulating tumor DNA, ctDNA), 根据ctDNA决定是否更改治疗模式。
吴一龙:患者在原有基础上, 左下肺病灶增大明显, 尽管其余病灶也增大, 但生长速度与左下肺病灶相比较慢, 提示左下肺生物学行为发生改变, 进展模式类似于局部进展, 需积极干预。而该病灶位于外周, 手术难度不大, 可手术切除, 同时行NGS明确其耐药机制, 如检出T790M突变, 则提示为肿瘤异质性表现。其他病灶增长缓慢, 可停用一代TKI。
患者于2020-06-01行左下肺楔形切除术, 病理提示为腺癌, 组织行NGS提示:EGFR19外显子缺失(19.2%)、T790M突变(13.5%)、CDC73突变(12.7%)、GNA11突变(10.5%)、HDAC2突变(12.4%); 血液NGS未见基因改变。予停用吉非替尼。
2020-09-07行头颅MR提示:原脑转移灶消失部位见转移瘤, 大小约1.8× 1.3 cm。2020-09-11行血NGS提示:ARID1B(0.4%)。脑脊液NGS无法检测。2020-09-21口服吉非替尼。2020-10-27复查头颅MR提示:脑转移病灶较前缩小, 约0.8 cm。
2021-01-22行CT示:双肺多发结节, 部分较前增大, 考虑转移。2021-01-23行头颅MR:左侧颞叶结节, 0.9 cm, 颅内多发点状影。患者诊治过程见图5。
目前诊断:左下肺腺癌, cT4N0M1a(肺、脑), Ⅳ A期。
讨论4:下一步如何治疗及对临床的启示?
董嵩(肺外科副主任医师):患者于2017年12月开始吉非替尼治疗后, 2020年5月之前的头颅MR都提示颅内未见明显结节, 2020年9月左侧颞叶结节明显增大, 服用吉非替尼治疗后, 颅内病灶于2020年10月缩小至0.8 cm。而实际当我们对比2020年5月及2020年10月的头颅MR, 发现左侧颞叶的病灶相似。因此, 目前关于颅内病灶存在两个问题:(1)2020年5月的MR中是否存在颞叶病灶; (2)2020年10月MR报告提示双侧颅内多发点状影是否为脑转移。请放射科医师阅片后, 发现两次MR的左颞叶显示是一致的, 该部位因靠近脑回, 因此有时观察不清, 两次MR要么都是无病灶, 要么都是有病灶; 而2021年1月MR提示颅内多发点状影, 根据MR片可判断该次MR为新一代的MR机拍摄而出, 图片更为高清, 因此既往MR未见的点状影, 本次MR显示双侧颅内点状影, 所以诊断颅内多发脑转移证据不足。
周清:患者2020年9月因左侧颞叶病灶恢复用药, 使用的是吉非替尼, 复查结果显示仍然有效。使用吉非替尼过程中, 双肺病灶变化不明显。而颅内病灶缩小明显, 提示颅内病灶对吉非替尼敏感, 而双肺结节则反应相对较差。可继续使用一代TKI, 同时使用ctDNA检测, 根据结果决定是否继续使用TKI。颅内病灶小, 经TKI治疗后缩小, 无症状, 暂时可单用TKI, 暂不用放疗。
潘燚:患者存在两次停药, 第一次无治疗间期超过2年, 第二次较短, 仅约4个月。而肺部病灶总体变化缓慢, 左下肺结节期间明显增大, 经局部手段切除。而颅内病灶经TKI治疗后明显缩小, 建议后续继续定期复查, 如颅内病灶再次消失可考虑停药。尽可能延长患者的无用药时间。
吴一龙:本病例治疗较为成功, 延长患者的无用药时间, 共2年余。中间存在多个治疗决策可能与常规的处理方式存在差异。随着靶向治疗的广泛使用, 此类病例以后可能会越来越多, 需总结该患者病史, 看看能否发现该类患者肿瘤生长规律及诊治的方式, 再决定该患者下一步的处理方式。
周清:患者在随访过程中病灶逐渐增大, 处理上予观察, 对于缓慢增长的肺腺癌患者, 这种处理方式比较好理解, 有循证医学证据。患者于2017年1月第一次发现颅内病灶, 此时建议继续观察, 与普通处理方式存在明显差异。若出现转移病灶为局限于胸腔内, 那么采取观察策略可能比较合适, 但是一旦出现胸腔外的转移, 则往往积极用药。因颅内可能出现快速进展, 一般情况不建议继续观察。该患者在无用药情况下继续观察了11个月, 而病灶仅由7 mm增大至8 mm, 颅内未出现其他病灶, 未出现脑膜转移, 未出现脑转移相关症状。因此该患者第一次发现左颞叶转移, 在观察过程中无明显变化, 观察策略显然符合肿瘤的生长特性。
涂海燕:患者2017年12月CT提示右下肺新发病灶, 为何不穿刺, 直接TKI治疗?
董嵩:患者左下肺结节切除后行NGS提示存在T790M突变, 提示右肺结节也可能存在T790M突变。此时术后为何选择使用一代TKI?
吴一龙:为患者制定治疗计划前, 需判断治疗的疗效, 如效果差, 则怀疑该治疗方式是否使患者获益。回顾患者的全部资料, 总结并建议如下:
(1)该患者术前即已存在双肺结节, 术后复查时无明显变化, 病灶性质未确定, 因此停用TKI, 可在观察过程中判断结节的性质及生长速度, 为下一步的治疗做准备。
(2)第一次发现脑部病灶, 我们在前期观察过程中已发现肺部结节增长缓慢, 生物学行为较为惰性, 因此判断颅内结节也可能为惰性生长, 该病灶单发, 长径较小, 无症状, 因此可以不着急治疗, 继续观察。根据患者肿瘤生长速度决定是否治疗。
(3)患者后续新发右下肺病灶, 其余病灶也逐渐增大, 右下肺病灶增长快速, 肿瘤的生物学行为已发生改变。因此需积极干预。治疗后肺内病灶及脑转移病灶均缩小, 提示尽管右下肺结节增长快, 但全身肿瘤病灶异质性低、生物学行为相似。
(4)该患者颅内病灶对一代TKI敏感, 在两次停药后恢复用药中均得到证明, 而肺部病灶在前期治疗中缩小明显, 后续治疗过程中缓慢增大, 因此考虑使用一代TKI可以有效控制颅内病灶。
该患者后续仍有较多治疗手段, 包括第三代TKI、化疗、抗血管生成等药物, 可能为后续延长患者生存提供强有力支持。但需明确, 治疗前一般首先需明确患者属于哪种类型, 判断肿瘤生长速度及生物学行为。
该患者目前尚不明确的是, 患者在2020年9月行血液NGS时, 发现出现新的基因改变:ARID1B, 丰度0.4%。而不是EGFR突变, 肿瘤组织检测时未出现该基因, 而血液中检出, 需后续继续探索。下一步处理可继续口服吉非替尼, 同时每三月复查ctDNA、胸部CT及头颅MR。
旁述:靶向治疗的患者不可避免出现耐药, 可能为部分肿瘤细胞耐药, 最终产生不同于原驱动基因的基因改变, 使得肿瘤可以继续生长, 这类细胞可能来源于亚克隆事件的发生[9]。
张绪超(肿瘤学研究员):这个基因可能跟克隆造血有关, 部分人随年纪增长可出现, 不一定是与该患者的肺癌相关。但近年有文献显示ARID1B可能与肿瘤生物学行为及基因不稳定有关。
旁述:SWI/SNF复合物(SMARCA4、SMARCA2、ARID1A和ARID1B)低表达的肺癌患者, 其无疾病生存及总生存均较低, 同时程序性死亡配体1水平及肿瘤突变负荷均较高[10]。
后记:
MDT讨论后, 患者于2021-02-04开始服用易瑞沙, 2021-03-22 MRD检测:阴性。2021-03-23停用易瑞沙。
2021-05-05头颅MR颅内病灶较前增多增大。较大者位于左侧颞叶(1.7 cm)。2021-05-05胸部CT:右下肺结节较前增大(2.0 cm)。2021-05-07开始易瑞沙治疗。1个月后颅内病灶缩小。肺部病灶稳定。予继续服用易瑞沙。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|