| 张俊,医学博士,博士研究生导师,上海交通大学医学院附属瑞金医院肿瘤科常务副主任、上海消化外科研究所副研究员。 卫生部肿瘤规范化诊疗专家委员会肿瘤化疗组委员、卫生部《胃癌诊疗规范》专家组成员。中国抗癌协会胃癌专业委员会青年学组副组长、肠癌专业委员会委员、肿瘤药物临床研究专业委员会委员、中华医学会外科学分会青年委员,中国临床肿瘤学会(CSCO)执行委员会委员、青年委员会副主任委员、血管靶向治疗专家委员会委员、胃肠道神经内分泌肿瘤专业委员会委员、生物标志物专业委员会委员、胰腺癌专业委员会委员,中华医学会肿瘤学分会胃肠肿瘤学组委员,中国研究型医院学会精准医疗与肿瘤MDT专业委员会副主任委员、上海市医师协会肿瘤学分会副会长、上海市医学会肿瘤靶分子专业委员会副主任委员、上海市医学会肿瘤学分会胃肠学组副组长,上海市疾控中心胃癌专业组委员兼秘书。 主持国家自然科学基金资助项目2项,主要研究方向为胃肠肿瘤的靶向治疗与化学治疗。2011年获上海市医疗系统“银蛇奖”,2015年入选上海市医学领军人才。 |
Janjigian YY, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma(CheckMate 649): A randomised, open-label, phase 3 trial[J]. Lancet, 2021, 398(10294): 27-40.
1a。
胃癌, 包括胃食管交界处癌, 是全球癌症相关死亡的第四大原因。腺癌是最常见(> 90%)的组织学类型, 约占全球癌症相关死亡人数的65%。氟尿嘧啶加铂类化疗是不可切除的晚期或转移性人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)阴性胃和胃食管交界处腺癌最常用的一线化疗方案, 中位总生存期(overall survival, OS)少于1年。
ATTRACTION-4、KEYNOTE-062、KEYNOTE-590等以程序性死亡受体1(programmed cell death 1, PD-1)/程序性死亡配体1(programmed cell death ligand 1, PD-L1)抑制剂为基础的晚期胃癌Ⅲ 期临床研究均未能达到主要终点, 使得免疫治疗在胃癌一线治疗的价值尚不明确。
我们旨在评估基于PD-1/PD-L1抑制剂的一线方案治疗胃、胃食管交界处和食管腺癌中的疗效。本篇文献报告了纳武利尤单抗联合化疗与单独化疗的初步结果。
• 研究条件:在29个国家的175家医院和癌症中心进行的全球多中心临床研究, 横跨亚洲、澳大利亚、欧洲、北美和南美(NCT02872116)。
• 研究时间:2017年3月27日至2019年4月24日。
• 研究方法:多中心、随机、开放性、前瞻性、随机对照Ⅲ 期试验。
• 研究对象:主要入组标准包括年龄≥ 18岁, 初治不可切除晚期或转移性胃、胃食管交界处或食管腺癌, 无论PD-L1表达如何, 根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)V1.1评估至少有一个可测量病变, ECOG评分0或1, 可提供肿瘤样本以评估PD-L1表达, 既往接受过辅助或新辅助化疗、放疗或放化疗(随机化前至少6个月给药)的患者。
主要排除标准包括已知的HER2阳性状态, 未经治疗的中枢神经系统转移瘤, 周围神经病变(高于1级), 活动性、已知或疑似自身免疫性疾病等。
• 干预措施:符合入组患者1∶ 1随机分为纳武利尤单抗联合化疗组及单独化疗组。纳武利尤单抗360 mg每3周或240 mg每2周给药, 联合化疗XELOX(卡培他滨1 000 mg/m2 BID d1~d14, 奥沙利铂130 mg/m2d1, 每3周给药)或FOLFOX(亚叶酸钙400 mg/m2d1, 氟尿嘧啶400 mg/m2d1, 1 200 mg/m2d1~d2, 奥沙利铂85 mg/m2d1, 每2周给药)方案, 除卡培他滨口服外, 其余均静脉给药。单独化疗组给药剂量同联合组。研究干预措施流程见图1。
• 评价指标:主要终点是通过独立中心评估的在PD-L1 CPS≥ 5的人群中, 纳武利尤单抗联合化疗与单独化疗组之间的总生存期(overall survival, OS)或无进展生存期(progression-free survival, PFS); 在接受至少一次指定治疗的所有患者中进行安全性评估。
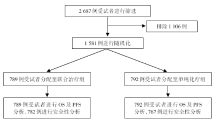
从2017年3月27日到2019年4月24日, 对2 687例患者进行评估筛选, 共1 581例患者随机分配至联合治疗组(n=789, 50%)或单独化疗组(n=792, 50%)。联合治疗组的OS中位随访时间为13.1个月(IQR 6.7~19.1), 单独化疗组为11.1个月(5.8~16.1)。在PD-L1联合阳性评分(combined positive score, CPS)≥ 5(最少随访12.1个月)的患者中, 联合治疗与单纯化疗相比, 显著改善OS[风险比(hazard ratio, HR)0.71, 98.4%可信区间(confidence interval, CI)0.59~0.86; P< 0.000 1]和PFS(HR 0.68, 98%CI 0.56~0.81; P< 0.000 1)。在PD-L1 CPS≥ 1或所有随机分配全人群中, 联合治疗组的OS以及PFS也有明显改善。在所有接受治疗的患者中, 联合治疗组782例患者中的462例(59%)和单独化疗组767例患者中的341例(44%)发生了3~4级治疗相关不良事件。两组最常见的任何级别治疗相关的不良事件(≥ 25%)是恶心、腹泻和周围神经病变。联合治疗组出现16例(2%)死亡和单独化疗组4例(1%)死亡被认为与治疗相关。没有出现之前未报道的治疗相关不良反应。
纳武利尤单抗是第一个在晚期胃、胃食管交界处, 和食管腺癌显示出优越OS以及PFS的PD-1抑制剂, 纳武利尤单抗联合化疗具有可接受的安全性; 纳武利尤单抗联合化疗已被美国食品药品监督管理局(Food and Drug Administration, FDA)批准作为治疗晚期或转移性胃癌、胃食管结合部癌和食管腺癌的一线疗法, 且不受PD-L1表达水平限制。
胃癌是全球高发的恶性肿瘤, 每年有超过一百万的新发病例。在我国, 由于诊断通常处于进展期, 尽管推行了以多学科诊疗团队的临床实践模式, 但总体疗效仍未尽满意, 胃癌死亡率仍高居癌症相关死亡的第三大最常见原因, 2018年全球有约784 000病例死亡[1]。因此, 改善胃癌的治疗效果和生存预后有着重要的临床意义。
大量临床研究证据已证实化疗可延长不可切除局部进展期或转移性胃癌患者的生存[2], 而一线治疗仍是决定患者生存获益的关键因素。近十年来, 除针对HER2的分子靶向药物外, 晚期胃癌一线的药物治疗并未见明显进展。迄今, HER2阴性晚期胃癌标准一线治疗仍然为含铂和氟尿嘧啶类药物两药联合, 中位生存期不到1年。因此, 探索新的联合治疗策略, 在改善胃癌总体生存中具有重大意义。
免疫治疗在非小细胞肺癌、恶性黑色素瘤等瘤种中的成功, 使我们将改善胃癌生存的希望投入在免疫治疗联合化疗上。CheckMate 649研究公布之前, 多个以PD-1/PD-L1抑制剂为基础的晚期胃癌Ⅲ 期临床研究(ATTRACTION-4、KEYNOTE-062、KEYNOTE-590)均未能达到主要终点, 免疫疗法用于胃癌一线治疗的价值尚不明确。ATTRACTION-4[3]临床研究纳入未经治疗的胃癌或胃食管结合处患者, 纳武利尤单抗联合化疗显著改善了PFS, 但在全随机化人群中未见OS的延长。同样, 在全球KEYNOTE-062[4]研究中, 在PD-L1 CPS≥ 1的患者, 帕博丽珠单抗联合化疗改善了PFS, 但是仍未获得OS上的差异。Ⅲ 期KETNOTE-590[5]研究食管癌或胃食管结合处癌(主要是鳞状细胞癌组织学), 一线帕博丽珠单抗联合化疗改善了晚期不可切除或转移性胃-食管连接(Siewert 1型)处肿瘤中的OS和PFS。CheckMate 649研究是首个且目前唯一在胃腺癌中取得阳性结果的一线治疗Ⅲ 期研究。较之于上述研究, CheckMate 649为何能在OS中取得获益?研究设计存在哪些优点及不足?这项研究的结果会对我国晚期胃癌的临床治疗发展带来哪些影响?本文将对这几点进行阐述。
第一, CheckMate 649是晚期胃癌领域迄今纳入患者样本量最大的研究, 也是十余年来在HER2阴性的胃癌一线治疗中, 首个超越化疗取得总生存期获益的全球多中心研究。鉴于这一研究成果的公布, 2021年美国综合肿瘤网络(National Comprehensive Cancer Network, NCCN)指南及中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)指南均将纳武利尤单抗+化疗(FOLFOX/XELOX)方案正式列为晚期转移性胃癌一线治疗I级推荐(1A级证据)。
在CheckMate 649, KEYNOTE-062和ATTRA-CTION-4中观察到的疗效的差异可能是由于研究设计的差异(例如, 生物标志物选择, 患者人口, 地理和治疗方案)和随后接受的治疗导致。首先, 研究纳入的患者人群存在差异。CheckMate 649研究中CPS≥ 5高达60%, CPS≥ 1高达82%, 远超过其他胃癌研究中PD-L1 CPS≥ 1的比例(57%~68%)。其次, CheckMate 649研究不论是在药物选择本身及联合化疗方案的设计上, 均经过精细考量, 不仅提供了XELOX和FOLFOX两种不同的化疗方案供研究者根据个体情况选择, 还分别调整了联合的纳武利尤单抗的用药剂量和周期。另外, 三项研究患者后线治疗方案存在差异, 比如ATTARCTION-4试验组和对照组分别有64%和68%患者接受后线治疗, 而CheckMate 649仅38%和41%的患者接受后线治疗。同时, CheckMate 649研究纳入了208例中国受试者, 中国大陆患者在亚洲患者中占比达60%, 这可能与最终结果也有着密切相关性。
第二, CheckMate 649研究的设计参考了之前免疫治疗研究的经验, 将PD-L1 CPS作为人群划分的标准, 并将CPS≥ 5的患者作为主要研究人群; 但从最终的结果来看, 不同CPS水平的患者, 从联合治疗中获益的趋势却具有高度的一致性, 这一结果在中国亚组人群中亦然。尽管PD-L1 CPS表达水平可以从一定程度反映免疫治疗的疗效, 但是PD-L1表达不太可能是整体人群和经筛选人群中的免疫治疗疗效预测的唯一指标, 因为在CPS< 5的人群中, 仍然能够看到有获益的患者。未来, 除了PD-L1的表达以外, 可能我们还要更多地关注病因学因素, 比如幽门螺杆菌的感染、人种的差异和肿瘤特征的差异等。因该研究中中国亚组结果的获益趋势与纳入亚洲人群的ATTRCTION-4研究结果又不尽相同, 也就是说胃癌即便是同在亚洲, 各个国家地区之间也是存在差异的。
第三, CheckMate 649研究的设计有它的局限性。CheckMate 649排除了已知HER2阳性状态的患者。然而, 由于HER2检测可能并未在所有研究中心进行常规检测, 因此允许招募HER2状态未知的患者。重要的是, 这些患者的比例(约40%)在治疗组之间是平衡的。基于已知的胃癌和胃食管结合部癌中HER2过表达肿瘤的比例(约20%), 预计大多数患者的HER2状态为HER2阴性。另外, CheckMate 649研究的开放标签研究设计, 这可能会影响患者生活治疗调查问卷和不良事件因果关系的评估。
尽管CheckMate 649研究具有局限性, 但是该研究结果明确了免疫治疗在晚期胃癌中的疗效, 也明确了以免疫治疗为基础的联合治疗在胃癌中的价值, 为未来的研究奠定了基础。此外, 随着免疫疗法在一线治疗的成功, 晚期胃癌的后线治疗将如何选择?一线免疫治疗的背景下, 免疫治疗会对肿瘤生物学特性产生哪些影响, 胃癌后线治疗方案需要做出哪些调整, 临床研究如何设计, 都有待于进一步探索。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|