作者简介:
唐翔宇(1986-),男,广东梅州人,医学硕士,主治医师,主要研究方向为胃肠肝胆胰腺方向。
目的 探讨LncRNA BC200在大肠癌组织中的表达及临床意义。方法 将2018年6月至2020年6月深圳市蛇口人民医院收治的90例大肠癌患者作为研究对象,收集患者术中取出的新鲜癌组织及癌旁组织(经病理证实为正常大肠组织),分别经液氮冷冻和石蜡包埋处理,采用逆转录实时荧光定量聚合酶链式扩增(reverse transcription-polymerase chain reaction,RT-PCR)法检测LncRNA BC200及血管内皮生长因子(vascular endothelial growth factor,VEGF)表达,采用免疫组织化学法(immunohistochemistry,IHC)检测VEGF表达,比较癌组织及癌旁组织中LncRNA BC200表达水平及VEGF阳性表达评分的差异性,并分析大肠癌组织中LncRNA BC200表达与VEGF阳性表达评分的相关性。结果 RT-PCR检测结果显示,大肠癌组织和癌旁组织中LncRNA BC200的相对表达量分别为(3.64±0.73)和(1.17±0.55),大肠癌组织中LncRNA BC200表达水平明显高于癌旁组织,差异具有统计学意义( t=7.334, P<0.001)。大肠癌组织和癌旁组织中VEGF的相对表达量分别为(5.25±0.26)和(2.16±0.11),大肠癌组织中VEGF表达水平明显高于癌旁组织,差异具有统计学意义( t=8.224, P<0.001)。IHC结果显示,与癌旁组织比较,大肠癌组织中VEGF阳性表达评分较高( t=5.372, P<0.001)。不同性别、不同肿瘤位置的大肠癌患者癌组织中LncRNA BC200相对表达量之间无显著性差异( P>0.05),但LncRNA BC200在不同临床分期、不同分化程度及是否发生淋巴结转移的大肠癌组织中的表达量差异显著( P<0.05)。大肠癌组织中LncRNA BC200的相对表达量与VEGF阳性表达评分呈正相关( r=0.703, P<0.05)。结论 LncRNA BC200在大肠癌组织中表达明显升高,其表达与大肠癌患者的临床分期、分化程度及淋巴结转移有关,并与癌组织中血管生成相关因子VEGF的表达呈正相关。
Objective To investigate the expression and clinical significance of LncRNA BC200 in colorectal cancer.Methods From June 2018 to June 2020, 90 patients with colorectal cancer in Shenzhen Shekou People's Hospital were selected as the research objects. Fresh cancer tissues and adjacent tissues (normal colorectal tissues confirmed by pathology) were collected and treated with liquid nitrogen freezing and paraffin embedding respectively. The expression of LncRNA BC200 was detected by reverse transcription-polymerase chain reaction (RT-PCR) and vascular endothelial growth factor (VEGF) was detected by immunohistochemistry (IHC). The difference of LncRNA BC200 expression level and VEGF positive expression score in cancer tissues and adjacent tissues was compared. The correlation between LncRNA BC200 expression and VEGF positive expression score was analyzed.Results The RT-PCR results showed that the relative expression levels of LncRNA BC200 in colorectal cancer tissue and adjacent tissues were (3.64±0.73) and (1.17±0.55). The expression of LncRNA BC200 in colorectal cancer tissues was significantly higher than that in adjacent tissues ( t=7.334, P<0.001). The relative expression levels of VEGF in colorectal cancer tissues and adjacent tissues were (5.25±0.26) and (2.16±0.11). The expression levels of VEGF in colorectal cancer tissues were significantly higher than those in adjacent tissues, and the difference was statistically significant ( t=8.224, P<0.001). The results of IHC staining showed that the positive expression score of VEGF in colorectal cancer tissue was higher than that in adjacent tissues ( t=5.372, P<0.001). There was no significant difference in the relative expression of LncRNA BC200 in colorectal cancer tissues of different gender and tumor location ( P>0.05), but the expression of LncRNA BC200 was significantly different in colorectal cancer tissues with different clinical stages, different degrees of differentiation and whether lymph node metastasis occurs ( P<0.05). There was a positive correlation between the relative expression of LncRNA BC200 and the score of VEGF positive expression ( r=0.703, P<0.05).Conclusions The expression of LncRNA BC200 was significantly increased in colorectal cancer. The expression of LncRNA BC200 was related to the clinical stage, differentiation degree and lymph node metastasis of colorectal cancer patients, and was positively correlated with the expression of angiogenesis related factor VEGF.
大肠癌为发病率和死亡率呈上升趋势十分明显的一种常见消化系统恶性肿瘤[1]。目前, 普遍认为大肠癌的近年来发病率高是环境因素及遗传因素综合作用的结果[2], 但有关大肠癌的详细发病机制尚不完全清楚。由于大肠癌早期无症状或症状隐匿、缺乏早期诊断标志物、国内肠镜筛查率低等原因, 导致部分大肠癌患者在诊断时大多是晚期[3], 因此, 探究大肠癌发生发展过程中的分子生物学特点意义重大。近年来, 长链非编码RNA(long noncoding RNA, LncRNA)获得了学者们的广泛关注, 这主要是由于LncRNA可在基因组转录、表观遗传学等层面调控基因表达, 从而影响细胞的增殖、凋亡等过程[4, 5], 现已发现LncRNA的异常调控可能参与多种肿瘤的发生及发展过程[6, 7]。LncRNA BC200是最近新发现的一种LncRNA, 其在乳腺癌、卵巢癌和食管癌中表达升高[8]。然而, 目前尚不清楚LncRNA BC200在大肠癌中的作用, 因此, 本研究旨在探讨LncRNA BC200在大肠癌组织中的表达及临床意义。
将2018年6月至2020年6月于深圳市蛇口人民医院收治的90例经病理学诊断的大肠癌患者纳入研究, 入组患者均于深圳市蛇口人民医院行手术治疗, 术前均未接受任何放化疗治疗。90例患者中, 男性57例, 女性33例, 年龄37~76岁, 平均年龄(61.38± 11.52)岁, 肿瘤位置:结肠癌62例, 直肠癌28例, 临床分期:Ⅰ ~Ⅱ 期36例、Ⅲ ~Ⅳ 期54例, 分化程度:高分化24例、中分化41例、低分化25例, 有淋巴结转移者37例。将患者术中取出的新鲜癌组织及癌旁组织(经病理证实为正常大肠组织)平均分为两份, 一份立即放入液氮中冷冻, 然后于-80℃保存待用, 另一份立即放入福尔马林中保存, 经石蜡包埋处理后, 制成组织切片待用。
逆转录实时荧光定量聚合酶链式扩增(reverse transcription-polymerase chain reaction, RT-PCR)法检测LncRNA BC200及血管内皮生长因子(vascular endothelial growth factor, VEGF)表达的方法如下:超声破碎收集的大肠癌组织及癌旁组织标本, 按照RNA提取试剂盒(美国ABI公司)说明书提取组织中的总RNA, 使用NanoDrop 2000C超微量分光光度计(美国Thermo公司)检测RNA纯度和浓度, 然后按照逆转录试剂盒(日本Takara公司)操作说明书, 将LncRNA BC200和VEGF分别逆转录为cDNA, 再参照SYBR GreenⅡ Supermix RT-PCR试剂盒(日本Takara公司)操作说明书使用7300型Real Time PCR扩增仪(美国ABI公司)扩增LncRNA BC200和VEGF, 引物序列见表1。反应条件:预变性95℃ 2 min, 95℃ 15 s, 60℃ 25 s, 72℃ 25 s, 35个扩增循环。每组设置三个复孔, 采用2-Δ Δ CT方法计算LncRNA BC200及VEGF相对表达水平。
| 表1 引物序列 Tab.1 Primer sequence |
将收集的大肠癌组织及癌旁组织石蜡切片经常规脱蜡、水化, 然后加3% H2O2溶液灭活, 再进行抗原修复。将修复后的组织切片参照SP免疫组织化学(immunohistochemistry, IHC)试剂盒(北京中杉金桥生物技术有限公司)说明书进行操作, 加入按照1∶ 200稀释的VEGF抗体(美国cell signaling公司), 4℃过夜。次日, 取出后加入生物素标记的二抗, 37℃孵育30 min, 经二氨基联苯胺显色及自来水充分冲洗后, 使用苏木素复染, 脱水、封片。结果判定标准:以细胞质及细胞核中出现棕黄色至棕褐色染色为阳性染色, 其中阳性细胞数:< 5%(0分)、5%~25%(1分)、26%~50%(2分)、> 50%(3分); 阳性细胞染色强度分级:无色(0分)、淡黄色(1分)、棕黄色(2分)、棕褐色(3分), 将2项得分相乘作为标本VEGF阳性表达评分, 每个标本取10个视野求平均值。
采用SPSS 20.00处理数据, 计量资料以x ± s表示, 用t检验或单因素分析, 计数资料用χ 2检验, 大肠癌组织中LncRNA BC200表达与VEGF阳性表达评分的相关性用Pearson分析, 以P< 0.05为差异有统计学意义。
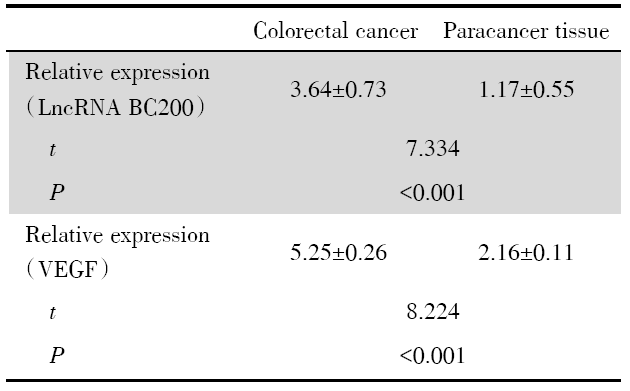
大肠癌组织和癌旁组织中LncRNA BC200的相对表达量分别为(3.64± 0.73)和(1.17± 0.55), 大肠癌组织中LncRNA BC200表达水平明显高于癌旁组织, 差异具有统计学意义(t=7.334, P< 0.001); 大肠癌组织和癌旁组织中VEGF的相对表达量分别为(5.25± 0.26)和(2.16± 0.11), 大肠癌组织中VEGF表达水平明显高于癌旁组织, 差异具有统计学意义(t=8.224, P< 0.001), 如表2。
| 表2 组织中LncRNA BC200及VEGF表达水平 Tab.2 Expression levels of LncRNA BC200 and VEGF in tissues (x ± s) |
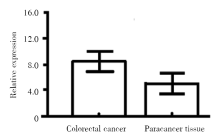
IHC染色结果显示, 大肠癌组织和癌旁组织中VEGF阳性表达评分分别为(8.24± 1.23)分和(4.92± 1.02)分, 二者比较差异显著(t=5.372, P< 0.001), 如图1。
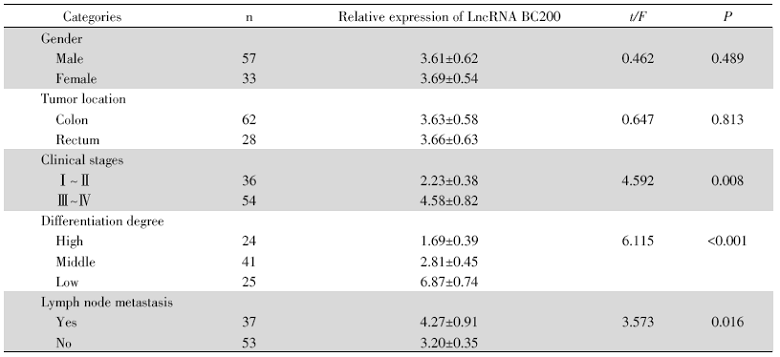
不同性别、不同肿瘤位置的大肠癌患者癌组织中LncRNA BC200相对表达量之间无显著性差异(P> 0.05), 但LncRNA BC200在不同临床分期、不同分化程度及是否发生淋巴结转移的大肠癌组织中的表达量差异显著(P< 0.05), 见表3。
| 表3 LncRNA BC200表达与大肠癌的关系 Tab.3 Relationship between expression of LncRNA BC200 and colorectal cancer (x ± s) |
大肠癌是消化系统常见的恶性肿瘤之一, 大肠癌的早期临床症状并不明显, 往往不容易引起注意, 而且我国老年人的肠镜筛查率较低, 这些原因共同导致我国老年大肠癌患者在确诊时多数已达到晚期阶段[9, 10]。由于目前尚不清楚大肠癌确切的发病机制, 且迄今为止, 可用于结肠癌早期诊断和评估预后的可靠生物标志物很少, 故研究大肠癌发生及发展过程中的分子生物学特点及探究可能的发病机制, 对于提高大肠癌患者的临床诊疗具有重要意义。
LncRNA为不编码蛋白质RNA, 其长度超过200个核苷酸[11]。研究显示, LncRNA可调控多个层面上的基因表达, 并与包括恶性肿瘤在内的多种疾病的发生有关[12]。在最近的研究中, LncRNA被认为是结肠癌早期诊断和评估预后的新的重要生物学标志物[13]。LncRNA BC200是最近发现的一种与多种恶性肿瘤的发病机制有关的LncRNA[14]。体外细胞实验显示, LncRNA BC200在乳腺癌细胞系和肺癌细胞系中的表达显著高于原代非肿瘤性培养的细胞[15]。另有研究显示, 敲除LncRNA BC200基因可导致恶性肿瘤细胞生长停滞并诱导细胞凋亡, 导致细胞的生存能力急剧下降[16]。据报道, 与对应的正常组织相比, LncRNA BC200在多种来源不同的恶性肿瘤组织中表达增高[17, 18]。在本研究中, 我们也通过RT-PCR检测发现, 大肠癌组织中LncRNA BC200表达水平明显高于癌旁组织, 差异具有统计学意义(P< 0.001), 这与以往在其他肿瘤组织中的研究结果相一致[19]。此外, 我们发现不同性别、不同肿瘤位置的大肠癌患者癌组织中LncRNA BC200的表达量比较无显著差异(P> 0.05), 但LncRNA BC200在不同临床分期、不同分化程度及是否发生淋巴结转移的大肠癌组织中的表达量差异显著(P< 0.05), 上述结果表明, LncRNA BC200在大肠癌组织中表达明显升高, 其表达与大肠癌患者的临床分期、分化程度及淋巴结转移有关。
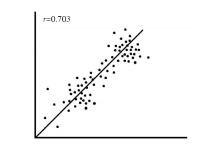
VEGF是一种具有强大的促进内皮细胞增殖和诱导血管新生作用的细胞因子, 恶性肿瘤的无限增殖及易转移特性均与血管新生有关[20, 21]。本研究发现, 与癌旁组织比较, 大肠癌组织中VEGF阳性表达评分明显较高(P< 0.001)。由于LncRNA BC200可与VEGF通路相互作用来调节肿瘤周围血管的生成[22], 故我们进一步分析了大肠癌组织中LncRNA BC200表达与VEGF阳性表达评分的相关性, 结果显示, 大肠癌组织中LncRNA BC200的相对表达量与VEGF阳性表达评分呈正相关(P< 0.05), 表明LncRNA BC200有可能是通过促进血管生成而参与大肠癌的发生及发展过程。
综上所述, LncRNA BC200在大肠癌组织中表达明显升高, 其表达与大肠癌患者的临床分期、分化程度及淋巴结转移有关, 并与癌组织中血管生成相关因子VEGF的表达呈正相关。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|