作者简介:
闻红江( 184-),男,河北石家庄人,主治医师,医学硕士,主要研究方向为肺部肿瘤的基础与临床研究。
目的 探究硫氧还蛋白相关蛋白14(thioredoxin-related protein 14 kDa,TRP14)在非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞增殖移动过程中的功能及其作用机制。方法 利用肿瘤基因图谱(The Cancer Genome Atlas,TCGA)数据研究并分析TRP14在NSCLC组织中的表达水平,定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)检测TRP14在正常肺上皮细胞和NSCLC细胞及组织中的表达;在H1299和H1975细胞系中用克隆形成实验检测TRP14基因敲减后对NSCLC细胞增殖的影响,探索TRP14在NSCLC细胞增殖中的作用,并用CCK8细胞增殖转移、细胞凋亡实验进一步验证;将TRP14干扰后,用western blot实验检测下游通路基因以分析TRP14基因可能的作用机制。结果 与癌旁组织相比,TRP14基因在肺癌组织表达显著升高,且TRP14敲减能抑制细胞增殖和转移、促进细胞凋亡;进一步发现TRP14可能通过调控细胞自噬发挥作用。结论 TRP14基因可能在NSCLC的细胞增殖移动中起到重要的作用,该作用可能通过影响细胞自噬机制进行,TRP14基因可能成为NSCLC的一个新的潜在的分子诊断指标及靶点。
Objective To explore the function and mechanism of thioredoxin-related protein 14 kDa (TRP14) in the cells proliferation and migration of non-small cell lung cancer (NSCLC).Methods Analysis the expression level of TRP14 in NSCLC within The Cancer Genome Atlas (TCGA) data. The expression of TRP14 in lung epithelial cells and NSCLC cells were detected by quantitative polymerase chain reaction (qPCR). Knockdown the TRP14 gene to detect the proliferation of NSCLC cells H1299 and H1975 by CCK8 assay and clone formation assay, and detect the migration and apoptosis by transwell and flow cytometry. After TRP14 was interfered, the downstream pathway genes were detected by western blot to analyze the possible mechanism of TRP14 gene.Results TRP14 expression was significantly increased in NSCLC tissues compared with adjacent tissues, and TRP14 knockdown inhibited cell proliferation and migration, and promoted cell apoptosis. Moreover, TRP14 may play a role by regulating autophagy.Conclusions TRP14 gene played an important role in the cells proliferation and migration of NSCLC by influencing the mechanism of autophagy. TRP14 gene was a new potential molecular diagnostic index and target for NSCLC.
非小细胞肺癌(non-small cell lung cancer, NSCLC)是最常见的肺癌类型, 全球每年有超过100万的NSCLC患者死亡[1]。通过大规模的基因组研究, 已经基本了解了NSCLC的基因组水平的特征[2, 3]; 并且已经找到了一些重要的治疗靶点, 如表皮生长因子受体(epidermal growth factor receptor, EGFR)和间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)。随着肿瘤免疫治疗方法的研究, 针对程序性死亡配体1(programmed death ligand 1, PD-L1)高表达、肿瘤突变负荷(tumor mutation burden, TMB)和基因表达评分较高的患者, 免疫检查点抑制剂药物的疗效也比较好[4, 5, 6]。与最初通过手术和放化疗治疗相比, 目前对于NSCLC的治疗效果有了很大的改善。但是, 发展中国家大部分患者确诊时已经是中晚期, 治疗效果普遍较差, 五年生存率小于60%[7, 8], 远低于发达国家水平; 并且NSCLC治疗中化疗耐药和靶向药耐药情况普遍发生。因此, 虽然目前已经对NSCLC的发病机制有了一定了解, 仍然需要进一步研究NSCLC发生发展的分子机制, 寻找新的早期诊断靶点和治疗靶点。
硫氧还蛋白相关蛋白14(thioredoxin-related protein 14 kDa)是一种2004年发现的二硫化物还原酶, 属于硫氧还蛋白家族, 也被称为硫氧还蛋白17(thioredoxin domain containing 17, TXNDC17)或类硫氧还蛋白5(thioredoxin-like 5, TXNL5)[9]。近年来多项研究发现, TRP14作为依赖于TrxR1的还原酶, 可以有效的降低S-硝基硫醇和L-胱氨酸水平。TRP14的生物学功能还不清楚, 已有研究证实TRP14在卵巢癌中通过自噬途径影响了细胞对紫杉醇的敏感性[10]。但其在NSCLC中的功能和作用机制尚不明确。本研究拟探讨TRP14在NSCLC中的表达及其作用功能。
BEAS-2B, A549, 95D, H1975和H1299细胞购自中科院上海细胞库; 细胞培养基(Roswell Park Memorial Institute-1640, RPMI-1640)和2.5%胰酶购自hyclone; 胎牛血清购自Gibco; Trizol购自英韦创津; 细胞凋亡试剂盒购自Sigma-aldrich; 反转录试剂盒和实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction, qPCR)试剂盒购自Takara; 蛋白质裂解液购自碧云天。Beclin 1, Atg5, TRP14和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体均购自Abcam。肺癌和正常组织均收集于河北医科大学第二医院。本研究临床样本采集实验通过了河北医科大学伦理委员会审批(伦理号:2020-R599)。所有患者均单独签署了知情同意书。
1.2.1 细胞培养
BEAS-2B, A549, 95D, H1975和H1299细胞培养于添加10%胎牛血清(fetal bovine serum, FBS)和1%青霉素/链霉素的RPMI-1640培养基中, 于含5%二氧化碳, 37℃细胞培养箱中进行培养。
1.2.2 TRP14基因细胞敲减
设计合成特异性TRP14基因的siRNA靶序列并进行验证, 与对照siRNA共同转染A549和NCI-H1299细胞, 通过qPCR与western blot实验检测敲减效率。TRP14基因敲减靶基因序列如下:5′ -GTGCCTACACTACTTAAGT-3′ ; 对照siRNA序列为:5′ -CACACCGTTTCGTGGCTTT-3′ 。
1.2.3 RNA提取与qPCR实验
用TRIZOL裂解细胞, 使用酚氯仿法提取1× 106细胞的总RNA, 溶于30 μ l无RNA核酸酶(RNase)的ddH2O中。用逆转录试剂盒将RNA反转录成cDNA后, 使用qPCR试剂盒进行qPCR实验。TRP14引物设计如下:上游:5′ -CCGGTGCTAGCTTTGTTTCACG-3′ ; 下游:5′ -AAGTCCCTGCCTCCGACGCCAACAT-3′ ; GAPDH引物设计如下:上游:5′ -GACAGTCAGCCGCATCTTCT-3′ ; 下游:5′ -TTAAAAGCAGCCCTGGTGAC-3′ 。
1.2.4 TCGA数据库
TRP14基因在肺癌中的表达水平通过肿瘤基因图谱(The Cancer Genome Atlas, TCGA)数据库进行查询并下载数据进行分析, 网址为http://cancergenome.nih.gov。
1.2.5 细胞增殖实验
将处于对数生长期的H1299和H1975细胞, 按照每孔1 000个细胞接种于96孔板, 每孔100 μ L培养液。第二天开始, 在相应的培养孔中加入10 μ L细胞增殖试剂盒(cell counting kit, CCK8)试剂, 于37℃下孵育3 h, 采用450 nm单波长进行吸光度测定, 吸光度值(optical density, OD)代表细胞增殖活力。连续检测4天, 计算细胞活率。
1.2.6 细胞克隆形成实验
将处于对数生长期的细胞均匀接种于6孔板, 每孔1 000个细胞。连续培养15天待细胞形成克隆之后弃去培养基, 磷酸盐缓冲液(phosphate buffer, PBS)洗涤两次之后使用结晶紫染色3 h, 晾干后拍照, 统计。
1.2.7 Western blot检测
6孔板培养的细胞弃去培养基, PBS洗涤2次。加入200 μ L放射免疫沉淀法(radio-immunoprecipitation assay, RIPA)后使用细胞刮将细胞刮下裂解提取蛋白。取50 μ g蛋白变性处理后进行十二烷基硫酸钠聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)电泳, 电泳完毕后将蛋白转移至聚偏二氟乙烯膜。5%脱脂奶粉封闭后, 分别进行一抗和二抗抗体孵育, 最后进行显色分析。
1.2.8 细胞凋亡检测
将待测细胞用不含乙二胺四乙酸的胰酶消化, 收集5× 105细胞。使用预冷的PBS洗涤细胞, 300 g, 4℃离心5 min。洗涤两次。进一步使用100 μ L 1× Binding Buffer重悬细胞, 加入5 μ L Annexin V-FITC和10 μ L PI染色液轻轻混匀, 避光、室温下孵育15 min。最后加入400 μ L 1× Binding Buffer, 进行流式检测。
1.2.9 Transwell
收集处于对数期的细胞, 使用无血清培养基重悬细胞。将细胞接种于transwell小室内室, 每个小室接种40 000细胞, 培养基体积为750 μ L。外室中添加500 μ L含20%胎牛血清的培养基。培养48 h后, 使用结晶紫对细胞进行染色。
1.2.10 数据统计分析
所有统计数据均为平均值± 标准差。应用Student's t检验或单因素方差分析评价两组或多组之间数据差异的显著性。P< 0.05即为显著性差异。
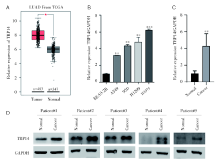
我们首先检测TRP14在NSCLC中的表达水平。通过对TCGA数据库中NSCLC数据下载数据并进行分析, 发现TRP14基因mRNA在NSCLC组织中呈高表达, 在NSCLC肿瘤组织中的表达水平显著高于其对照癌旁或正常组织中的表达水平(图1A)。并且, 通过qPCR检测发现和正常肺上皮粘膜细胞BEAS-2B相比, TRP14在NSCLC细胞中显著高表达(图1B)。进一步收集10对NSCLC及其对照组织, 通过qPCR检测发现TRP14在NSCLC组织中高表达(图1C); 然后, 通过western blot检测TRP14蛋白水平的表达, 结果显示TRP14在NSCLC组织中表达升高(图1D)。
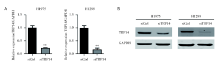
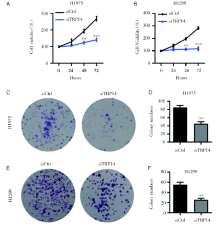
为研究TRP14在NSCLC恶性进展中的功能, 我们应用siRNA敲低TRP14基因表达的方法进行, 成功在NSCLC细胞系H1975和H1299细胞中将TRP14基因沉默(图2A和2B), 以观察TRP14基因表达降低后NSCLC细胞系的生长状况。通过CCK8增殖实验检测发现, TRP14基因沉默可以显著地抑制细胞的增殖能力(图3A和3B)。克隆形成结果显示, 干扰TRP14可以显著地抑制NSCLC细胞的克隆形成能力(图3C~3F)。以上结果说明TRP14对NSCLC细胞增殖能力是必不可少的。
为了探讨TRP14是否可以通过影响肺癌细胞凋亡影响细胞的存活, 我们在肺癌细胞中干扰TRP14对细胞凋亡的影响。结果发现, 干扰TRP14可以显著激活H1975和H1299细胞的凋亡(图4)。提示TRP14可以调节肺癌细胞的凋亡。
我们进一步探讨TRP14对NSCLC细胞转移能力的影响。Transwell结果显示干扰TRP14可以显著地抑制H1975和H1299细胞的转移能力(图5), 提示TRP14参与NSCLC细胞的转移。
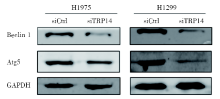
将TRP14干扰后, 我们通过western blot实验检测TRP14的下游通路基因表达水平和蛋白磷酸化水平, 发现与对照组相比, TRP14基因沉默组的自噬相关分子Beclin 1和Atg5的蛋白水平显著降低; 说明TRP14基因表达沉默后可以抑制细胞自噬, 抑制NSCLC细胞增殖(图6)。
TRP14在低等生物细菌到高等生物哺乳动物中具有高度的保守性, 是普遍存在的胞浆氧化还原活性蛋白[11, 12]。TRP14在进化中的高保守性预示其对于细胞或机体的重要性, 需要进一步了解它在生命活动中的作用。TRP14没有经典的Trx1底物的酶催化活性, 但能通过TrxR1发挥特有的氧化还原信号调节作用。既往研究证实TRP14在过硫化物还原、PTP1B活化、SNO还原等氧化还原反应中发挥重要作用[9]。在对信号通路调控的研究中发现, TRP14可以通过对底物LC8二硫化物还原抑制NF-κ B信号通路活性[13], TRP14与STAT3可能具有互相调节的能力[14], 并且TRP14可能通过Beclin 1对细胞自噬具有调控作用[15, 16]。虽然已有对TRP14初步了解, 但仍需进一步了解它的生物学功能和分子机制。
在肿瘤中TRP14的报道很少, 卵巢癌的研究发现TRP14通过激活细胞自噬促进降低对顺铂敏感性[15]。我们的研究发现NSCLC中TRP14表达较癌旁组织升高, 但TRP14在NSCLC组织和细胞中的基因突变等情况尚不清楚。利用siRNA沉默TRP14的表达后发现, 肺癌A549和NCI-H1299细胞的增殖能力受到显著抑制。以上结果说明TRP14可以促进肺癌的发生发展。进一步对其下游作用机制研究中发现:TRP14干扰后自噬相关基因Beclin 1和Atg5蛋白水平显著降低。类似的研究也发现干扰TRP14可以显著地抑制自噬相关蛋白Atg5, Beclin 1, 以及LC3-Ⅰ /Ⅱ 的表达水平, 而过表达TRP14可以增加Atg5和Beclin 1的表达, 提示TRP14可以激活自噬的发生[16]; 并且TRP14也可以参与紫杉醇的敏感性[16]。以上结果提示TRP14可能通过调控自噬参与肺癌发生发展。自噬与肿瘤发生发展密切相关, 已有研究证实自噬在肿瘤进展过程中具有双向作用[17, 18]。正常细胞中, 自噬发挥肿瘤抑制作用, 通过降解受损细胞器和聚集异常蛋白, 保护正常细胞免受氧化应激和诱导癌变的DNA损伤[19]。在癌细胞中, 自噬是促进其存活、保证细胞快速增殖的重要机制[20]。抑制肿瘤细胞自噬对于肿瘤治疗可能具有重要的意义。
综上所述, TRP14基因在NSCLC的细胞增殖移动中有着重要的功能, 并且可能通过影响自噬从而影响肺癌的发生发展, 但进一步的研究有待进行, 如在NSCLC组织中检测TRP14基因与肺癌临床指标和患者预后的关联度、TRP14与自噬相关基因的表达相关性、TRP14基因如何调控自噬等, TRP14基因可能成为NSCLC肿瘤治疗的一个新的分子诊断指标及靶点。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|