作者简介:
王涵敏(1992-),女,广东汕头人,医学硕士,主要研究方向为肺癌靶向治疗。
目的 MET14外显子跳跃突变是肺癌的少见驱动基因,靶向治疗在临床研究中已观察到良好的抗肿瘤活性,然而目前多数报道为临床研究数据,真实世界中患者分析较少。本研究旨在探索真实世界中此类患者的临床特征和疗效。方法 回顾性收集不符合临床试验入组标准或不愿意参加临床试验的 MET 14外显子跳跃突变局部晚期和转移性非小细胞肺癌(non-small cell lung cancer,NSCLC)患者,总结临床病理和分子特征,同时进行客观疗效与生存分析。结果 本中心自2017年2月至2021年2月共15例患者符合纳入标准,常见的伴随基因为 TP53(53.8%)、 MYC(23.1%)、 ATM(23.1%),并多以共突变的形式存在。大部分患者(70.0%,7/10)程序性死亡配体1(programmed death ligand 1,PD-L1)呈高表达(≥50%)水平。13例患者接受伯瑞替尼或克唑替尼治疗,12例可进行疗效评价的患者中,中位无进展生存期(median progression free survival,mPFS)为6.1个月,中位总生存期(median overall survival,mOS)为17.3个月,客观缓解率(objective response rate,ORR)为33.3%。体力活动状态(performance status,PS)评分=1分的患者疗效明显优于PS评分>1分的患者(mPFS:7.3个月vs. 0.4个月, P=0.002;mOS:21.2个月vs. 9.3个月, P=0.000)。结论 本研究中 MET14外显子跳跃突变NSCLC靶向治疗的客观疗效与生存期差于已发表的临床数据,考虑可能与靶向治疗用药时PS评分较差或原发耐药相关。
Objective MET exon 14 skipping was a rare driver gene in lung cancer. Efficacy of targeted therapy had been observed in clinical trials. However, few reports were about analyses of patients in the real world. This study was designed to explore the clinical characteristics and outcomes of such patients in the real world.Methods MET exon 14 skipped locally advanced or metastatic non-small cell lung cancer (NSCLC) patients who did not meet the criteria or reject to participate in clinical trials were retrospectively collected, clinicopathologic and molecular characteristics were summarized, objective response and survival analysis were performed.Results Fifteen patients were included in this study. The most common concurrent altered genes were TP53 (53.8%), MYC (23.1%) and ATM (23.1%). High programmed death ligand 1 (PD-L1) expression (≥ 50%) was seen in most patients (70.0%, 7/10). Thirteen patients received bozitinib or crizotinib treatment. Of the 12 evaluable patients, the median progression free survival (mPFS) was 6.1 months while the median overall survival (mOS) was 17.3 months, and the objective response rate (ORR) was 33.3%. Patients with a performance status (PS) score of 1 had a significantly better outcome than those with a poor PS score (>1) (mPFS: 7.3 m vs. 0.4 m, P=0.002; mOS: 21.2 m vs. 9.3 m, P=0.000).Conclusions The efficacy of targeted therapy for NSCLC with MET exon 14 skipping in this study were worse than published data of clinical trials, which may be related to poor performance status or primary drug resistance.
MET 14外显子跳跃突变作为少见突变, 在西方人群中的发生频率约为3%~4%[1, 2, 3], 在中国人群中的发生频率则低至1%[4, 5, 6, 7]。Awad等回顾性分析34例未接受MET抑制剂治疗的MET 14外显子跳跃突变晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者, 中位总生存期(median overall survival, mOS)仅8.1个月[8], 预后较差。近年MET 14外显子跳跃突变NSCLC终于迎来靶向治疗的春天。多项临床研究显示, MET抑制剂在此类肺癌患者中具有良好的抗肿瘤活性, 客观缓解率(objective overall survival, ORR)为32%~68%, 中位无进展生存期(median progressive-free survival, mPFS)超过6.9个月[9, 10, 11]。目前的报道多为临床研究数据, 而临床实践中, 一部分患者因体力活动状态(performance status, PS)评分较差、存在不稳定的脑转移病灶或其他原因无法入组临床试验, MET抑制剂在这部分真实世界的患者中的疗效报道仍较少。Yang等分析了44例一线使用克唑替尼治疗的患者, PFS达8.1个月[7]。一项回顾性研究中, 20例MET 14外显子跳跃突变晚期NSCLC韩国患者, 4例使用克唑替尼治疗的经治患者仅1例维持了8.1个月的疾病稳定(stable disease, SD), 另外3例均在服药4~9天内进展死亡, ORR为0%。研究者认为较差的疗效可能与患者使用靶向治疗时已经过多线治疗相关[5]。因而本研究将分析本中心真实世界中MET14外显子跳跃突变晚期NSCLC的临床特征及治疗疗效。
本研究回顾性收集广东省肺癌研究所从2017年2月1日至2021年2月1日期间不符合临床试验入组标准或不愿意参加临床试验的MET 14外显子跳跃突变局部晚期和转移性NSCLC患者, 基线共存EGFR、ALK等其他敏感突变除外。
所有患者的人口学资料包括年龄、性别、吸烟状态、PS评分、病理类型、TNM分期、基因状态、肿瘤细胞程序性死亡配体1(programmed death ligand 1, PD-L1)表达水平和治疗方案、肿瘤影像学评估资料均从广东省人民医院电子病历系统收集。所有患者或家属均已签署知情同意书。
部分患者自愿申请并获得北京浦润奥生物科技有限责任公司免费提供伯瑞替尼用于治疗, 即同情给药, 已签署知情同意书。
OS定义为从接受一线治疗当天至任何原因导致的死亡之间间隔的时间。PFS定义为从接受该线治疗当天至疾病进展或任何原因死亡之间间隔的时间。随访时间截至2021年5月8日。
检测方法为免疫组织化学法, 采用22C3抗体, 按肿瘤细胞阳性比例分数(tumor proportion score, TPS)判读PD-L1表达水平:PD-L1染色肿瘤细胞数/总肿瘤细胞数(PD-L1染色和非染色)× 100%。检测结果的定义:阴性:< 1%; 低表达:1%~49%; 高表达:≥ 50%。
使用燃石和世和二代基因测序(next generation sequencing, NGS)检测患者的血浆、肿瘤组织或浆膜腔积液中的基因突变状态。
应用GraphPad Prism 8统计软件对结果进行统计分析。生存分析使用Kaplan-Meier法, 组间比较使用卡方检验, P< 0.05认为有统计学意义。
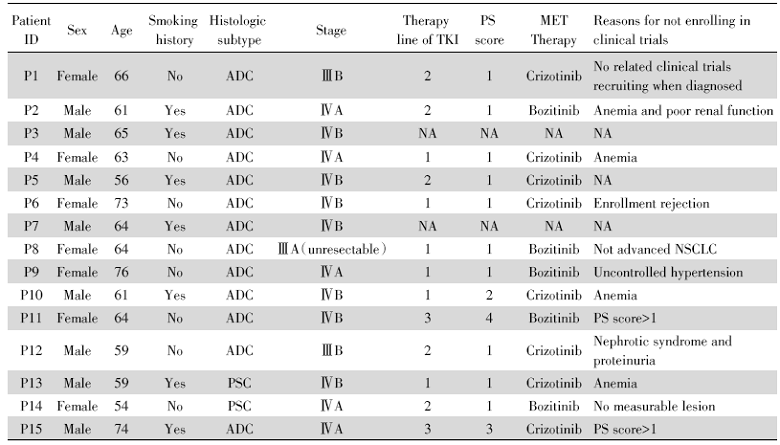
共收集30例MET 14外显子跳跃突变局部晚期或转移性NSCLC患者, 剔除15例为MET抑制剂临床试验入组患者, 剩余15例纳入分析。患者中位年龄为64岁, 范围54~76岁, 男性占53.3%, 女性46.7%。吸烟者占46.7%。绝大多数(86.7%)为腺癌, 2例为肉瘤样癌, 见表1。
| 表1 MET 14外显子跳跃突变NSCLC患者的临床病理特征 Tab.1 Clinical and pathologic characteristics of NSCLC patients harboring MET exon14 skipping |
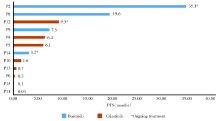
15例患者中, 2例基线仅进行8个驱动基因的检测, 不纳入基线共存基因分析。另13例进行了超过139个基因的NGS。共检测出5种MET 14外显子跳跃突变亚型。常见的伴随基因为TP53(53.8%)、MYC(23.1%)、ATM(23.1%), 并多以共突变的形式存在, 见图1。
 | 图1 13例MET 14外显子跳跃突变NSCLC基线基因变异情况Fig.1 Genetic profile at the baseline of NSCLC harboring MET exon 14 skipping |
10例患者进行PD-L1检测。大部分患者(70.0%, 7/10)PD-L1呈高表达(≥ 50%)水平, 低表达(1%~49%)占10.0%(1/10), 阴性占20.0%(2/10)。
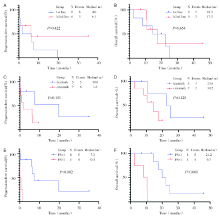
13例患者使用MET抑制剂治疗, 其中5例使用伯瑞替尼(同情给药)、8例使用克唑替尼治疗。中位随访时间为45.9个月, 范围2.3个月~45.9个月。12例可进行疗效评价的患者中, mPFS为6.1个月(图2A, 图3), mOS为17.3个月(图2B), ORR为33.3%。6例初治患者的mPFS为4.0个月, mOS为18.3个月, 与经治患者(mPFS 6.1个月, mOS 17.3个月)相比无显著性差异(图4A~B)。尽管5例使用伯瑞替尼治疗的患者的mPFS和mOS均长于7例使用克唑替尼治疗的患者(mPFS:19.6个月vs. 1.6个月, mOS:23.6个月vs. 14.2个月), 然而没有统计学意义(图4C~D)。8例患者用药前PS=1分, 4例患者PS> 1分, PS=1分的患者生存结局明显优于PS> 1分的患者(mPFS:7.3个月vs. 0.4个月, P=0.002; mOS:21.2个月vs. 9.3个月, P=0.000, 图4E~F)。
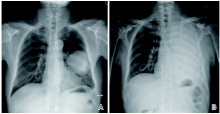
5例患者PFS小于3个月。P6, 73岁女性, 初诊确诊为右上肺腺癌cT4N2M1c(右肺下叶、多发骨)Ⅳ B期。肺穿刺组织NGS示MET 14外显子c.3028+3A> G突变, PS评分1分, 一线使用克唑替尼治疗0.7个月后出现胸闷气促, 外院胸片提示新发大量右侧胸腔积液, 入院后紧急行胸腔穿刺术, 胸水病理:腺癌。判断疾病进展。P10, 61岁男性, 初诊时确诊为左上肺腺癌cT4N2M1c(左侧额叶、右侧腹壁、肝)Ⅳ B期。肺穿刺组织示MET 14外显子c.2888-1G> A突变, PS评分2分, 一线使用克唑替尼治疗, 无临床获益, 胸片示新发大量左侧胸腔积液, PFS 1.6个月(图5)。P11, 64岁女性患者, 确诊为右上肺微乳头状癌cT2aN3M1c(多发骨、肝、肾上腺、肾)Ⅳ B期, 淋巴结活检组织示MET 14外显子c.3028+2T> C突变, 三线使用伯瑞替尼治疗时PS评分已4分, 服药1天后死亡。P13, 59岁男性, 初诊确诊为左上肺肉瘤样癌cT2aN2M1c(双肺、肝、左肾上腺、骨、肾、喙肱肌)Ⅳ B期。肺穿刺组织示MET 14外显子c.2887+25_3028+946del突变, PS评分2分, 一线使用克唑替尼治疗0.7个月后全身骨痛加重, 外院复查CT示肺部原发灶稳定, 全身转移病灶范围增大, 判断疾病进展。P15, 74岁男性, 确诊为左下肺腺癌cT1bN3M1a(胸膜)Ⅳ A期, MET 14外显子c.2888-33_2888-1del突变。三线使用克唑替尼治疗时PS评分为3分, 服药3天后死亡。
MET14外显子跳跃突变在肺癌中多发于年龄较大的腺癌、肉瘤样癌患者中, 预后较差。自2015年Paul报道伴随此类突变的晚期肺腺癌患者可从MET酪氨酸激酶抑制剂中获益后, 相关靶向药物的临床试验相继开展, 且均取得良好的抗肿瘤活性, 延长了患者的PFS, 见表2。由于临床研究入组要求较高, 大多数PS评分较差、或存在不稳定的脑转移病灶、或各器官功能存在一定缺陷的患者均被排除在外, 此类患者在真实世界中占比不少, 因而有必要单独分析真实世界中患者使用靶向药物治疗的疗效。
| 表2 已开展的针对MET 14外显子跳跃突变NSCLC的靶向药物临床试验 Tab.2 Clinical trials of targeted therapy to NSCLC harboring MET exon 14 skipping |
本研究回顾性分析了15例真实世界中MET 14外显子跳跃突变晚期NSCLC患者, 在12例使用MET抑制剂靶向治疗且可进行疗效评估的患者中, ORR为33.3%, mPFS 6.1个月, mOS 17.3个月。总体疗效和生存低于已报道的数据。5例PFS小于3个月的患者中, 2例使用MET抑制剂时已是多线治疗, 服药后无获益, 考虑与病情重、已至肿瘤终末阶段有关。另3例均为初治患者, 使用克唑替尼治疗, 基线体能状态尚可。对12例患者进行的生存分析结果显示, 靶向治疗疗效与用药时PS评分密切相关, 而与治疗线数及靶向药物种类无关。对于PS评分, Liu等汇总了115例公开报道的EGFR突变肺鳞癌患者, 在单变量和多变量分析中, 基础状态较好的患者(PS< 2分)具有较长的靶向治疗PFS[14]。Dudnik等对77例携带罕见驱动基因突变(EGFR/ALK除外)的晚期NSCLC进行多因素分析, 发现确诊为晚期NSCLC后的OS与PS评分(P=0.01)显著相关[15]。因而考虑PS评分可能也是影响MET抑制剂在MET 14外显子跳跃突变NSCLC中疗效和生存的因素。对于治疗线数, 如表2所示, 在GEOMETRY mono-1研究中, 一线使用卡马替尼的患者, ORR及mPFS均优于二线及以上线数使用的患者, 然而, 在其他MET抑制剂的临床研究中, 并没有观察到这一点, 在本研究中, 也显示治疗线数同疗效无明显关系。对于靶向药物的种类, 克唑替尼作为非选择性MET抑制剂, PROFILE研究报道的疗效不如其他特异性MET抑制剂, 但尚无头对头的随机对照试验提供更坚实的数据。本研究中, 使用伯瑞替尼和克唑替尼治疗的患者mPFS和mOS不存在显著统计学差异, 但因本研究例数较少, 以上结论仍有待更大的样本数据进行验证。
此外, 较短时间内进展还需考虑原发耐药, 耐药是靶向治疗不可避免的难题, 现有多项研究对MET抑制剂的耐药机制进行探索。已报道的获得性耐药机制有MET第二位点突变和EGFR、BRAF、KRAS、HER3旁路激活等[16, 17]。但对于原发耐药机制以及在一定程度上影响MET抑制剂疗效的因素, 阳性结论仍较少。Robin等结合靶向质谱分析、基于DNA/RNA NGS测序和免疫组化, 分析了患者治疗前合并共存的基因突变、全基因组复制、肿瘤突变负荷(tumor mutational burden, TMB), 并没有发现与疗效或生存的相关性。相反, 治疗前在组织中可以检测到MET蛋白表达的患者, 疗效明显优于无法检测到MET蛋白表达的患者。这提示对于初治患者, 也许可通过检测MET蛋白表达对疗效进行预测[17]。Yang等发现基线合并MET扩增同较短的PFS相关(P=0.029)[7]。这些结论仍需要更多的临床数据加以验证。而在本研究中, 我们同样发现MET 14外显子跳跃突变患者基线多合并共存TP53、MYC等基因异常, 但因样本例数较少, 无法进行与疗效的关联性分析。相应的原发或获得性耐药机制我们将在另外一篇文章进行阐述。
除了靶向治疗外, MET 14外显子跳跃突变患者免疫治疗疗效也在探索中。目前普遍认为PD-L1为预测免疫治疗疗效的生物标志物[18, 19], 但在MET14外显子跳跃突变的NSCLC中, PD-L1和TMB均无法很好预测免疫治疗的疗效。Sabari等对111例MET 14外显子跳跃突变的NSCLC肿瘤组织进行PD-L1检测, PD-L1表达为0%、1%~49%、50%以上的发生率分别为37%、22%和41%。然而PD-L1高表达或TMB高的人群中并没有展示更好的疗效[20]。本研究中, PD-L1呈高表达水平者占大多数, 仅3例患者曾接受免疫治疗, 3例中2例PD-L1高表达, 1例阴性, 均未获益。Marie等报道了6例MET 14外显子跳跃突变的晚期NSCLC, PD-L1表达水平分别为70%、20%、40%、< 1%、90%和未知状态[21], 患者在一线化疗失败后接受了免疫治疗, 4例部分缓解, 2例完全缓解。总的来说, 免疫治疗在MET 14外显子跳跃突变晚期NSCLC中的疗效和优势人群仍有待进一步研究。
综上, 本研究初步分析了本中心真实世界中MET 14外显子跳跃突变NSCLC的临床病理、分子特征和治疗疗效。本研究的不足在于这是一项单中心的回顾性分析, 样本量较小, 可能存在选择偏倚。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|