作者简介:
陈贤哲(1994-),女,广东清远人,在读博士研究生,主要研究方向为乳腺肿瘤研究。
患者女性, 50岁, 因“ 乳癌单切术后5年伴胸部结节转移1月余” 入院。已婚, G2P1, 绝经前(15
2016年7月在外院行“ 右乳癌乳房单纯切除术+前哨淋巴结活检术” 。术后病理类型:(右乳)乳腺粘液癌。分期:pT2N0M0(肿瘤大小:3.5 cm)LN 0/7。分型:Luminal A(ER:80%中等强度, PR:70%中等强度, CerbB2:0, Ki67:10%)。后续未化疗(21gene:17), 未放疗, 一直行三苯氧胺内分泌治疗。2021年7月外院B超提示右侧胸壁皮下实性结节, 大小1.9 cm× 1.6 cm, 外院行穿刺活检。术后病理:转移性乳腺粘液癌。术后分型:Luminal A(ER:95% 强, PR:60% 中-强, CerbB2:1+, Ki67:15%)。全身检查:无远处转移。无病生存期(disease-free survival, DFS)达5年。
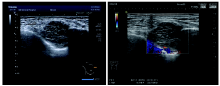
入院后行专科检查:右乳呈术后缺如, 左乳皮肤外观正常, 无橘皮样改变, 乳头乳晕无糜烂, 乳头无凹陷, 未触及肿物。双侧腋窝未触及肿大淋巴结, 双侧锁骨上窝未触及肿大淋巴结。辅助检查:2021-08-02行胸壁超声检查示:右侧胸壁2、3肋骨与胸骨柄交界处可见一大小2.4× 2.1 cm低回声光团, 边界欠清, 内回声欠均, 该光团与周围骨组织分界欠清, BI-RADS 5类, 见图1。
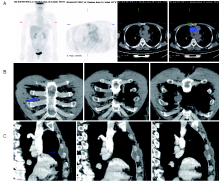
2021-08-05行PET/CT检查示:(1)“ 右侧乳腺癌术后” :右侧乳腺缺如; 右侧胸壁结节, 糖代谢轻度增高, 考虑转移性病变。(2)18F-FDG-PET/CT体部扫描余部位未见恶性肿瘤代谢影像, 见图2。
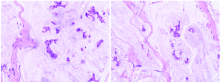
2021-08-16行右侧胸壁结节活检病理结果示:(右胸壁肿物1)(右胸壁肿物2)结合病史, 符合粘液癌; (右胸壁肿物2)肿瘤细胞免疫组化:P63(-), CK5/6(-), Ki67(1%+), P120(+++), ECD(+++), CgA(-), Syn(-), AR(10%+), ToPⅡ a(-), Tau(++), CD44S(++), Bcl2(+++), C-MET(80%, ++), PD-L1(阴性试剂对照)(-), PD-L1(22C3)(CPS:0), P53(-), CD8(免疫细胞+), FOXC1(-); ER:3+(95%), PR:1+(10%), HER-2:2+(FISH:阴性)。见图3。
杨辞秋(乳腺肿瘤科医师):汇报病史特点(同上)。提出讨论要点:(1)患者乳腺癌术后5年局部复发, 目前应首选局部治疗还是全身治疗?(2)目前手术是否合适?能否请肺科会诊根治性切除局部胸部结节?(3)该患者后续治疗?选择放疗、内分泌治疗还是靶向治疗?
王思云(核医学主任医师):根据患者右侧胸壁结节的PET-CT显像特点, 考虑转移性病变, 该位置不除外右侧内乳淋巴结转移, 且该软组织肿块包绕胸廓内血管, 可疑肋软骨侵犯。
杨学宁(肺外科主任医师):根据王思云主任分析该患者右侧胸壁结节的PET-CT显像情况, 就外科角度考虑, 患者右侧胸壁局部复发病灶确实可通过手术根治性切除, 但考虑到可疑肋软骨侵犯以及肿瘤的浸润特点, 手术可能需要切除肿块周围的组织, 包括部分肋骨, 同时通过手术重建胸廓外形, 术后可能仍需要放射治疗, 考虑患者年龄不大, 手术切除则可能带来较大的创伤, 影响患者后续的生活质量。可考虑先全身治疗, 若全身治疗效果不佳, 外科手术可作为补救性措施。
潘燚(放疗科主任医师):患者局部复发的位置确实适合局部放射治疗, 通过控制放射剂量及强度, 甚至可以达到治愈, 创伤要比手术切除小。首次复发患者局部小野照射会导致高达50%以上的再次复发率, 且小野照射后再次复发中有2/3位于原照射野以外, 所以在既往没有接受过术后放疗的患者中照射靶区需要覆盖患侧全胸壁, 并需要对锁骨上/下淋巴引流区进行预防性照射。弥漫性复发患者需要先行全身性治疗, 根据局部病变的退缩情况并排除远处转移后, 再行胸壁和区域淋巴结的放疗。
杨衿记(肺内科主任医师):除了考虑局部治疗, 可能需要检测患者有无存在致病的基因突变, 患者是在术后内分泌治疗第5年出现复发的, 是否存在内分泌治疗耐药情况, 有无存在基因突变, 例如ESR1突变, 通过基因检测明确患者存在的致病基因或突变基因, 为后续内分泌治疗及靶向治疗的药物选择提供依据。
吴一龙(肿瘤学教授):我们在参考既往循证证据的同时, 要注意患者的特殊性, 例如该患者是在内分泌治疗期间出现复发的。在围绕局部治疗及全身治疗的选择, 需要列出不同治疗方案的利弊, 同时提供相应临床证据进行比较, 从而选择患者更有利的方案。在重视体内药敏信息指导治疗的今天, 借用早期乳腺癌新辅助治疗的理念, 对于可手术的局部复发乳腺癌, 同样可以应用全身治疗, 同时以此局部复发病灶退缩程度作为解救治疗效果的评价指标, 从而选择更有效的全身解救治疗方案, 尽可能杀灭那些潜在的已经全身播散的肿瘤细胞, 降低远处脏器的转移风险。
旁述:根据《中国抗癌协会乳腺癌诊治指南与规范》[1]中关于乳房切除术后胸壁复发:对于胸壁结节可切除者, 推荐局部广泛切除。但是单纯手术切除的后续再次复发率可达60%~75%, 放射治疗可以显著降低再次复发率, 是局部区域性复发患者综合治疗的主要手段之一。弥漫性复发患者则需要先行全身性治疗, 根据局部病变的退缩情况并排除远处转移后, 再行胸壁和区域淋巴结的放疗。胸壁结节较大或不可切除如有全身治疗指征, 经全身治疗后结节缩小预计有切除可能者, 先全身治疗有助于增加局部治疗成功的可能性。
根据《中国晚期乳腺癌临床诊疗专家共识》[2]中关于胸壁和区域(淋巴结)复发:(1)由于存在同时发生远处转移灶的风险, 患者应接受全面评估, 包括胸、腹、骨; (2)在可行和并发症低的情况下, 应手术切除胸壁和区域复发灶; (3)既往未接受放疗者, 可行局部区域放疗; (4)ER阳性者, 局部或区域治疗后接受内分泌治疗可改善长期疗效; (5)全身治疗应评估肿瘤生物学特征、既往治疗、无病间期、患者因素(合并症、体力状态等); (6)不适合接受根治性局部治疗的患者, 姑息性全身治疗应遵循转移性乳腺癌治疗的原则, 可考虑接受姑息性局部治疗。
DBCG[3]研究(乳房切除术后+化疗+放疗)后续研究对535例局部复发分别予以局部或全身治疗, 其中全身治疗的完全缓解率(complete response, CR)仅有46%, 2年以上局部控制率仅为11%, 而采用手术+放疗, CR达96%, 2年以上局部控制率可达45%, 表明局部复发病灶通过局部治疗比全身治疗局部控制率高。CALOR[4, 5]研究是关于局部复发的患者在局部复发灶切除后再随机是否接受化疗, 研究表明在乳腺癌孤立局部区域复发完整切除后进行化疗可以显著提高患者5年DFS和总生存期(overall survival, OS), 尤其在ER阴性患者中。该研究表明手术+化疗可改善局部复发乳腺癌的生存情况, 提供了临床可借鉴的先手术后化疗的模式, 表明局部复发病灶通过局部治疗联合全身治疗可达到更好的生存获益。此外, 本中心参与来自中日韩[6]1 200例登记病例的回顾性队列分析, 接受局部治疗联合系统治疗对于寡转移性乳腺癌是一个有前景的治疗策略, 对于10年总体生存率, 局部治疗联合系统治疗可达到60%, 而全身治疗只有42%。
该患者在我院完成全身检查, 未见其它远处转移, 仅有右侧胸壁局部结节复发, 但考虑到可疑肋软骨侵犯以及肿瘤的浸润特点, 手术可能需要切除肿块周围的组织, 包括部分肋骨, 可能带来较大的创伤, 影响患者后续的生活质量。患者目前ECOG PS=0~1, 无其他合并症, 激素受体(hormone receptor, HR)阳性, 术后三苯氧胺内分泌治疗第5年出现局部复发, 可考虑先行内分泌治疗联合靶向治疗, 若全身治疗效果不佳, 外科手术或局部放疗可作为补救性措施。
王坤(乳腺肿瘤科主任医师):综合大家上述讨论建议, 首先完善患者局部复发病灶的组织活检以及基因检测, 用于指导临床全身治疗的药物选择, 目前拟先行系统全身治疗, 待右侧胸壁结节退缩至最佳临床缓解状态, 再行局部手术根治性切除以及局部放射治疗。
后记:患者于2021-08-16在广东省人民医院行右侧胸壁活组织检查, 推荐患者使用CDK4/6抑制剂+依西美坦, 患者因经济原因拒绝, 改行西达本胺+依西美坦全身治疗, 拟每个月进行一次治疗效果评估, 待右侧胸壁结节退缩至最佳临床缓解状态返院行局部治疗。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|