| 陈锦章,南方医科大学南方医院肝脏肿瘤中心副主任医师、硕士生导师。主要从事肝胆胰肿瘤的临床及科研工作,擅长肝脏肿瘤消融、肝癌的多学科综合治疗。现任广东省基层医药学会肝癌防治专业委员会副主任委员兼秘书长、广东省老年保健协会肝癌MDT专业委员会副主任委员、广东省药学会肝胆肿瘤多学科综合治疗专家委员会副主任委员、中国研究型医院学会肝病专业委员会常务委员、广州抗癌协会转化医学专业委员会常务委员、广东省肝脏病学会微创治疗专业委员会常务委员、广东省生物医学工程学会智能介入分会常务委员、广东省临床医学学会肝癌与肝转移瘤专业委员会常务委员、中国医师协会肝癌专业委员会委员、广东省医学会肝癌分会委员、广东省医师协会肝病专科医师分会委员,广东省自然科学基金评审专家,兼任《南方医科大学学报》编委。 近2年来以第一作者/通讯作者(含共同)在《Cancer Commun》《Front Immunol》等SCI收录的杂志发表论文8篇,影响因子达45。承担广东省自然科学基金3项,主持中晚期肝癌治疗方向的国内多中心临床研究1项,单中心临床研究2项,参与国家自然科学基金4项,参与国际(国内)多中心临床研究多项。 |
Finn RS, Qin S, Ikeda M, et al. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma[J]. N Engl J Med, 2020, 382(20):1894-1905.
1b。
索拉非尼与仑伐替尼作为不可切除肝癌的一线系统治疗具有明显的副作用。既往文献表明, 程序性死亡受体1(programmed cell death 1, PD-1)抑制剂并未明显提高肝癌患者总生存期(overall survival, OS), 而抗血管内皮生长因子(vascular epithelial growth factor, VEGF)治疗可能通过转变VEGF介导的免疫抑制及增强肿瘤中T细胞浸润而提高PD-1及程序性死亡配体1(programmed cell death ligand 1, PD-L1)抑制剂的疗效。阿替利珠单抗联合贝伐珠单抗在Ⅰ b期研究中展现了令人鼓舞的效果。
IMbrave150研究旨在评估阿替利珠单抗联合贝伐珠单抗方案对比索拉非尼在既往未接受过系统性治疗的不可切除肝细胞癌(hepatocellular carcinoma, HCC)患者中的作用。
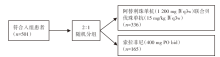
• 研究方法:全球性、多中心、开放性、Ⅲ 期临床试验(NCT03434379)。
• 研究对象:局部进展或转移性肝细胞癌患者, 伴或不伴不可切除性肝细胞癌, 且既往未进行系统治疗。
• 干预措施:患者按2∶ 1随机接受阿替利珠单抗(1 200 mg Ⅳ q3w)和贝伐珠单抗(15 mg/kg Ⅳ q3w)联合治疗或索拉非尼(400 mg PO bid)治疗, 直至无临床获益或出现不可接受的毒性。分层依据包括:地区[亚洲(除外日本)vs. 其它地区]; ECOG PS评分(0 vs. 1); 大血管侵犯或肝外转移(伴vs. 不伴); 初始AFP水平(< 400 vs. ≥ 400 ng/mL)。研究路线见图1。
• 研究终点:主要研究终点包括OS和无进展生存期(progression-free survival, PFS), 次要研究终点是客观缓解率(objective response rate, ORR)和缓解持续时间。
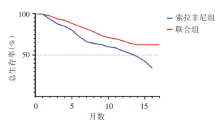
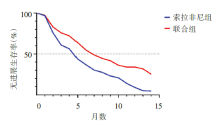
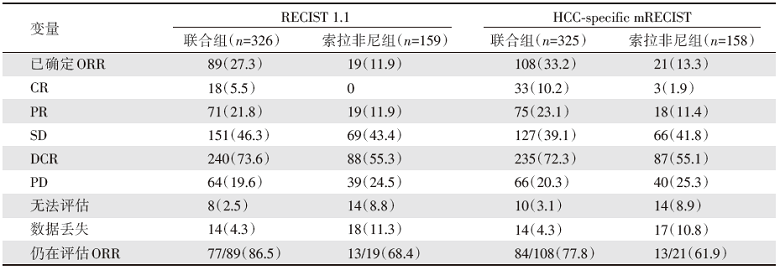
截至2019年8月29日, 阿替利珠单抗联合贝伐珠单抗治疗组与索拉非尼治疗组的中位随访时间分别为8.9个月及8.1个月。阿替利珠单抗联合贝伐珠单抗治疗组OS及PFS显著长于索拉非尼治疗组(图2及图3)。阿替利珠单抗联合贝伐珠单抗治疗组在6个月及12个月的最终生存率分别为84.8%[95%可信区间(confidence interval, CI)80.9~88.7]及67.2%(95%CI 61.3~73.1), 而索拉非尼治疗组则为72.2%(95%CI 65.1~79.4)及54.6%(95%CI 45.2~64.0)。根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)1.1及HCC-specific mRECIST标准, 阿替利珠单抗联合贝伐珠单抗治疗组的ORR优于索拉非尼治疗组(表1)。
| 表1 联合组与索拉非尼组有效性对比 例数[占比(%)] |
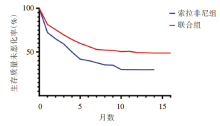
根据EORTC QLQ-C30问卷评估结果, 阿替利珠单抗联合贝伐珠单抗治疗组对比索拉非尼治疗组更晚出现生命质量恶化, 患者出现生命质量恶化中位时间联合组为11.2(6.0~未达到), 索拉非尼组为3.6(3.0~7.0), 见图4。
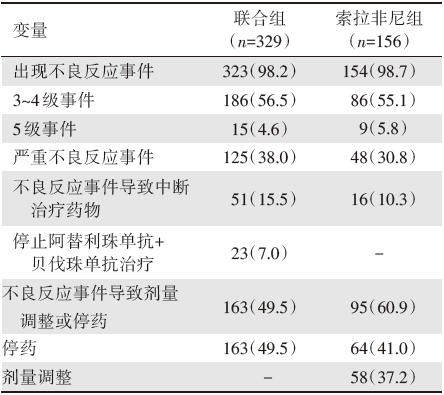
在治疗的安全性方面, 两组表现出了相近不良反应事件发生率, 其中阿替利珠单抗联合贝伐珠单抗治疗组相较于索拉非尼治疗组更少因不良反应事件而调整剂量及停药, 然而阿替利珠单抗联合贝伐珠单抗治疗组对比索拉非尼治疗组出现了更高的严重不良反应事件发生率(表2), 其中联合组最常见的3~4级不良反应事件是高血压(15.2%)。
| 表2 相关不良反应事件发生率 例数[占比(%)] |
IMbrave150研究展现了阿替利珠单抗联合贝伐珠单抗在不可切除肝癌且未接受系统治疗的患者中, 有显著优于索拉非尼的OS及PFS。同时, 对比索拉非尼, 接受联合治疗的患者更晚出现生存质量及功能的下降。但在另一方面, 接受联合治疗的患者出现了更高的严重毒性反应发生率。
据我国癌症中心发布的2015年癌症流行数据显示, 我国肝细胞癌(hepatocellular carcinoma, HCC)的发病率和死亡率分别为第五位和第二位, 其5年总体生存率不足15%, 严重威胁人民生命健康[1]。HCC往往起病隐匿, 进展迅速, 近7成患者在发现时已处于晚期, 丧失了根治机会, 姑息性系统(全身)治疗是该部分患者的主要治疗手段。我国原发性肝癌诊疗规范(2019年版)推荐:Ⅱ b、Ⅲ a、Ⅲ b期患者可选择系统治疗[2]。然而, 截至2019年, 全球仅有两种分子靶向药物(索拉非尼及仑伐替尼)获批肝癌一线治疗, 中位OS为6.5~13.6个月, 临床获益有限[3, 4]。
近年来, HCC系统治疗取得突破性进展, 特别是以PD-1/PD-L1抑制剂为代表的免疫检查点抑制剂(immune checkpoint inhibitors, ICI)治疗打破了分子靶向药物的垄断格局, 而免疫治疗联合抗血管生成靶向治疗的策略更显示出优效性, 由此PD-1/PD-L1抑制剂联合靶向治疗开始成为新的研究热点。其中, 2020年5月14日《N Engl J Med》发表了一项针对晚期不可切除肝癌的国际多中心、随机、对照、开放标签的3期临床试验, 即IMbrave150的研究结果:阿替利珠单抗联合贝伐珠单抗(简称“ T+A” 方案)与索拉非尼相比可降低晚期HCC患者42%的死亡风险, 改善患者OS[19.2个月 vs. 13.4个月, 风险比(hazard ratio, HR)=0.66, P=0.000 9], 延长PFS(6.9个月vs. 4.3个月, HR=0.000 1)(RECIST v1.1), 提高ORR(30% vs. 11%, P< 0.000 1), 由此“ T+A” 方案成为晚期HCC患者的一线治疗方案。更令人惊喜的是, IMbrave150研究更新结果提示中国人群中位生存达24个月[5]。
相比既往的研究, IMbrave150研究在设计上具有的最大优势是该研究对纳入患者的肿瘤负荷没有特别的排除标准, 更符合临床实践中的患者情况。从研究报道的患者基线特征分析中可以看到, 纳入的受试者中82%为巴塞罗那临床肝癌(Barcelona Clinic Liver Cancer, BCLC)C期患者, 38%有血管侵犯, 63%有肝外转移, 可见该研究结果对临床的指导意义更大。其次, 该研究对受试者的安全数据报道详尽, 具有重要的临床指导价值。IMbrave150研究提示阿替利珠单抗联合贝伐珠单抗治疗安全性良好, 不良事件(adverse event, AE)的发生与各个药物已知的安全特性及潜在基础疾病相关。研究中各个药物中位治疗时长分别为:阿替利珠单抗7.4个月, 贝伐珠单抗6.9个月, 索拉非尼2.8个月。所有级别AE阿替利珠单抗联合贝伐珠单抗组和索拉非尼组分别为98.2%和98.7%, 3~4级AE分别为56.5%和55.1%, 5级AE分别为4.6%和5.8%, 严重不良事件分别为38.0%和30.8%(未发现特殊事件可以解释联合组该发生率升高)。IMbrave150研究中, 阿替利珠单抗联合贝伐珠单抗组患者的生活质量得到很好的维持, 对比索拉非尼组, 患者生活质量恶化的中位时间明显延迟了7.6个月。
但在受到鼓舞之余, 我们仍需要理性思考, 对于IMbrave150研究存在的以下局限性:首先, 该研究为开放标签设计, 无法与随机、对照、双盲的研究设计相媲美, 尽管该研究为了最大限度地减少与开放标签设计相关的偏差, 选择了盲法独立审查机构(independent review facility, IRF)评估的PFS作为共同主要终点。其次, 为考虑研究的安全性, 该研究入组的受试者肝功能分级(Child-Pugh分级)均为A级, 对于临床实践中Child-Pugh B级的患者指导意义有限。接着, 该研究中贝伐珠单抗不存在剂量调整的情况, 使用剂量为15 mg/kg, 如受试者出现与贝伐珠单抗相关的不能耐受的AE, 方案建议停用贝伐珠单抗, 在条件允许的情况下, 可恢复贝伐珠单抗的用药, 这与既往靶向药物的使用方法有区别。在临床实践中, 是否可以考虑下调贝伐珠单抗的剂量, 减少用药相关不良反应, 延长患者的治疗时间呢?然后, 考虑到贝伐珠单抗及索拉非尼的出血风险, 该研究排除了重度食管胃底静脉曲张或中度食管胃底静脉曲张并具有高出血风险人群。但我们临床实践中大多数HCC患者有肝硬化、门脉高压和(或)食管胃底静脉曲张的背景, 贝伐珠单抗用于该部分人群, 尤其是高出血风险人群的安全性数据尚需进一步论证。最后, 尽管该研究在所有级别AE方面进行比较, 阿替利珠单抗联合贝伐珠单抗组和索拉非尼组均无统计学差异, 但蛋白尿的发生在阿替利珠单抗联合贝伐珠单抗组更常见(21% vs. 8%), 且随着治疗时间的延长, 受试者出现蛋白尿的风险越高。根据IMbrave150研究及不良事件常用毒性标准(Common Toxicity Criteria of Adverse Events, CTCAE)5.0版指导意见, 当24小时尿蛋白定量≥ 2 g时, 需要暂停贝伐珠单抗治疗。若出现了肾病综合征, 就永久性停止贝伐珠单抗治疗。那么, 在停用贝伐珠单抗, 单用免疫治疗的情况下, 将会有多少患者出现疾病进展?在临床实践中, 如患者出现24小时尿蛋白定量≥ 2 g时是否可考虑调整贝伐珠单抗的剂量, 而不是直接停用?如停用贝伐珠单抗后存在进展, 在24小时尿蛋白定量≥ 2 g的情况下, 应如何为患者选择后线的治疗方案?以上问题需要我们在临床实践中寻找答案, 需真实世界的研究数据进一步验证。
综上所述, 阿替利珠单抗联合贝伐珠单抗方案为中晚期肝细胞癌的治疗带来巨大的进步, 使中晚期肝癌的中位OS从1年提升到2年, 目前该治疗方案为中晚期肝癌的一线治疗方案, 在临床实践中, 需评估患者的体力状况、肝功能、出血风险、合并疾病, 并建议经肝脏肿瘤多学科团队讨论后执行。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|