| 范卫君,主任医师,博士研究生导师,中山大学附属肿瘤医院微创介入治疗科主任,主要从事原发性肝癌及各类肝转移瘤(尤其是黑色素瘤肝转移)的微创介入治疗,对肿瘤微波消融治疗具有较高的造诣,并已开展较多高质量基础与临床研究工作。目前以第一作者及通讯作者发表SCI论文30余篇,主持国家自然科学基金面上项目2项,主持广东省科技厅、广东省卫生厅、广州市科技局课题多项。主编或参编多本学术专著,其中,担任《临床肿瘤学》主编,《肝癌微创治疗与多学科综合治疗》及《肿瘤介入诊疗学》副主编,参与《神经影像学》《鼻咽癌》及《螺旋CT诊断学》的编写。 现任中国医师协会介入医师分会肿瘤消融专业委员会主任委员、中国医师协会肿瘤消融治疗技术专家组组长、中国临床肿瘤学会(CSCO)肿瘤消融治疗专家委员会主任委员、中国抗癌协会肿瘤消融专业委员会候任主任委员、中华放射学会介入学组呼吸介入专业委员会主任委员、广东省基层医药学会微创介入专业委员会主任委员、广东省抗癌协会肿瘤微创治疗专业委员会候任主任委员。兼任《J Cancer Res Ther》杂志副主编,《中华放射学杂志》通讯编委,《解剖与临床》杂志编委。获得2019年第三届“国之名医·优秀风范”称号。 |
Kudo M, Ueshima K, Ikeda M, et al. Randomised, multicentre prospective trial of transarterialchemoembolisation (TACE) plus sorafenib as compared with TACE alone in patients with hepatocellular carcinoma: TACTICS trial[J]. Gut, 2020, 69(8):1492-1501.
2a。
经动脉化疗栓塞术(transarterial chemoembolization, TACE)为中期不可切除肝细胞癌(hepatocellular carcinoma, HCC)推荐的治疗。然而, 对于不可切除的HCC患者予TACE可导致肿瘤内血管内皮生长因子(vascular endothelial growth factor, VEGF)浓度升高, 进而影响HCC疗效。索拉非尼(sorafenib)为晚期不可切除HCC患者的标准治疗药物, 可作用于VEGF受体上, 从而发挥抗血管生成和直接抗肿瘤作用。TACE联合索拉非尼在不可切除HCC中的疗效尚存在争议, Japan-Korea post-TACE研究和SPACE研究亚组分析的结果表明, 接受索拉非尼联合TACE的疗程长短与不可切除HCC患者的临床疗效显著相关。既往已有临床试验表明了TACE及索拉非尼单独治疗用于治疗不可切除HCC患者, 均可延长其生存期, 但在TACE联合索拉非尼的多个试验中存在不同结果。
比较了TACE联合索拉非尼治疗与单纯TACE治疗在不可切除或不适合消融治疗的HCC患者的安全性和疗效。
• 研究方法:日本33家中心开展的随机、开放标签、多中心试验(NCT01217034)。
• 研究时间:2011年2月至2016年3月。
• 研究对象:纳入标准包括肿瘤局限于肝脏, 肿瘤最大直径不超过10 cm, 最大结节数为10个, 无血管浸润/肝外转移, ECOG PS评分0~1, Child-Pugh分级B级≤ 7分, 可通过TACE治疗的HCC患者。排除标准包括既往或当前存在其他恶性肿瘤, 但复发风险低的早期癌症或在纳入前> 3年接受治疗且无复发的恶性肿瘤除外。
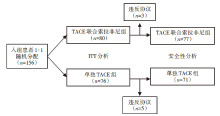
• 干预措施:按1∶ 1随机分配接受TACE联合索拉非尼治疗(联合组)和单纯TACE治疗。联合组在首次TACE前2~3周接受索拉非尼400 mg/d, 在每次TACE治疗前和治疗后均停用2天, 索拉非尼如可耐受, 可逐步提升至800 mg/d; 如800 mg/d不可耐受, 可降至400 mg/d或400 mg/qod; 如仍无法耐受, 则考虑暂停使用索拉非尼或永久停药, 研究流程见图1。
单纯TACE组化疗药物:表柔比星或米铂(具体药物及剂量由各研究中心决定, 但重复TACE术时需相同), 栓塞剂Gelpart碘油; 对于超大肿瘤, 可分次行TACE; 首次TACE后4周行影像复查, 如活性病灶> 基线50%, 建议再次TACE, 且在首次TACE后4~6周完成; 新发病灶> 10 mm, 是否再次TACE取决于静脉期是否洗脱。
• 疗效评价:本研究的疗效评价基于肝癌疗效评价标准(Response Evaluation Criteria in Cancer of the Liver, RECICL):完全缓解(complete response, CR):结节内完全碘油沉积; 部分缓解(partial response, PR):结节内50%~100%的碘油沉积; 疾病稳定(stable disease, SD):介于PR及PD之间; 疾病进展(progressive disease, PD):①TACE特异性进展[untreatable (unTACEable) progression]:肝内肿瘤与基线相比增加25%; 肝功能恶化至Child-Pugh C级, 包括腹水不可控或肝功能失代偿; 血管侵犯; 肝外转移(肿瘤> 10 mm); 肝内新病灶不认为是疾病进展; ②日本肝病学会(Japan Society of Hepatology, JSH)定义的TACE抵抗:两次及更多次数的TACE后肿瘤活性病灶仍> 基线50%或肝内肿瘤数量持续增加。
• 研究终点:主要研究终点指标包括无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)。次要研究终点指标包括至无法治疗/无法TACE的进展时间[time to untreatable (unTACEable) progression, TTUP]、至进展时间(time to progression, TTP), 初次TACE治疗后的客观缓解率(objective response rate, ORR); AFP、AFP-L3和PIVKA-Ⅱ 和安全性等。
共148例患者进行并最终完成了研究, 其中联合组77例, 单独TACE组71例。在联合组中, 只有52.5%(42/80)的患者能耐受剂量800 mg/d的索拉非尼, 索拉非尼的中位实际日剂量为 355.2 mg。
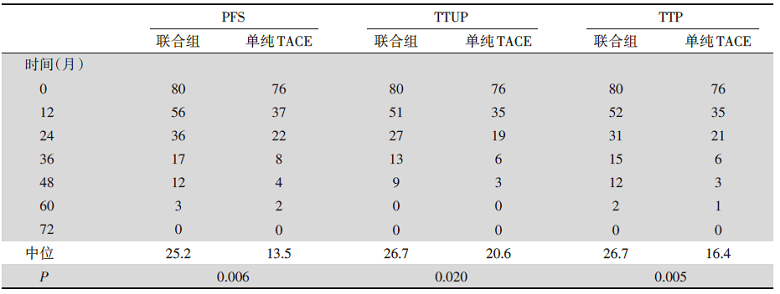
联合组的TACE中位间隔时间显著长于单纯TACE组(21.1周 vs. 16.9周, P=0.018), 联合组的中位PFS(25.2个月 vs. 13.5个月, P=0.006)、中位TTUP(26.7 个月vs. 20.6个月, P=0.02)、中位TTP(26.7个月 vs. 16.4个月, P=0.005)均显著长于单独TACE组。联合组和单独TACE组1年和2年的OS分别为96.2%和82.7%, 77.2%和64.6%。因2017年11月2日研究截止, 125个OS事件中只有92个(73.6%)成熟, 中位OS未获得, 见表1。
| 表1 TACE联合索拉非尼组和单独TACE组的中位PFS、TTUP和TTP |
亚组分析中表明, TACE联合索拉非尼治疗的所有亚组中, 基于TTUP的PFS比单独TACE治疗的时间更长。在首次TACE治疗4周后, 在肿瘤反应、疾病控制率和ORR上, 联合组与单独TACE组相似, 无显著差别。
联合组和单独TACE组的进展模式和频率无显著差异。然而, 在考虑事件发生时间的分析中, 联合组的微血管浸润(microvascular invasion, MVI)时间(31.3个月 vs. 4.0个月, P=0.008)和肝外转移(extrahepatic spread, EHS)时间(15.7个月 vs. 6.9个月, P=0.006)均明显长于单独TACE组。联合组的分期进展时间(定义为MVI和/或EHS的出现)也明显长于单独TACE组(22.5个月 vs. 6.3个月, P=0.001)。
安全性分析上, 许多不良反应在联合组比单独TACE组更为常见, 可能主要由索拉非尼所致。更常见的不良反应包括手足皮肤反应(53.2% vs. 0%)、高血压(51.9% vs. 39.4%)、脂肪酶升高(49.4% vs. 25.4%)、疲劳(24.7% vs. 9.9%)、腹泻(14.3% vs. 0%)、多形性红斑(11.7% vs. 0%)、体质量减轻(11.7% vs. 2.8%)等。
在无血管侵犯且无远处转移的不能切除HCC患者中, 相比单独TACE, TACE联合索拉非尼可阻止中晚期HCC进展, 进而显著改善PFS, 且其安全性可控。
不可切除的HCC因其无法达到R0手术切除, 而导致相对不良的预后。近年来, 微创介入治疗技术(如TACE、肝动脉灌注化疗、消融治疗、粒子植入等)、靶向治疗(如索拉非尼、仑伐替尼、贝伐珠单抗、阿帕替尼等)及免疫治疗(帕博利珠单抗、阿特珠单抗、卡瑞利珠单抗等)药物的不断发展, 为不可切除的HCC患者的预后改善提供了重要保障。然而, 在不可切除的HCC患者中, 单一治疗措施的疗效是有限的, 如何联合不同治疗措施以达到最佳疗效是目前探索的热点。
根据NCCN指南[1], TACE是BCLC分期B期HCC的标准治疗方案, 索拉非尼是BCLC分期C期HCC的标准治疗方案之一。尽管目前一些高质量的临床研究报道了TACE联合索拉非尼在不可切除的HCC的探索结果, 但结论存在争议[2, 3, 4, 5, 6, 7]。近期, Kudo等[8]总结了这些研究成功及失败的经验, 进行了一项TACTICS研究。该研究改变了TACE与索拉非尼的联合策略及主要研究终点的评价标准, 其结论为TACE联合索拉非尼治疗不可切除HCC的疗效显著优于单纯TACE。尽管该研究的结论令人鼓舞, 但索拉非尼联合TACE在不可切除HCC的确切疗效仍需理性看待。
第一, 本研究的PFS与OS是否存在显著及强相关性值得进一步研究。该研究将PFS定义为随机化至TACE特异性进展、JSH定义的TACE抵抗或任何原因导致的死亡的时间间隔。其中, TACE特异性进展评价基于RECICL标准, 但肝内新病灶不认为PD。尽管肝内出现新病灶可能与HCC的多中心起源的生物学特征有关, 但这也提示出现新病灶的HCC患者的肝硬化存在时间更长、肝硬化结节更易恶变或储备肝功能相对不足等, 而这些不良因素往往和患者更短的OS的显著相关。而且, 肝内出现的新病灶数量、大小、分化程度、是否有微血管侵犯、位置等均可能与患者预后显著相关, 而作者并未对这些新增病灶的情况进行精确的描述, 因此, 肝内新病灶不认为PD是值得商榷的。
第二, TACE与索拉非尼的联合策略的改变是否能显著延长OS也值得商榷。本研究在首次TACE术前2~3周开始服用索拉非尼, 其目的为确认耐受索拉非尼的患者、TACE术前正常化肿瘤新生血管以及抑制TACE术后产生的VEGF水平。然而, 该研究并未在使用索拉非尼前对患者肿瘤新生血管情况进行评估, 因此无法确认患者使用2~3周索拉非尼后能否正常化肿瘤新生血管。此外, TACE术前与术后使用索拉非尼抑制TACE术后VEGF水平的差异有待于进一步研究。因此, TACE术前及术后服用索拉非尼是否显著影响HCC患者预后有待于高质量的头对头随机对照研究确认。
第三, 尽管该研究表明:在按需TACE期间, TACE联合索拉非尼组的中位TACE间隔明显长于单纯TACE组(21.1周vs. 16.9周, P=0.018), 但两组因治疗导致的肝功能恶化并无显著差异(2/80 vs. 2/76)。因此, 索拉非尼带来的TACE间隔显著延长能否使患者的OS获益也值得进一步探讨。实际上, 精细TACE也可延缓储备肝功能恶化, 且能及时杀伤肿瘤组织, 因此, 未来将按需TACE及精细TACE有机结合可能进一步改善HCC患者的预后。
第四, 本研究纳入的人群特点为:HBV感染(12/156, 7.7%)、Child-Pugh分级A级(150/156, 96.2%)、肿瘤最大直径不超过10 cm、最大结节数为10个、无血管侵犯、无肝外转移的HCC患者, 这种人群分布特点显然不符合我国国情, 因此, 该结论的推广应用需在我国进行严格的验证, 切不可盲目照搬。
因此, 尽管TACE联合索拉非尼改善不可切除的HCC疗效具有较大潜能, 但TACE与索拉非尼如何有效地联合, 包括联合的顺序、时间间隔、周期、索拉非尼的最佳剂量、按需TACE与精细TACE的标准及时机等, TACE与索拉非尼的适用人群以及与OS显著强相关的主要研究终点以及其有效评价标准均值得进一步探索。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|