作者简介:
朱瑞云(1993-),女,广东汕头人,护师,医学硕士(护理学专业),主要研究方向为肿瘤护理。
目的 分析肺癌患者术后并发肺部感染(postoperative pulmonary infection in patients with lung cancer,PPILC)的危险因素。方法 回顾性分析中山大学肿瘤防治中心2018年1-12月收治的472例行肺癌手术患者的资料,包括临床基本资料和实验室检查结果等,应用单因素分析和logistic回归分析患者术后并发肺部感染的风险因素。结果 10.6%的肺癌患者术后并发肺部感染;多因素分析结果显示:术前存在肺通气功能障碍、手术时间长、术后3天内需予辅助吸痰、行二次手术、氧分压低是患者术后并发肺部感染的独立危险因素( P<0.05)。结论 医护人员应重点关注合并以上危险因素患者术后肺部感染的防治,尽早干预改善患者肺功能、咳痰能力等,以期改善患者预后。
Objective To analyze the risk factors of postoperative pulmonary infection in patients with lung cancer (PPILC).Methods A total of 472 patients who underwent lung cancer resection in January to December 2018 in Sun Yat -sen University Cancer Center were surveyed retrospectively, and a self-designed questionnaire was used to collect their clinical basic data and laboratory examination results. Univariate analysis and logistic regression were used to analyze the risk factors of postoperative pulmonary infection in patients with lung cancer.Results The incidence rate of postoperative pulmonary infection was 10.6%. The results of multivariate analysis showed that needed to be assisted sputum suction, needed re-operation, low postoperative PaO2 within 72 hours after operation, longer length of operation and preoperative pulmonary ventilation dysfunction, were the main factors affecting postoperative pulmonary infection ( P<0.05).Conclusions Doctors and nurses should pay more attention to the prevention and treatment of postoperative pulmonary infection in patients with these risk factors and improve their pulmonary function and coughing ability, so as to improve their prognosis.
肺癌是起源于气管、支气管粘膜或腺体的肺部原发性恶性肿瘤, 根据国家癌症中心最新发布的中国癌症统计数据[1], 肺癌居恶性肿瘤发病率和死亡率的首位, 发病占所有恶性肿瘤的20.03%, 死亡率占恶性肿瘤死亡率26.99%。目前, 手术是肺癌首选和最主要的治疗手段。然而, 手术给患者机体产生较大影响, 降低患者免疫力, 增加了患者肺部并发症的发生率, 研究报道胸部手术后肺部并发症的发生率达19%~59%[2], 肺部感染是其中最常见的并发症之一。目前, 不同研究结果显示的肺癌患者术后并发肺部感染(postoperative pulmonary infection in patients with lung cancer, PPILC)的发生率差异较大, 为2.2%~31.7%[3, 4]。肺部感染是导致患者住院时间延长、医疗费用增加、再次住院率和远期死亡率升高等的重要原因[5, 6, 7, 8]。一旦发现或处理不及时, 更不利于患者的预后, 甚至出现更严重的并发症, 因此, 早期甄别术后肺部感染的发生具有重要意义。本研究调查472例行肺癌手术的患者, 分析肺癌患者术后并发肺部感染的危险因素, 以期为医护人员早期识别术后并发肺部感染的肺癌患者提供参考依据, 有助于及早地对患者进行干预治疗和护理, 改善患者预后。
选取2018年1-12月在中山大学肿瘤防治中心行肺癌手术的患者作为研究对象。纳入标准包括:≥ 18岁; 病理诊断为肺恶性肿瘤; 行胸腔镜或开胸术。排除标准包括:手术前存在感染或处于感染潜伏期; 其他恶性肿瘤肺转移到肺部者。本研究在482例肺癌患者中排除10例不符合标准的患者, 最终纳入患者472例。
本研究为一项回顾性研究, 通过查阅电子病历系统收集患者相关资料。采用自行设计的资料收集表对数据进行收集, 内容包括患者的一般资料, 包括性别、年龄、体质量指数(body mass index, BMI)、吸烟史; 疾病相关资料, 包括呼吸系统疾病史、肿瘤治疗史、病理类型和分期; 围手术期的实验室检查结果, 包括术前和术后72 h内的氧分压(alveolar arterial oxygen pressure, PaO2)、二氧化碳分压(partial pressure of carbon dioxide in artery, PaCO2)、血红蛋白含量、氧合指数、乳酸、C反应蛋白(C reactive protein, CRP); 术前肺功能检查, 包括用力肺活量(forced vital capacity, FVC)[%预测值(prediction, pred)]、第一秒用力呼气量(forced expiratory volume in one second, FEV1)(%pred)、FEV1/FVC、最大呼气流量(peak expiratory flow, PEF)(%pred)、最大呼气中期流量(maximal mid-expiratory flow, MMEF)(%pred)、最大自主通气量(maximal voluntary ventilation, MVV)、肺一氧化碳弥散量(diffusion capacity for carbon monoxide of the lung, DLCOc)(%pred)、每升肺泡容积一氧化碳弥散量(diffusion capacity for carbon monoxide per liter of alveolar volume, KCOc)(%pred); 手术相关情况, 包括手术方式、切除范围、手术时长、术中出血量、是否二次手术; 术后护理和治疗情况, 包括术后当天引流量、是否行肺功能锻炼、辅助吸痰。其中患者肿瘤治疗史包括化疗史、放疗史、靶向治疗史、免疫治疗史和综合治疗。
术后肺部感染的诊断采用中国人民共和国卫生行业标准(WS 382-2012)[9]:肺炎诊断, 该标准于2013-02-01实施。医院获得性肺炎诊断标准需同时满足以下三条:(1)至少行两次胸片检查(对无心、肺基础疾病, 如呼吸窘迫综合症、支气管肺发育不良、肺水肿、慢性阻塞性肺疾病或充血性心力衰竭等的患者, 可行一次胸片检查), 并至少符合以下一项:新出现或进行性发展且持续存在的肺部浸润阴影、实变或空洞形成。(2)至少符合以下一项:(a)发热(体温> 38℃)且无其他明确原因; (b)外周血WBC> 12× 109/L或< 4× 109/L; (c)年龄≥ 70岁的老年人没有其他明确原因而出现神志改变。(3)至少符合以下两项:(a)新出现的脓痰或痰的性状发生变化, 或呼吸道分泌物增多, 或需要吸痰次数增多; (b)新出现的咳嗽、呼吸困难或呼吸频率加快, 或原有的咳嗽、呼吸困难或呼吸急促加重; (c)肺部啰音或支气管呼吸音; (d)气体交换情况恶化, 氧需求量增加或需要机械通气支持。
采用SPSS 21.0软件进行统计分析, 采用均值填补法对缺失值< 10%的连续型变量进行填补, 其余缺失值不做处理。计量资料采用均数± 标准差表示, 计数资料采用频数和百分比表示。单因素分析中, 计量资料且符合正态分布采用t检验, 非正态分布采用秩和检验, 计数资料采用卡方检验。将单因素分析中具有统计学意义的变量纳入多因素logistic回归进行分析。P< 0.05表示差异具有统计学意义。
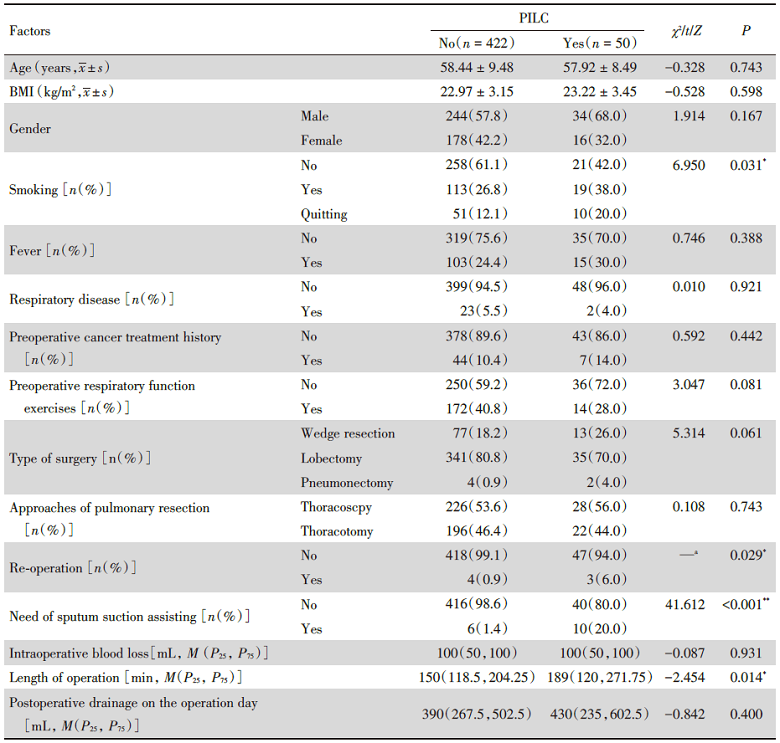
472例肺癌患者中有50例诊断为PPILC, 发生率为10.6%。472例患者的一般资料见表1。
| 表1 患者一般资料 Tab.1 Patient demographic characteristics |
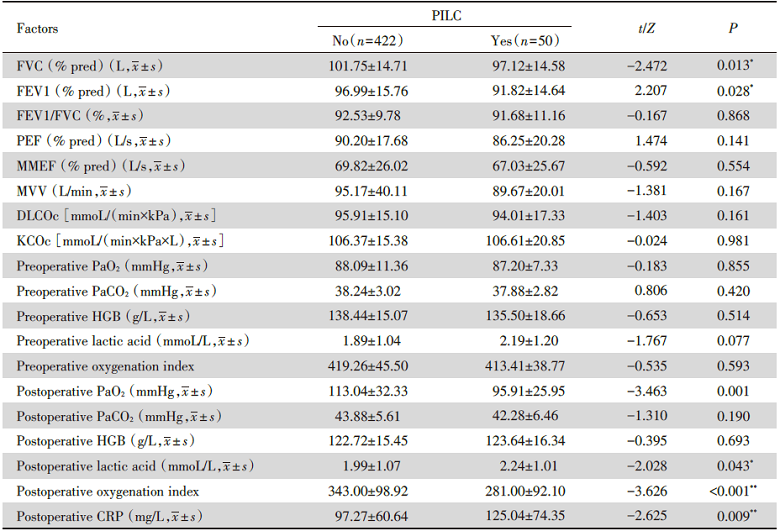
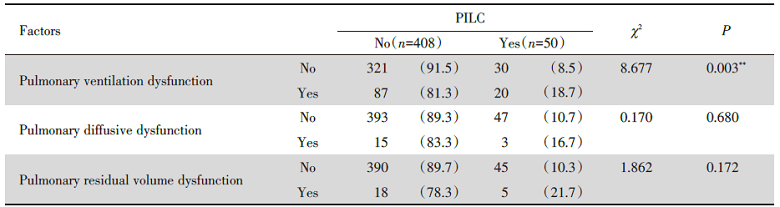
单因素分析结果显示, 吸烟、二次手术、辅助吸痰、手术时长(min)、FVC(%pred)、FEV1(%pred)、术后PaO2、术后乳酸、术后氧合指数、术后CRP、肺通气功能障碍等指标不同的患者其是否发生PPILC的差异具有统计学意义(P< 0.05), 具体见表2~表4。
| 表2 肺癌患者基本情况和手术相关情况对术后并发肺部感染影响的单因素分析 Tab.2 Single factor analysis of the influence of demographic characteristic and operation-related factors on PPILC |
| 表3 术前肺功能指标和术前、术后血气分析结果对术后并发肺部感染影响的单因素分析 Tab.3 Single factor analysis of the influence of preoperative pulmonary function, preoperative and postoperative arterial blood gas analysis on PPILC |
| 表4 肺癌患者术前肺功能情况对术后并发肺部感染影响的单因素分析 Tab.4 Single factor analysis of the influence of preoperative pulmonary function on PPILC |
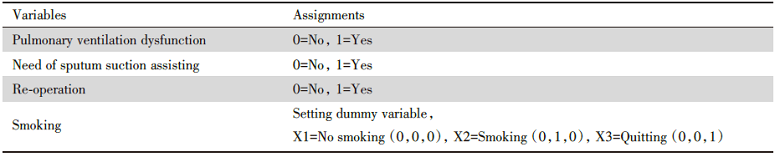
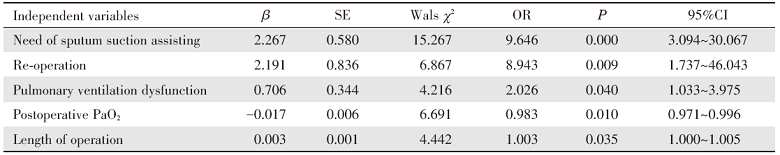
以是否发生PPILC为因变量, 将单因素分析具有统计学意义的变量作为自变量纳入二元logistic回归分析, 其中分类变量进入回归模型的赋值具体见表5。最终结果显示, 需辅助吸痰、二次手术、手术时长、肺通气功能障碍和术后PaO2是PPILC的独立影响因素(表6)。
| 表5 变量赋值表 Tab.5 Categorical variable assignment table |
| 表6 肺癌术后并发肺部感染的多因素logistics回归分析 Tab.6 Multivariate logistic regression analysis of PPILC Independent variables |
本研究结果显示PPILC发生率为10.6%, 高于王庆华等[10]研究显示的7.5%, 低于张宇星等[11]针对老年肺癌患者研究结果显示的46.1%, 这可能与不同研究对术后并发肺部感染的诊断标准不一致有关。已有专家指出由于对术后肺部感染的定义不一致, 不同研究结果显示的肺炎发生率差异较大[4]。再者, 本研究中, 老年患者占50.8%(表1), 而肺癌是增龄相关疾病, 老年患者身体条件、免疫力等较差, 故PPICL的发生率较高[12]。PPILC可致使病情恶化, 增加患者死亡风险, 影响预后。因此, 有效预防和早期识别患者术后并发感染极为关健。
3.2.1 辅助吸痰 辅助吸痰是指患者由于自身排痰困难, 需由医务人员使用吸痰装置予以辅助吸痰, 本研究显示术后需辅助吸痰患者是PPILC的独立危险因素(OR=9.646, P< 0.001)。肺癌术后疼痛、咳嗽无力、年老体弱是进行辅助吸痰最主要的适应证, 疼痛让患者对咳嗽有抵触和恐惧情绪, 下意识控制咳痰的动作, 导致呼吸道分泌物不能及时排出, 是影响术后康复和引起并发症的危险因素, 若围手术期给予及时疼痛评分和充分止痛则可减少患者的应激反应[13]; 术后咳嗽无力, 排痰不畅伴随肺不张的出现, 诱发PPILC; 高龄患者机体各器官出现退行性变化, 气道纤毛清除功能和咳嗽排痰能力降低[11], 术后需行辅助吸痰。对于医护人员来说, 提高患者术后的咳嗽咳痰能力显得尤为重要。杨梅等[14]的研究表明术前开始对老年肺癌患者进行提高自我效能的主动呼吸循环锻炼可以改善患者的咳嗽能力和排痰效果, 提示医护人员可早期针对咳嗽无力患者进行干预, 改善患者的咳嗽能力或术后排痰效果, 从而减少辅助吸痰的需求和肺部感染。另外, 本研究中辅助吸痰患者包含一部分术后3天内使用呼吸机辅助通气的患者, 不能排除由此导致的呼吸机肺炎也是本研究中PPILC的构成部分。
3.2.2 二次手术 本研究中二次手术的界定是肺癌手术后24小时内再次行手术, 行二次手术的主要原因是患者手术部位出血予再次剖胸探查止血。本研究结果显示行二次手术患者发生PPILC的风险是无需行二次手术患者的8.943倍(OR=8.943, P=0.009)。出血导致血红蛋白和球蛋白降低, 机体抵抗力下降, 继发感染的风险增加。本研究中, 二次手术患者再次使用静脉麻醉加吸入麻醉的复合麻醉方式, 而地氟醚、七氟醚麻醉药吸入由肺泡摄取进入循环系统经肺脏或肝脏代谢, 且可降低老年患者术中红细胞的免疫功能, 使促炎性因子肿瘤坏死因子α (tumor necrosis factor α , TNF-α )、白细胞介素6(interleukin 6, IL-6)和IL-1β 的水平升高[15], 可能是PPILC发生的原因。且二次手术属于侵入性操作, 增加了肺部伤口暴露时间; 同时二次手术的患者经历两次气管插管, 使呼吸道防御功能下降, 呼吸道粘膜受损, 细菌侵入并滋生繁殖, 更容易发生肺部感染; 手术中使用单肺通气使手术侧肺叶完全塌陷, 手术视野好, 便于操作, 但术侧肺长时间处于无通气及血液供应不足状态增加了术后急性肺损伤的机率, 提高了PPILC的发生风险[10]。
3.2.3 手术时长 本研究中, PPILC发生组的手术时长(226.96± 151.19)min较非PPILC组(174.27± 93.69)min时间长, 差异具有统计学意义(P< 0.05)。手术时间的延长增加了术野的暴露时间, 对肺组织反复挤压和揉捏的次数增加, 污染概率增加; 长时间手术使术中健侧肺较长时间过度通气和通气-血流比例失调, 可使患侧肺萎缩和肺泡术后不易复张, 使PPILC发生的风险增加。手术时间延长, 往往意味着手术难度增大, 机体侵入性操作增多, 加重感染风险。这与其他研究[10]报道的结果一致。
3.2.4 肺通气功能障碍 本研究多因素分析结果显示肺通气功能障碍是PPILC的独立危险因素, 单因素分析中同时显示FVC%(pred)和FEV1%(pred)与PPILC的发生有关(P< 0.05)。FVC%(pred)和FEV1%(pred)均是反映肺通气功能的重要指标, 当FVC%(pred)和FEV1%(pred)值较低时, 提示患者呼气功能较差, 可能痰液咳出困难, 而痰液淤积导致PPILC发生。既往的研究亦表明术前肺功能降低是术后肺部并发症发生的主要因素, 其对预测并发症的发生具有积极意义[8, 16]。同时, 肺癌患者因肿瘤占位切除后导致肺脏体积变小, 肿瘤累及胸膜引起胸膜增厚或黏连导致胸廓活动受限, 肺气肿、肺大泡病史等诸多因素导致手术后呼吸功能的进一步恶化, 增加PPILC的风险。提示医护人员应该重点关注术前已存在肺功能通气障碍的患者。本研究中, FVC%(pred)、FEV1%(pred)两个指标和肺通气功能障碍存在共线性, 对比发现肺通气功能障碍这一指标进行拟合回归模型效果更好, 考虑是由于这一变量能更全面地反映患者整体的肺通气功能情况。
3.2.5 术后PaO2 氧分压和低血氧饱和度被认为是判断术后肺炎非常重要的诊断因子[17]。本研究结果显示患者术后PaO2越低, PPILC的发生率越高(OR=0.983, P=0.010)。当肺癌术后发生肺不张或炎症等因素导致肺泡渗入液体, 造成肺泡无通气, 动脉血中氧含量整体下降; 当术后动脉血中PaO2低于60 mmHg, 可引起组织和器官的无氧代谢, 造成细胞受损, 尤其是急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)发生时, 肺内皮细胞和Ⅰ 型肺泡细胞严重受损, 增加PPILC的风险。本组资料中, 术后PaO2低的情况多为低氧性缺氧、循环性缺氧、贫血性缺氧, 引起肺泡通气不足、通气-血流比例失调和肺内分流, 从而增加PPILC的发生风险。因此, 医护人员应该重点关注术后3天内PaO2持续性低的患者, 警惕PPILC的发生。
本研究通过回顾性收集472肺癌患者的相关资料, 分析了肺癌术后患者出现肺部并发感染的主要风险因素包括术前肺通气功能障碍、术后3天内需辅助吸痰、行二次手术、手术时间长、PaO2低, 临床上医护人员应该加强关注合并上述危险因素的肺癌患者, 给予合理有效的预防性治疗, 并做到早期诊断和及时治疗存在肺部感染的患者, 以减少肺部感染的发生和改善患者预后。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|