作者简介:
陆勤(1969-),女,江苏宜兴人,主管护师,护理学士,主要研究方向为肝癌发生发展机制。
目的 研究尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator,uPA)在原发性肝癌中的表达水平及其与临床病理特征的相关性。方法 收集48例原发性肝细胞癌的组织及其相邻的癌旁相对正常组织,用荧光定量聚合酶链式反应方法(quantitative real-time polymerase chain reaction,QRT-PCR)检测uPA在原发性肝癌组织及其相邻正常组织中的信使RNA(messenger RNA,mRNA)表达情况,分析uPA表达与原发性肝癌患者临床病理特征及系统炎症指标的相关性,包括系统性免疫炎症指数(systemic immune inflammation index,SII)、中性粒细胞-淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet-to-lymphocyte ratio,PLR),进一步行体外功能实验,研究uPA对肝癌细胞迁移和侵袭能力的影响。结果 在48例原发性肝癌组织中,uPA在27例原发性肝癌中表达上调( P<0.01),且uPA高表达与原发性肝癌的包膜不完整及复发转移相关( P<0.05),并与肿瘤大小成正相关( P=0.011)。我们还发现uPA表达水平与肝癌系统炎症指标(NLR,PLR,SII)相关,在体外迁移和侵袭实验中,我们发现uPA可促进肝癌细胞的迁移和侵袭。结论 uPA可能作为评估原发性肝癌细胞迁移和侵袭潜能的指标。
Objective To investigate the expression of urokinase-type plasminogen activator (uPA) and characterize the association between uPA and tumor metastasis in hepatocellular carcinoma.Methods We collected 48 primary hepatocellular carcinoma (HCC) tissues and their adjacent normal tissues. Quantitative real-time polymerase chain reaction (QRT-PCR) was performed to detect the messenger RNA (mRNA) expression of uPA in primary HCC, and then analyzed the correlation between uPA expression and clinicopathological features and systemic inflammatory indicators of primary HCC, including systemic immune inflammation index (SII), neutrophil-to-lymphocyte ratio (NLR) and platelet-to-lymphocyte ratio (PLR). Further in vitro experiments performed to study the effect of uPA on migration and invasion.Results uPA was up-regulated in 27 of 48 HCC tissues ( P<0.01) and uPA expression was associated with incomplete envelope, recurrence and metastasis of HCC ( P<0.05). uPA expression was positively correlated with tumor size ( P=0.011). We also found that the expression level of uPA was correlated with HCC systemic inflammatory indicators (NLR, PLR, SII). Furthermore, we found that uPA can promote the migration and invasion of HCC cells in vitro.Conclusions uPA could be a clinical marker for the migration and invasion of HCC cells.
肝细胞癌(hepatocellular carcinoma, HCC)是原发性肝癌中最常见的类型, 也是导致癌症患者死亡的最常见恶性肿瘤之一[1]。近年来, 我国肝癌发病率呈上升趋势, 其恶性程度较高、病程发展快, 其发病率和死亡率分列第三位和第二位[2]。早期肝癌的治疗以手术治疗为主, 其他治疗方式还包括介入治疗、放射治疗。约66%的肝癌患者初诊时已处于中晚期, 失去手术机会。因此, 晚期肝癌患者的治疗及预后评估尤为重要。近年来晚期肝癌的免疫及靶向治疗取得较大进展, 但患者的预后生存仍较差[3]。探究肝癌的发生发展的分子机制并寻找新的分子预后指标对于提高早期诊断及评估预后具有重要的临床意义。
肿瘤的侵袭和转移是肿瘤预后不良的重要原因, 肿瘤转移是一个复杂而漫长的过程, 其中穿越基底膜是肿瘤转移的必经过程, 基底膜对肿瘤细胞具有“ 限制性屏障作用” , 限制肿瘤细胞的转移和侵袭[4]。细胞外蛋白水解酶在细胞外基质的重塑过程中发挥重要作用, 细胞外蛋白水解酶主要包括基质金属蛋白酶和丝氨酸蛋白酶两大类, 通过重塑细胞外基质, 促进肿瘤细胞侵袭和转移[5]。尿激酶型纤溶酶原激活物(urokinase typeplasminogen activator, uPA)是重要的丝氨酸蛋白酶, 对纤溶酶原活性起重要调控作用[6]。uPA通过与细胞膜表面的尿激酶型纤溶酶原激活物受体(urokinase type plasminogen activator receptor, uPAR)结合后被激活, 活化的uPA将纤溶酶原激活为纤溶酶, 促进基质金属蛋白酶等细胞外基质内相关成分的降解, 促进肿瘤细胞的侵袭、转移[7]。
研究报道uPA在恶性乳腺癌、结直肠癌、宫颈癌等多种肿瘤细胞中表达上调, 并且与其侵袭转移密切相关[8, 9, 10]。另外还有研究报道uPA除了激活细胞外基质降解途径外, 还可通过胞内途径与uPAR结合后激活细胞Raf、Src、ERK、MAPK、FAK等肿瘤相关信号通路, 促进肿瘤细胞侵袭转移[11, 12, 13]。uPA还可通过与Notch受体结合, 激活Notch信号通路活性, 增加脑胶质瘤的侵袭性[14]。uPA在肿瘤转移中扮演重要角色, 可能会成为一个重要的潜在分子治疗靶标, 但其在肝癌中的表达情况和作用机制研究较少。
在本研究中我们检测了uPA在原发性肝癌中的表达情况, 并分析了其与临床病理特征及肝癌系统炎症指标的相关性, 进一步在体外功能实验中研究其对HCC迁移和侵袭能力的影响。我们将着重探讨uPA在HCC中的表达及其与肝癌细胞的迁移和侵袭的相关性。
组织标本来源为广州医科大学附属肿瘤医院2016-2020年间手术切除且病理确诊的48例原发性肝癌病例。每例病例采集两块样本, 一块为取自肝癌病灶的肿瘤组织, 另一块为离肿瘤切缘3 cm以外的相对正常癌旁组织, 癌旁组织镜下无肿瘤细胞。48例原发性肝癌患者术前均未接受过放射治疗和化学治疗。其中男性25例, 女性23例, 年龄27~77岁, 中位年龄45岁。所有病例中包膜完整31例, 包膜不完整17例。发生复发或转移22例, 没有发生复发或转移26例。有癌栓形成30例, 无癌栓形成18例。发生淋巴结转移19例, 其余29例无淋巴结转移, 癌的分级根据世界卫生组织分级标准。手术切除标本包括癌组织和癌旁组织, 迅速置于冻存管中于-80℃液氮储存。所有手术标本及病例资料均通过广州医科大学附属肿瘤医院伦理委员会批准同意使用。
用总RNA提取试剂盒TRIZOL提取肝癌组织及癌旁组织的总RNA, 取少量冻存组织加入1 mL Trizol(Invitrogen), 根据提取组织总RNA的标准操作步骤, 经匀浆、分层、洗涤等步骤, 用电动匀浆器将组织充分匀浆1~2 min; 经过相的分离、RNA沉淀、RNA洗涤, 用DNaseⅠ 酶去除基因组DNA, 并将沉淀溶于相应体积的无RNase酶水中, 用紫外分光光度计测吸光度值, 根据测得的OD值计算所获RNA含量, 测定RNA纯度和浓度, 使用Prime Script RT试剂盒(Promega, Madison, WI, USA)按其操作说明书进行反转录, 反转录所得的cDNA保存于-30℃ 冰箱中。
以样品cDNA为模板, 设计检测uPA的引物序列为:sense: 5′ -GCCATCCCGGACTATACAGA-3′ ; antisense:5′ -AGGCCATTCTCTTCCTTGGT-3′ , β -actin作为检测的内参。采用SYBR Green SuperMix(Roche, Basel, Switzerland)进行QRT-PCR检测, 扩增反应设置为40个循环数。应用ABI PRISM 7900 Sequence Detector(Applied Biosystems, Foster City, CA, USA)序列检测系统对反应产物进行定量检测和溶解曲线分析, 分别进行三次独立重复实验。以2-Δ Δ CT(Livak)法比较肝癌中uPA含量相对于癌旁相对正常肝组织和内参β -actin的变化, 对应的uPA表达水平以相应的倍数变化体现。
取对数生长期的肝癌细胞系8024细胞, 分为实验组和对照组两组, 用含0.1% FBS的DMEM培养基培养, 实验组在培养基中加入uPA重组蛋白(北京义翘神州生物技术有限公司), 于37 ℃、5% CO2培养箱中, 培养24 h。为了检测细胞的迁移和侵袭, 胰酶消化细胞, 1 000 rpm离心5 min, 用无血清DMEM培养基重悬细胞, 计数细胞并稀释至6× 104/0.2 mL, 将0.2 mL上述悬液加入上层不含基质的迁移室中(BD Biosciences, Flanklin Lakes, NJ), 下层孔中加入含10% FBS DMEM培养基作为引诱剂。培养24~48 h, 计算小室底部的膜上每个视野的迁移的细胞平均数。侵入试验采用Matrigel侵袭小室(BD Biosciences, Flanklin Lakes, NJ)进行, 步骤与迁移试验基本相似。两项实验分别独立重复三次。
系统性免疫炎症指数(systemic immune inflammation index, SII)定义为(血小板× 中性粒细胞)/淋巴细胞计数; 中性粒细胞-淋巴细胞比值(neutrophil-lymphocyte ratio, NLR)定义为外周血中性粒细胞与淋巴细胞绝对计数的比值; 血小板与淋巴细胞比值(platelet-to-lymphocyte ratio, PLR)定义为外周血中血小板与淋巴细胞绝对计数的比值。患者肝癌手术前7 d内无抑制和/或促进骨髓生长特殊治疗, 无肺部感染、尿路感染等感染性疾病。取肝癌患者手术治疗前1~7 d的血常规计算NLR、PLR、SII值。
采用SPSS 16.0软件进行统计学分析, 三个独立实验的结果以平均值± 标准差表示, 独立样本的t检验用于比较uPA在肝癌和癌旁组织中的差异表达。uPA表达与临床病理特征的关系采用χ 2检验分析。采用卡方检验(Pearson chi-square test)或精确概率法(Fisher's exact test)分析uPA表达与临床病理特征(包括病人年龄、性别、肿瘤大小、包膜完整性及复发转移情况等)和系统炎症指标之间的相关性。P< 0.05认为差异或相关性有统计学意义。
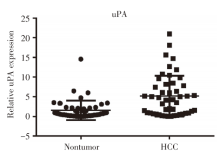
Δ CT进行定量分析, 我们在48对原发性肝癌组织样本及癌旁相对正常组织中运用荧光实时定量PCR方法检测uPA的表达, 对结果用Δ CT进行定量分析。与癌旁相对正常组织相比, uPA在27例原发性肝癌组织中表达上调, uPA在肝癌组织中的上调比例为56.3%(27/48)(P< 0.01, 图1)。uPA在肝癌中的相对表达量高于癌旁相对正常组织。
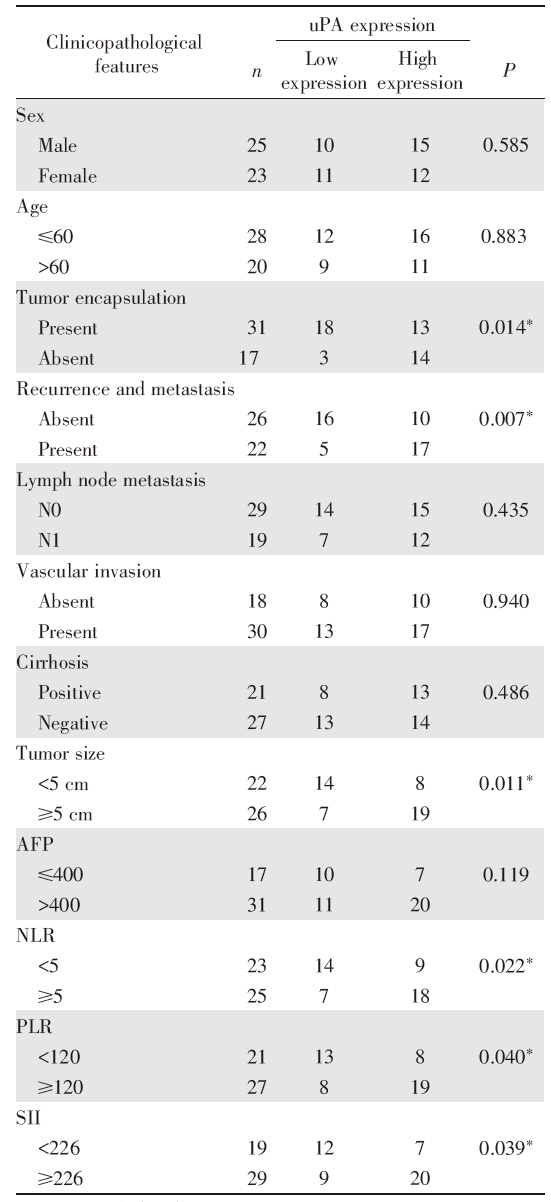
QRT-PCR结果显示uPA在原发性肝癌中表达上调, 我们根据uPA表达情况对肝癌临床病理特征进行相关性分析, 分析结果显示uPA表达与原发性肝癌患者肿瘤包膜不完整和复发和转移显著相关(P< 0.05), uPA在肿瘤包膜不完整的病例中的表达高于肿瘤包膜完整者(P=0.014), 且在复发和转移病例组中uPA表达更高(P=0.007), 同时发现uPA表达水平与肿瘤大小成正相关(P=0.011)。在与系统炎症指标的相关性分析中发现, uPA表达水平与患者的系统炎症指标NLR(P=0.022)、PLR(P=0.040)、SII(P=0.039)成正相关。卡方检验显示uPA高表达与患者年龄、性别、淋巴结转移、癌栓形成、肝硬化的相关性无统计学意义(P> 0.05), 见表1。
| 表1 uPA在肝癌组织中的表达与临床病理特征及系统炎症指标的相关性 Tab.1 Association of uPA expression with clinicopathological features and systemic inflammatory indicators in HCCs |
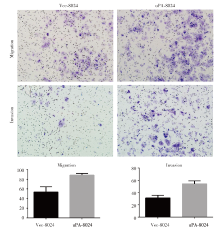
将肝癌细胞系8024细胞分为实验组和对照组两组, 实验组在培养基中加入uPA重组蛋白, 都用含0.1% FBS的DMEM培养基培养24 h, 在细胞迁移实验中, 我们将6× 104个细胞种到Transwell小室, 小室内培养液为不含FBS的DMEM, 下层培养液用含10% FBS的DMEM, 培养24~48 h, 染色计数, 显微镜下计算穿过小室膜的细胞数量。结果显示:培养基中加入uPA的肝癌细胞穿过PET膜的数量明显多于对照组, 说明uPA可在体外增加肝癌细胞的迁移能力(图2)。在细胞侵袭实验中, 培养基中加入uPA的肝癌细胞穿过PET膜的数量明显多于对照组细胞(P< 0.05)(图2), 说明uPA在体外促进肝癌细胞的侵袭。两组实验分别重复三次。
肝癌是严重威胁人类健康的恶性肿瘤, 其临床特点为高复发率和高肝内转移率, 预后很差[1]。早期肝癌的治疗以手术切除为主, 但术后复发率较高, 并且在初诊断患者当中, 大多数患者已失去根治性手术治疗的机会, 这是肝癌患者高死亡率的重要原因之一。大量研究表明早期诊断是提高肝癌治愈率与降低死亡率的最有效办法之一[3]。因此, 研究肝癌发生发展过程中相关分子机制, 发现与肝癌恶性进展程度、转移相关的肿瘤标志物十分重要, 这些分子标志物可能对肝癌的预后判断及治疗提供重要的临床价值。
u-PA是重要的丝氨酸蛋白酶, 近年来多项研究报道uPA在恶性肿瘤细胞中表达上调, 并且与乳腺癌、结直肠癌、宫颈癌等多种肿瘤的侵袭转移密切相关[8, 9, 10]。研究显示uPA与细胞膜表面的uPAR结合后被激活, 通过调控纤溶酶原活性激活基质金属蛋白酶, 从而促进细胞外基质成分的降解, 促进肿瘤的侵袭与转移[7]。多项研究显示uPA可通过调控多条与肿瘤侵袭转移相关的信号通路促进肿瘤细胞侵袭转移[11, 12, 13, 14], 说明uPA在肿瘤转移中扮演重要角色, 可能会成为一个重要的潜在分子治疗靶标。
我们研究发现uPA在原发性肝癌中表达明显高于癌旁相对正常组织, 这一结果与uPA在其他肿瘤如乳腺癌、结直肠癌、宫颈癌的高表达情况相似[9, 10, 11], 实验结果提示uPA高表达可能在原发性肝癌的发生和发展过程中扮演重要作用。为了进一步研究uPA在原发性肝癌中的作用, 我们根据uPA表达情况对其临床病理特征进行相关性分析, 结果显示uPA表达与原发性肝癌患者包膜不完整及复发转移显著相关, uPA在肝癌包膜不完整组中表达水平明显增高, 提示uPA表达越高, 其侵袭性越强。我们的研究还发现uPA高表达组患者更容易出现复发转移。在体外迁移和侵袭实验中, 我们发现uPA增强肝癌细胞的迁移和侵袭能力, 在这些数据提示, uPA在原发性肝癌的形成和进展过程中充当促进肿瘤侵袭和转移的重要角色, uPA参与肝癌发生和发展可能机制是:uPA与细胞膜表面的uPAR结合, 激活纤溶酶原的活性, 进而促进细胞外基质成分的降解, 促进肝癌的侵袭与转移; 或通过与uPAR结合, 激活胞内肿瘤转移相关信号通路包括Raf、Src、ERK、MAPK等促进肝癌细胞的侵袭和转移。但其在肝癌中的具体作用机制尚不清楚, 需要进一步的深入研究。
中性粒细胞-淋巴细胞比值(NLR)是一项常规外周血检测的简单炎症相关预后指标, 研究显示NLR升高与HCC术后更差的总生存相关, 研究发现NLR升高是预后差的独立危险因素[15], 关于NLR临界值的分析发现NLR≥ 5是术后无瘤生存的独立危险因素[16]。血小板与淋巴细胞比值(PLR)是另一个重要炎症反应指标, 近期研究发现PLR与肿瘤大小、肿瘤数目和血管侵犯的比例显著相关, 可作为预测HCC术后复发的预后因素。研究发现PLR≥ 120的患者预后较差, 且PLR≥ 120与患者无病生存期独立相关[17]。2014年, Hu[18]等研究发现系统免疫炎症指数(SII), 结合了外周血小板、中性粒细胞和淋巴细胞的综合预后评分系统, 相对于单个细胞类型的因子的预后评估作用更有效, 可预测肝癌根治性切除后患者的预后。SII更客观反映了宿主炎症和免疫状态的平衡。
我们相关性分析结果表明uPA表达水平与原发性肝癌患者NLR、PLR、SII水平呈正相关, uPA与NLR、PLR、SII结合, 可更好的预测患者预后。
综上, uPA在原发性肝癌组织中高表达, 且uPA水平与原发性肝癌细胞迁移侵袭及系统炎症指标相关, 可作为临床评估肝癌复发转移的新的分子标志, 为其成为新的分子治疗靶标奠定研究基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|