作者简介:
黄伟业(1987-),男,广东佛山人,病理技师,医学硕士,从事病理技术在肿瘤诊断中应用的研究。
目的 分析肺大细胞神经内分泌癌(large cell neuroendocrine lung carcinoma,LCNEC)中程序性死亡配体-1(programmed death ligand-1,PD-L1)的表达及其与预后的相关性,同时进行相关文献回顾。方法 回顾性收集2016年1月至2021年7月期间于广东省人民医院病理科诊断为LCNEC并行PD-L1检测的患者42例,同时收集患者PD-L1检测结果、临床病理特征和预后数据,分析患者的PD-L1表达以及与临床病理特征和预后的相关性。通过PubMed检索LCNEC中PD-L1表达的相关研究报道。结果 42例患者的中位年龄63岁,男性占85.7%,有吸烟史的患者占42.9%,手术切除标本占81%,标本中47.6%是纯大细胞神经内分泌癌,其余为复合性大细胞神经内分泌癌,复合成分为小细胞癌、腺癌或鳞癌。使用22C3或SP142抗体克隆行PD-L1检测,其中22C3抗体染色阳性率43.2%,SP142抗体阳性率60%,总体阳性率为45.2%。接受根治性手术的PD-L1阳性患者的无疾病生存期(disease-free survival,DFS)显著优于PD-L1阴性患者,然而整体的总生存期(overall survival,OS)未显示明显的差异。Cox回归分析显示PD-L1与DFS、OS均未见显著相关性。文献回顾11篇相关研究报道,共计713例病例,PD-L1表达的阳性率为10.4%~100%,免疫细胞的阳性率均高于肿瘤细胞,并且免疫细胞的阳性往往与更好的预后相关,而肿瘤细胞阳性在不同的研究中出现了相矛盾的预后相关性。结论 LCNEC患者中部分表达PD-L1,并且PD-L1阳性患者具有更长的DFS。
Objective To ascertain the expression of programmed death ligand-1 (PD-L1) on large cell neuroendocrine lung carcinoma (LCNEC), analysis its association with survival and review existing literatures.Methods Between January 2016 to July 2021, 42 LCNEC patients diagnosed at Department of pathology, Guangdong Provincial People's Hospital with PD-L1 detection were included. PD-L1 expression was analyzed by immunohistochemistry and the association of PD-L1 expression with clinicopathological characteristics and survival were performed. Previously published studies using PubMed search engine were reviewed.Results Forty-two cases of LCNECs were retrieved. Median age was 63 years with male preponderance (85.7%). Nearly half of patients (42.9%) were smoker. 81% of the specimens were from surgical resection. 47.6% were diagnosed with pure LCNECs and the others were combined LCNECs with small cell lung cancer, adenocarcinoma and squamous carcinoma. Immunostaining of PD-L1 was performed using clone 22C3 with the percentage positivity of 43.2% or SP142 with the percentage positivity of 60% and the overall percentage positivity was 45.2%. Patients with PD-L1 positive showed significantly longer disease-free survival (DFS) but not overall survival (OS) than those with PD-L1 negative, but in Cox regression analysis, PD-L1 was not associated with either DFS or OS. Eleven studies evaluating 713 LCNECs were reviewed. The percentage positivity varied from 10.4%~100%, which was higher in immune cells than that in tumor cells. Moreover, PD-L1 positivity in immune cells was associated with better prognosis, while the association of PD-L1 positivity in tumor cells with prognosis was still inconsistent.Conclusions PD-L1 positivity could be found in part of LCNECs, and DFS in patients with PD-L1 positive tends to be longer.
肺癌是当今世界上发病率和死亡率最高的恶性肿瘤之一, 严重危害人类健康[1, 2]。从病理类型上, 肺癌主要分为非小细胞肺癌(non-small cell lung cancer, NSCLC)与小细胞肺癌(small cell lung cancer, SCLC)两大类型, NSCLC约占原发性肺癌的85%, 其中肺大细胞神经内分泌癌(large cell neuroendocrine lung carcinoma, LCNEC)是NSCLC的亚型之一, 约占2%~3%。同时, 由于LCNEC起源于肺和支气管上皮内分泌细胞, 具有细胞大、胞浆丰富、核分裂像多见等特点, 2015年世界卫生组织(World Health Organization, WHO)又将LCNEC与SCLC统称为肺高级别神经内分泌癌[3]。因此, LCNEC既属于NSCLC又与SCLC存在诸多相同特性, 是一类独特的肺恶性肿瘤。
免疫治疗, 因其较好的疗效和安全性, 目前已被批准广泛用于NSCLC和SCLC。然而, 免疫治疗在LCNEC中的疗效仍未知, 相关数据只见于少量的个案报道和零星的回顾性研究[4, 5, 6, 7]。程序性死亡受体配体-1(programmed death ligand-1, PD-L1)是目前较公认的免疫标志物, 可以预测免疫治疗疗效。近年来, 越来越多研究发现PD-L1在多种肿瘤中与临床病理因素和免疫因子相关, 从而影响预后。由于肺LCNEC的发病率低, 其PD-L1的表达情况仍未知, PD-L1与预后的相关性也至今未明。
为分析PD-L1在肺LCNEC中的表达, 我们回顾性收集了广东省人民医院相关42例病例, 同时收集患者PD-L1检测结果、临床病理特征和预后数据, 并且进行文献回顾, 比较既往研究病例和本研究病例中的PD-L1表达以及与临床病理特征和预后的相关性。
回顾性收集2016年1月至2021年7月于广东省人民医院病理科诊断为纯肺LCNEC或复合性肺LCNEC的标本共42例, 接受PD-L1免疫组化检测, 从广东省人民医院电子病历系统获得以上患者的性别、年龄、病理、分期、治疗过程及生存时间等临床病理资料。
PD-L1 22C3免疫组化检测步骤:标本石蜡包埋、切片、烤片后, 用二甲苯Ⅰ 、Ⅱ 分别脱蜡10 min, 梯度乙醇至水, 然后将切片放入Dako公司PTLink抗原修复仪中(先将脱蜡抗原修复液预热至65℃)自动抗原修复97℃ 40 min, 抗原修复结束后蒸馏水漂洗, 然后将待检片放在免疫组织化学染色仪(Dako Autostainer Link 48)进行自动免疫组织化学染色, PD-L1 22C3抗体(Dako)室温孵育60 min, EnVision Flex+Linker室温孵育30 min, EnVision/HRP室温孵育30 min, 二氨基联苯胺显色5 min, 染色结束常规脱水、透明、封片[8]。
PD-L1 SP142免疫组化检测步骤:标本石蜡包埋、切片、烤片后, 将待检片放至免疫组织化学染色仪(Bench Mark ULTRA)进行全自动免疫组织化学染色, 72℃脱蜡10 min, ULTRA CC1修复液中自动修复100℃ 92 min, PD-L1 SP142抗体(VENTANA)37℃孵育32 min, OV HQ LINKR室温孵育12 min, MULTIMER/HRP室温孵育12 min, 使用Optiview扩增试剂盒染色, 结束后常规脱水、透明、封片。
PD-L1(22C3)抗体染色采用肿瘤细胞阳性比例分数(tumor proportion score, TPS)的计数方式(即只计数肿瘤细胞), 阳性肿瘤细胞计数方法及结果判读标准如下:计数的肿瘤细胞必须是活细胞, 肿瘤细胞数≥ 100个; 任何染色强度(强阳性、中等或弱阳性)的膜染色(包括完整和/或不完整膜阳性)均为阳性, 单纯胞质或胞核染色不能判为阳性染色; 阳性结果记录为具体的百分比(即所有阳性染色的肿瘤细胞占所有肿瘤细胞的百分比), PD-L1(22C3)的阈值为1%和50%:> 1%为阳性; < 1%为阴性; 1%~50%为低表达; > 50%为高表达。
PD-L1(SP142)抗体染色评估的包括两部分:第一部分是任何强度膜着色肿瘤细胞的百分比, 即肿瘤细胞(tumor cells, TC); 第二部分是肿瘤区域中的染色阳性免疫细胞所占面积的百分比, 即免疫细胞(immune cells, IC)。PD-L1的结果基于两部分的评估:TC< 1%和IC< 1%为阴性; TC≥ 1%或IC≥ 1%为阳性; TC≥ 50%或IC≥ 10%为高表达。
染色结果均由广东省人民医院病理科两位医师背靠背双盲判读。
使用卡方检验分析PD-L1表达与临床病理特征的相关性, 使用Kaplan-Meier方法和log-rank检测分析生存曲线, 使用单因素和多因素Cox回归分析各个因素与预后的相关性, 统计分析使用SPSS 20.0软件进行。P< 0.05认为有统计学意义。
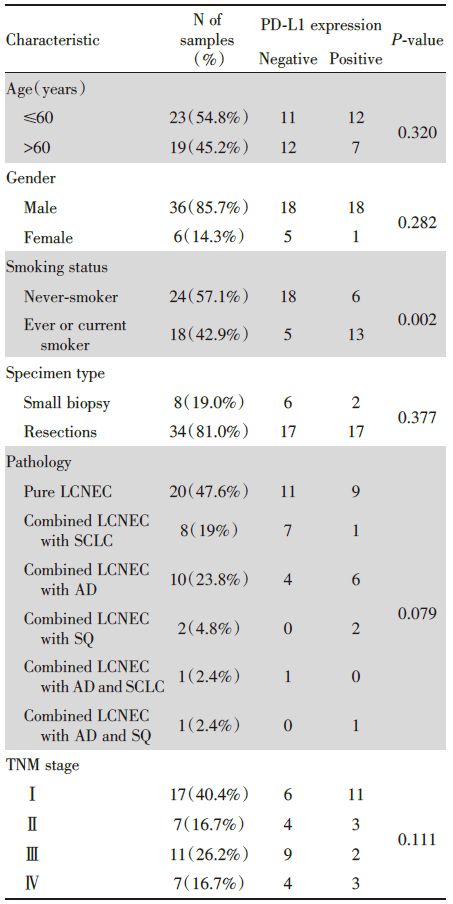
收集的42例LCNEC患者的临床病理特征见表1。中位年龄63岁, 男性占85.7%, 42.9%的患者有吸烟史, 81%的标本为手术切除标本, 标本中47.6%是纯大细胞神经内分泌癌, 其余为复合性大细胞神经内分泌癌, 复合成分为小细胞癌(small cell lung cancer, SCLC)、腺癌(adenocarcinoma, AD)或鳞癌(squamous carcinoma, SQ), 最常见的复合成分为腺癌。大部分患者的临床分期(tumor-node-metastasis, TNM)均为早中期。
| 表1 42例LCNEC患者的临床病理特征 Tab.1 Clinicopathological characteristics of 42 LCNECs |
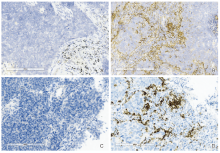
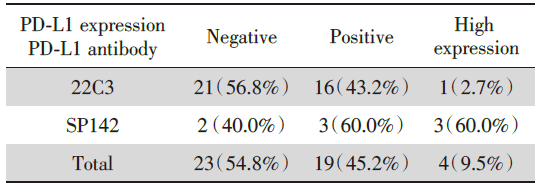
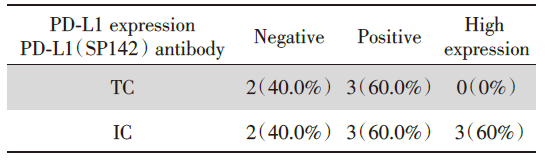
42例LCNEC患者标本进行PD-L1检测, 其中37例使用22C3抗体染色, 5例使用SP142抗体染色, 结果见于表2、表3。22C3抗体染色标本中, 21例阴性, 16例阳性, 阳性率43.2%, 其中1例为PD-L1高表达, 高表达率仅2.7%。SP142抗体染色标本中, 2例阴性, 3例阳性且均为PD-L1高表达, 阳性率60%。总体来说, PD-L1阳性率为45.2%, PD-L1高表达率9.5%。两种抗体的免疫组化代表图见图1。
| 表2 42例LCNEC患者的PD-L1表达水平 Tab.2 PD-L1 expression in 42 LCNECs |
| 表3 5例通过PD-L1(sp142)检测LCNEC患者的TC和IC的表达水平 Tab.3 PD-L1 (sp142) expression in 5 LCNECs of TC and IC |
进一步分析PD-L1表达与临床病理特点的相关性, 发现无论是年龄、性别、病理还是分期, 与PD-L1表达均未见显著相关, 但吸烟史与PD-L1显著相关, 提示有吸烟史的病人更有可能PD-L1表达阳性(表1)。
42例LCNEC患者中, 33例接受了根治性手术治疗, 截止到2021年8月31日, 其中25例出现复发, 平均无病生存期(disease-free survival, DFS)为19.5个月; 25例患者出现死亡, 平均总生存期(overall survival, OS)为27个月。接受根治性手术的PD-L1阳性患者DFS显著优于PD-L1阴性患者(P=0.045 3), 但整体OS未显示明显的差异(P=0.068 8)(图2)。
 | 图2 根据PD-L1分层的DFS(A)和OS(B)曲线Fig.2 Kaplan-Meier curves for DFS (A) and OS (B) according PD-L1 expression status (positive vs. negative) |
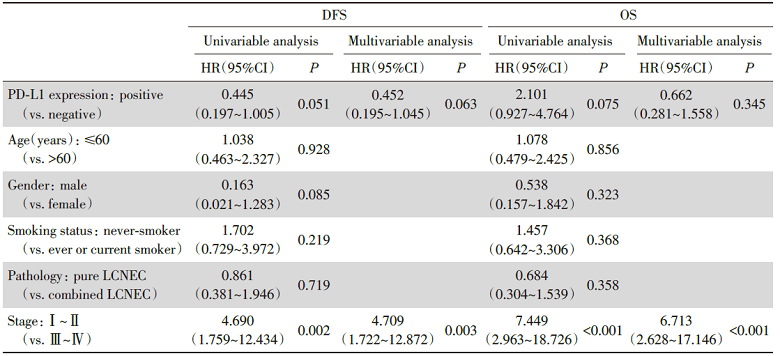
单因素Cox回归分析中, PD-L1表达与DFS[风险比(hazard ratio, HR) 0.445, 95%可信区间(confidence interval, CI)0.197~1.005, P=0.051]、OS(HR 2.101, 95%CI 0.927~4.764, P=0.075)均未见显著相关性, 临床分期与DFS(HR 4.690, 95%CI 1.759~12.434, P=0.002)、OS(HR 7.449, 95%CI 2.963~18.726, P< 0.001)均显著相关。多因素Cox回归分析得到相似的结果, 即PD-L1表达与DFS(HR 0.452, 95%CI 0.195~1.045, P=0.063)、OS(HR 0.662, 95%CI 0.281~1.558, P=0.345)均未见显著相关性, 临床分期与DFS(HR 4.709, 95%CI 1.722~12.872, P=0.003)、OS(HR 6.713, 95%CI 2.628~17.146, P< 0.001)均显著相关, 见表4。
| 表4 对DFS和OS进行单因素和多因素回归分析 Tab.4 Univariate and multivariate analysis of DFS and OS |
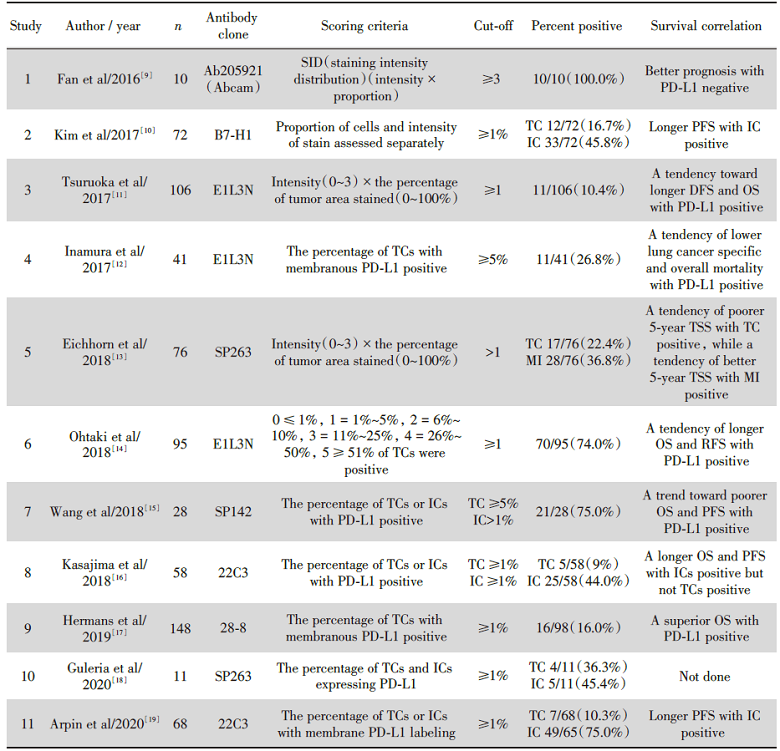
通过PubMed检索, 仅发现11篇关于LCNEC中PD-L1表达的相关研究报道, 共计713例病例, 见表5。不同的研究使用的PD-L1抗体不同, 共使用7种不同的PD-L1抗体, 其中E1L3N是最常用的抗体[9, 10, 11]。同时, 不同抗体的评分标准也不同, 抗体B7-H1、SP263、22C3的评分包括肿瘤细胞和免疫细胞染色两部分, 而抗体Ab205921、E1L3N、SP142、28-8的评分仅关注肿瘤细胞的染色情况。并且不同抗体的评分临界值也不同, 甚至是同一抗体在不同的研究中的临界值也有所不同。回顾的文献中, PD-L1表达的阳性率为10.4%~100%, 并且, 免疫细胞表达的阳性率均高于肿瘤细胞。多个研究证实免疫细胞的阳性往往与更好的预后相关, 比如:更长的无进展生存期(progression-free survival, PFS)、OS, 而肿瘤细胞阳性在不同的研究中呈现不同的预后相关性, 使用抗体E1L3N、28-8的研究结果发现肿瘤细胞阳性与更佳的预后相关, 使用抗体Ab205921、SP142的研究显示肿瘤细胞阳性预示不良预后, 而使用抗体B7-H1、22C3的研究则表明肿瘤细胞阳性与预后不相关。
| 表5 LCNEC患者PD-L1表达水平的文献回顾 Tab.5 Review of literatures of PD-L1 expression in LCNECs |
LCNEC是一种起源于肺和支气管上皮内分泌细胞的肿瘤, 恶性程度高。LCNEC的组织病理呈现分化差、高度恶性的特征, 细胞体积大、呈大多角形, 核浆比值低, 核染色质粗或呈泡状, 坏死较多, 可见核仁, 核分裂指数高(≥ 10/10HPF)。LCNEC与腺癌存在一些类似的组织学特性, 又与SCLC和类癌都表达神经内分泌标志物, 而且它还可以与其它肺癌组织类型混合共存, 即复合性LCNEC, 因此LCNEC的病理诊断是相对困难的[12]。多个研究报道初始诊断为LCNEC的病理标本, 经病理专家组重新审核后, 27%~37%标本的诊断需修改[13, 14, 15]。此外, 本研究中的42例样本大部分来自于早中期患者的手术标本, 少部分为穿刺、抽吸等小标本, 这可能是由于小标本往往存在细胞挤压变形、组织过少等问题, 给诊断带来极大的障碍。因此, LCNEC一般在手术切除标本充分取材时排除了其他分化成分后才能诊断, 在活检小标本中往往存在诊断困难, 这也导致有学者认为LCNEC的发病率在既往很可能被低估了[16]。但随着病理技术不断更新、免疫组化标志物的不断探索、分子基因的深入检测, LCNEC的诊断会越来越精准。
继化疗、靶向治疗后, 免疫治疗目前已成为肺癌治疗史上又一里程碑式进展, 然而由于LCNEC发病率低, 开展前瞻性临床研究困难, 至今免疫治疗在LCNEC中的疗效仍未知。PD-L1作为免疫标志物, 其表达越高, 被认为越可能从免疫治疗中获益。PD-L1在LCNEC中的表达阳性率在不同的研究中存在较大的差异, 范围从10.4%至100%, 本研究的阳性率是45.2%, 考虑导致以上差异主要有以下原因:(1)不同研究使用不同的抗体克隆。Fan等[17]使用的抗体克隆ab205921(Abcam)检测PD-L1在LCNEC中的表达阳性率高达100%, 甚至在类癌中也呈现异常的PD-L1高表达。Ishii等[18]使用相同克隆检测SCLC中的PD-L1表达, 同样也显示出与大多数其它研究不同的高表达结果。因此, 应选美国食品药品管理局(Food and Drug Administration, FDA)批准的抗体克隆进行检测。(2)不同抗体克隆的评分标准不同。克隆E1L3N只表达于肿瘤细胞, 因此它的评分标准不含有免疫细胞的表达。但FDA批准的抗体克隆SP263、22C3, 它们的评分标准既包括肿瘤细胞的表达也包括免疫细胞的表达, 但事实上, 它们的表达评分仅在肿瘤细胞中被证实, 尚缺乏免疫细胞评分的证据。而抗体SP142是唯一一个在肿瘤细胞和免疫细胞的检测均已标准化的克隆[19]。不同的研究发现以上抗体检测PD-L1在LCNEC中的表达, 免疫细胞表达的阳性率均高于肿瘤细胞, 提示大部分LCNEC呈现免疫豁免的特点, 当然由于病例数较少, 可能并不能完全反映PD-L1的表达情况。此外, 相同的抗体克隆, 不同研究的评分阈值也可能不同。Tsuruoka和Ohtaki等[9, 11]使用克隆E1L3N阈值均设为1, 而Inamura等[10]设为5%。Wang等[20]使用克隆SP142, 阈值设为TC≥ 5%、IC> 1%, 本研究同样也使用SP142, 但阈值设为TC≥ 1%、IC≥ 1%。因此, 评分阈值的规范化对于PD-L1检测也十分重要。(3)不同研究的人群不同。Guleria等[21]发现LCNEC中PD-L1高表达更多见于东南亚人群, 特别是蒙古族源人群, 比如中国、日本, 因此不排除不同种族人群本身存在PD-L1表达的差异, 这也需要更大样本的研究进一步证实。
一直以来PD-L1作为预后标志物都是充满争议, 在LCNEC中也不例外。多项研究发现肿瘤细胞中PD-L1的阳性表达呈现更佳的预后趋势, 如:更长的DFS、OS, 更低的肺癌相关致死率[9, 10, 11, 22]。但同时, Fan等[17]研究显示PD-L1在肿瘤细胞中的阴性表达与更好的预后相关, 同样的结论也可见于Wang等[20]的研究。本研究发现PD-L1阳性患者DFS显著优于PD-L1阴性患者, 但OS未显示明显的差异。Cox回归分析显示PD-L1与DFS、OS均未见显著相关性。考虑以上各个研究呈现相矛盾的结论可能由于LCNEC的高异质性和样本量不足所致。2016年来自美国斯隆凯瑟琳癌症研究中心(Memorial Sloan Kettering Cancer Center, MSK)的Rekhtman N等对45个LCNEC组织进行二代测序(next generation sequencing, NGS), 根据基因突变表型, 将LCNEC分成2个主要亚型和1个次要亚型:SCLC样亚型, 以TP53和RB1共突变或缺失为特征, 同时还出现其他一些常见于SCLC中的基因改变, 包括MYCL、SOX2、FGFR1扩增和PTEN突变或缺失; NSCLC样亚型, 以缺乏TP53和RB1共同突变为特征, 也可见STK11、KRAS、KEAP1基因改变; 类癌样亚型, 以MEN1基因突变和低肿瘤突变负荷为特征[23]。不同的基因突变, 不同的亚型, 对治疗疗效不同, 预后也不同。而免疫细胞中PD-L1的阳性表达均显示与更好的预后相关[13, 24, 25]。Eichhorn等[26]进一步将肿瘤细胞和免疫细胞的PD-L1表达结合起来, 发现TC+/IC-表达类型较TC-/IC+具有显著的不良预后, 具体的机制尚不清楚, 但PD-L1在免疫细胞中的表达主要存在于巨噬细胞, 而巨噬细胞与CD8+ T细胞浸润显著相关, 这表明肿瘤的免疫原性可能影响预后。
综上所述, 虽然免疫治疗在LCNEC中疗效未知, 但一部分LCNEC患者的PD-L1表达阳性, 甚至是强阳性。无论是肿瘤细胞还是免疫细胞中的PD-L1表达均与预后相关, 但结论尚未统一, 将二者的表达情况结合起来可能更有预后价值, 未来需要前瞻性的大样本的研究来进一步证实。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|