作者简介:
钟育敏(1995-),女,广东汕头人,硕士研究生,研究方向肺癌免疫治疗。
肺淋巴上皮瘤样癌(pulmonary lymphoepithelioma-like carcinoma,PLELC)是一种罕见的肺原发恶性肿瘤,较其他类型的非小细胞肺癌具有更好的预后。EB病毒(Epstein-Barr virus,EBV)感染已被证实和这种特殊类型肺部恶性肿瘤的发生发展有重要联系。目前PLELC的标准治疗仍存在争议,而免疫治疗在病毒相关性肿瘤的治疗中呈现出良好的治疗效果,包括人乳头瘤病毒阳性的头颈部鳞状细胞癌和EBV阳性的胃癌等。由于和EBV感染相关,程序性死亡配体-1(programmed death ligand 1,PD-L1)高表达和肿瘤区域大量淋巴细胞浸润,免疫治疗可能对PLELC产生良好的治疗效果。在本文中,我们将从EBV感染和PLELC的关系,免疫检查点抑制剂在这种特殊类型肿瘤中的治疗效果和其治疗产生耐药的机制这几方面进行阐述。
Pulmonary lymphoepithelioma-like carcinoma (PLELC) was a rare type of primary malignant lung tumor with favorable prognosis than other types of non-small cell lung cancer. Since its first publication in 1987, a close association between the disease and Epstein-Barr virus (EBV) infection had been found. To date, no standard therapeutic strategy for this rare disease had been established. It was reported that immunotherapy had a good therapeutic effect in some virus-associated cancers, including human papilloma virus (HPV)-positive head and neck squamous cell carcinoma and EBV-positive gastric cancer. For its association with EBV infection, overexpression of programmed death ligand 1 (PD-L1) and sufficient lymphocytic infiltration, it was likely that immunotherapy could be a promising choice for PLELC. In this review, we retrospected the association of EBV and PLELC, described the therapeutic effects of immune checkpoint inhibitors in this rare disease and explore drug resistance mechanisms to immune checkpoint inhibitors.
淋巴上皮瘤样癌在病理上是指在肿瘤区域有大量淋巴细胞浸润的未分化癌。已有报导, 在鼻咽、肺、胸腺、唾液腺、胃、膀胱和子宫颈等多种器官都发现了淋巴上皮瘤样癌的存在。其中, 鼻咽是淋巴上皮瘤样癌最好发的部位。肺淋巴上皮瘤样癌(pulmonary lymphoepithelioma-like carcinoma, PLELC)是一种罕见的肺原发恶性肿瘤, 在中国南方, 日本和亚洲东南部的其他国家等特定地理位置和人群中更为常见[1]。在PLELC患者中, 常见肺癌驱动基因的突变率较低, 手术、化疗和放疗仍是PLELC的主要治疗手段[2, 3]。近几年, 有病例报导, 用免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)治疗PLELC在临床上产生了令人满意的效果。然而免疫治疗是否是PLELC治疗的新希望仍需要更多强有力的证据来支持。
病毒感染与大约20%人类恶性肿瘤的发生发展密切相关[4]。已发现包括EB病毒(Epstein-Barr virus, EBV)、乙肝病毒、丙肝病毒和人乳头瘤病毒(human papilloma virus, HPV)等在内的八种病毒是人肿瘤相关病毒, 与人类恶性肿瘤的发生发展密切相关。这些病毒致癌机制各不相同, 包括表达病毒基因诱导宿主细胞稳态失调, 诱导慢性炎症和通过免疫抑制创造出更适宜肿瘤生长的环境等。根据一个评估度伐利尤单抗在头颈部鳞状细胞癌的治疗效果的临床试验(NCT02207530), HPV阳性患者的客观缓解率(objective response rate, ORR)为16.2%[95%可信区间(confidence interval, CI)9.9~24.4]和29.4%(95%CI 15.1~47.5), HPV阴性患者为10.8%(95%CI 4.4~20.9)[5]。似乎ICIs在HPV阳性的头颈部鳞状细胞癌患者中治疗效果较阴性患者更好。另一个临床试验(NCT02589496)的数据表明, 帕博利珠单抗在6例EBV阳性的胃癌患者中取得了高达100%的ORR[6]。然而, 由于患者例数较少, EBV的状态是否能成为ICIs在胃癌中的疗效预测因子仍需要在更大规模的队列中进行前瞻性的研究来证实。
CheckMate 040研究评估了纳武利尤单抗在262例成年肝癌患者中的治疗效果。在乙型肝炎病毒或丙型肝炎病毒阳性的患者中的反应率为14%~20%, 而在肝炎病毒阴性患者中为21%~23%[7]。似乎免疫治疗在肝炎病毒阳性和阴性患者中治疗效果并无差别。大多数皮肤梅克尔细胞癌与梅克尔多元癌细胞病毒(Merkel cell polyomavirus, MCPyV)感染相关, 而免疫治疗对这类肿瘤能产生较好的治疗效果。Avelumab等药物已经被美国食品药品监督管理局批准用于该病的治疗。一项评估帕博利珠单抗在梅克尔细胞癌患者中治疗效果的临床试验(NCT02267603)数据显示, 帕博利珠单抗在MCPyV阳性和阴性患者中均产生较好的疗效, ORR分别为62%和44%, 差异无统计学意义[8]。总而言之, ICIs在不同类型的病毒相关性肿瘤中产生不同的治疗效果。ICIs有望成为病毒相关性肿瘤治疗新的首选治疗方案, 然而这需要更多的研究来进一步证实。
PLELC是在1987年由Begin等首先发现的[9], 他们在这种新发现的肿瘤患者的血清中发现了高浓度的EBV抗体, 表明其可能与EBV感染高度相关。此后, 有许多研究致力于证明EBV感染和PLELC发生发展的相关性。通过聚合酶链式反应(polymerase chain reaction, PCR)检测EBV DNA, 原位杂交技术(in situ hybridization, ISH)检测EBV DNA和RNA, 免疫组织化学检测EBV相关的抗原等, 都在PLELC患者体内发现了EBV[10], 这些都证明其与EBV感染相关。同时, 在许多肿瘤细胞中都有大量的EBV编码的小核RNA(EBV-encoded small nuclear RNA, EBER)。ISH检测EBER能区分EBV是肿瘤来源的还是淋巴细胞持续EBV感染带到肿瘤区域的, 这已经成为PLELC诊断的重要手段。今年, 有研究对8例PLELC冰冻标本进行多组学基因分析显示, EBV更容易插入基因间和内含子区域, 同时有两种microRNA(BART 5-3P和BART 20-3P)表达上升[11]。这些研究都证明EBV感染和PLELC密切相关, 虽然它在肿瘤启动和促进中的作用仍未完全清楚。
B淋巴细胞是EBV的主要靶细胞, EBV感染B淋巴细胞主要与病毒表面gp350、gB、gH、gL和gp42等糖蛋白有关[12]。gp350和B细胞受体CD21结合调节病毒和细胞的黏附, gB形成的同型三聚体和gH、gL形成的异二聚体的激活是EBV和B细胞融合的关键步骤, gp42和gH结合形成的复合体再和主要组织相容性复合体(major histocompatibility complex, MHC)Ⅱ 类分子结合促进病毒和B细胞融合。而EBV感染上皮细胞的机制更为复杂, 不仅可以通过CD21、整合素等细胞表面受体介导, 还可以通过和已感染EBV的淋巴细胞直接接触或者上皮细胞侧膜释放病毒颗粒等[13]。近几年发现, ephrin receptor A2(EPHA2)是EBV感染上皮细胞的关键分子, 在鼻咽癌和胃癌上皮细胞发现, EPHA2和gH/gL、gB相互作用促进EBV融合和进入上皮细胞[14]。有类器官实验进一步证明, EBV感染胃癌上皮细胞是由于细胞表面EPHA2表达位置的改变[15]。然而EBV感染肺泡上皮细胞的机制仍未有研究报导。
EBV对肿瘤微环境中相关免疫细胞及免疫炎症相关分子产生一定的影响, 从而使得EBV相关肿瘤呈现出独特而复杂的免疫微环境。单细胞RNA测序发现, 在EBV阳性的鼻咽癌标本中, 主要的肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, TILs)是T细胞, 而在EBV阴性的标本中主要为B细胞[16]。在鼻咽癌中, EBV编码的核抗原EBNA-1通过促进Treg细胞趋化迁移形成抑制性的肿瘤免疫微环境[17]。EBV裂解期基因BILF1通过下调MHC-Ⅰ 类分子表达促进病毒的免疫逃避[18]。包含膜潜伏蛋白1(latent membrane protein 1, LMP1)的细胞外囊泡通过影响NFκ B、AKT和MAPK/ERK通路改变细胞外基质重塑相关基因的表达, 进而形成促进肿瘤生长和转移的微环境[19]。
既往研究已经发现, 在鼻咽癌患者中, 肿瘤细胞释放的血浆EBV DNA对于疾病的筛查和疗效的监测具有重要的意义[20]。同样的, 有越来越多的证据证明血浆EBV DNA浓度可能是PLELC预后和疗效预测的潜在因子。谢等用实时荧光PCR的方法检测了429例PLELC患者血浆中EBV DNA的含量, 证明了基线血浆EBV DNA浓度是疾病预后的独立预测因子[21]。李绮雯等的研究发现, 如果在PLELC患者随访期间血浆中EBV DNA浓度持续升高并且超过1 000拷贝数/mL, 推荐进行放疗干预[22]。然而, 由于这种疾病的罕见性, 这些研究纳入的患者例数不够, 在未来仍需进一步更大规模的随机对照试验来验证。
有趣的是, 并非世界上所有的PLELC患者都显示出与EBV感染相关。在1项关于西方PLELC患者的研究中, 用免疫过氧化物酶染色和ISH检测6例患者的结果均显示为阴性[23]。这表明西方人群中, PLELC的发生可能与EBV感染无关。然而, 有1例病例报导显示, 在1例高加索PLELC患者中, ISH证实EBER存在大多数肿瘤细胞中但不在反应性炎症细胞中[24]。PLELC在西方人群中是否与EBV感染有关仍存在争议。而EBV感染在PLELC发生发展中的作用仍未知, 在未来, 需通过进一步实验研究来回答这些问题。
目前, 手术、化疗和放疗是PLELC的主要治疗手段。早期PLELC患者以手术治疗为主, 预后较好。晚期PLELC仍无标准的治疗方案, 治疗以化疗、放疗等多种方式综合为主, 预后较其他类型非小细胞肺癌较好。由于PLELC在病理上和鼻咽癌类似, 5-氟尿嘧啶联合铂类化合物的方案也被用于晚期PLELC的治疗。一线紫杉醇联合铂类化合物和吉西他滨联合铂类化合物在PLELC患者中取得较好的治疗效果, 中位无进展生存期(progression-free survival, PFS)可达8.8个月和7.9个月[25]。近几年, ICIs在临床上越来越多地被用于治疗包括肺癌在内的多种恶性肿瘤, 并取得了良好的治疗效果。包括纳武利尤单抗, 帕博利珠单抗, 阿特珠单抗和度伐利尤单抗在内的程序性死亡因子-1(programmed death 1, PD-1)/程序性死亡配体-1(programmed death ligand 1, PD-L1)抑制剂已被批准用于非小细胞肺癌的治疗。PD-L1的表达水平是PD-1/PD-L1抑制剂疗效的重要预测因子。然而, ICIs在PLELC患者治疗中的效果和耐受性、安全性仍存在争议。
有研究表明, 在包括MCPyV阳性的梅克尔细胞癌, EBV相关的鼻咽癌, 非霍奇金淋巴瘤等病毒相关性肿瘤中, 肿瘤组织中PD-L1和PD-1的表达水平较非病毒相关性肿瘤要高[26, 27, 28]。这可能是由于宿主对肿瘤的反应和病毒基因的表达引起的。在一项包含79例PLELC患者的研究中, 50例(63.3%)患者表现为PD-L1阳性(≥ 5%肿瘤细胞膜染色阳性)并有更长的PFS和总生存期(overall survival, OS)[29]。像鼻咽癌一样, PLELC患者中PD-1/PD-L1表达增强可能是由于干扰素γ 分泌增加和EBV表达的LMP1引起的[30]。已经有越来越多的证据表明, PLELC患者中肿瘤细胞PD-L1的表达水平较其他类型非小细胞肺癌较高。
炎症T细胞浸润的肿瘤微环境能影响肿瘤对抗PD-1治疗的反应。包括PLELC在内的EBV阳性的肿瘤的特点表现为在肿瘤微环境中有丰富的TILs, 主要为CD8+的T细胞浸润, 即免疫浸润型肿瘤微环境。这类型肿瘤中PD-1与PD-L1结合是肿瘤逃避免疫监视的重要机制, 用PD-1抑制剂治疗效果较好。然而, 虽然PLELC中有大量的CD8+的T细胞浸润, 也有个案报导部分肿瘤特异性的CD8+的TILs不表达PD-1[31]。因此, 有人认为用PD-1/PD-L1抑制剂治疗PLELC可能不是最佳的选择。然而, 更多的证据支持ICIs用于PLELC治疗能产生较好的治疗效果。
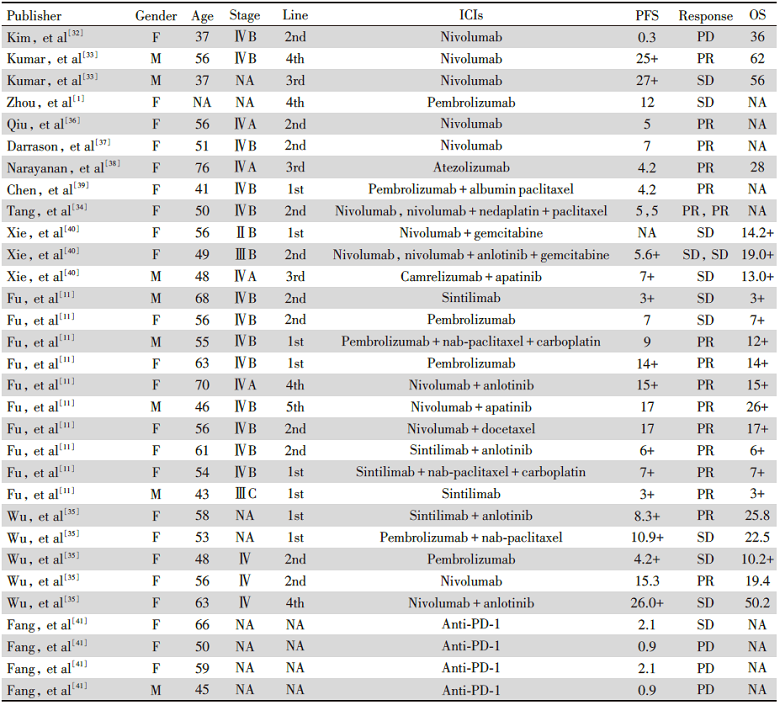
2016年, Kim等报导了第1例用纳武利尤单抗治疗PLELC患者的病例。在第1剂纳武利尤单抗治疗后的10天, 这例患者疾病进展并且死亡, 表明可能纳武利尤单抗在PLELC患者中不能取得好的治疗效果[32]。此后, Kumar等报导了2例进展期PLELC患者用纳武利尤单抗治疗20个月以上, 耐受性好并且副作用也较小[33]。同时, EBV DNA拷贝数也随着疾病进展而变化。在所有已报导用ICIs治疗的PLELC患者中, 他们的PFS是最长的。另1例病例报导显示, 在纳武利尤单抗治疗5个月进展后, 1例PLELC患者用免疫联合一线化疗药物又治疗了5个月并维持疾病稳定[34]。ICIs联合抗血管药物也被用于PLELC的治疗, 其中最长的PFS达到了26个月以上[35]。近期, 1个单中心回顾性研究纳入了10例PLELC免疫治疗的患者和17例化疗的患者, 免疫治疗组比化疗组具有更长的PFS(15.0个月和7.9个月, P=0.005)[11]。我们回顾了既往的文献报导收集的已发表的关于PLELC免疫治疗的患者, 见表1[1, 36, 37]。
| 表1 既往文献中PLELC免疫治疗患者 Tab.1 PLELC patients with immunotherapy in previous literature |
大多数PLELC患者用ICIs治疗副作用较少, 安全性和耐受性好。有报导的ICIs治疗相关的不良反应包括免疫相关性肺炎、免疫相关性结肠炎、腹泻等消化系统症状, 白细胞升高、中性粒细胞减少和甲状腺功能减退等。大多数报导的免疫相关不良反应为1级。有1例帕博利珠单抗联合白蛋白紫杉醇治疗的患者出现3级腹泻[39]。另1例免疫治疗患者出现4级免疫相关的多器官功能衰竭[11]。总之, ICIs在PLELC治疗的有效性、安全性和耐受性仍需要在更大的队列中验证。
如前所述, 病毒相关性肿瘤中PD-L1和PD-1表达水平较高, 同时有丰富的TILs浸润。PD-1/PD-L1高表达, TILs被抑制可能是病毒相关性肿瘤逃避免疫杀伤作用的机制, 当用ICIs治疗后, TILs恢复杀伤肿瘤细胞的功能。在EBV相关的B细胞肿瘤中发现, 通过激活LMP1信号通路, 可以促进B细胞对肿瘤相关抗原的表达和抗原通过MHC-Ⅰ /MHC-Ⅱ 的递呈[42]。在应用ICIs使T细胞功能恢复后, 能促进TILs对肿瘤细胞的杀伤作用。以上这些分子信号可能是病毒相关性肿瘤免疫治疗效果较好的原因之一。
在部分PLELC患者中, ICIs的疗效在几个周期后开始减退甚至于一开始就无效。为了探究ICIs治疗的复杂获得性耐药机制, 我们回顾了既往相关的病例报导。在1例病例报导中, 帕博利珠单抗联合化疗在前4个周期取得了良好的疗效, 而在第6个周期后疾病开始进展。对比ICIs治疗前, 患者肝脏病灶再穿刺活检新检测出磷脂酰肌醇-3-激酶催化亚基α (phosphatidylinositol-4, 5-bisphosphate 3-kinase catalytic subunit alpha, PIK3CA)和白细胞介素7受体(interleukin-7 receptor, IL-7R)扩增[39]。在肺癌中, PIK3CA扩增是癌基因, 具有致瘤潜能[43]。IL-7在抑制凋亡和促进肿瘤细胞增殖方面起作用[44]。我们回顾了既往的文献报导和KEGG, BioCarta和Reactome数据库以找寻IL-7R和PIK3CA信号通路, 见图1。由于PIK3CA和IL-7R扩增是ICIs治疗后新出现的, 可能是PD-1抑制剂治疗耐药的机制, 然而这需更多的研究数据来支持。
我们在之前的研究中发现, 对比基线的免疫组化数据, 在ICIs治疗后进展的PLELC患者中T细胞免疫球蛋白域粘蛋白域蛋白-3(T cells immunoglobulin domain and mucin domain protein-3, TIM-3)显著升高[45]。Koyama等发现, 在小鼠模型中, 疾病进展时TIM-3表达显著升高, 同时, TIM-3阳性与PD-1抑制剂治疗的持续反应时间密切相关[46]。在小鼠的头颈部肿瘤模型中, 与单用抗PD-1免疫治疗相比, 联合抗PD-1与抗TIM-3治疗能显著抑制肿瘤的生长[47]。而PD-1抑制剂治疗后TIM-3上调是由于PI3K/AKT通路的激活(图1)。我们猜测TIM-3上调是PLELC用ICIs治疗后耐药的另一机制。联合使用PD-1和TIM-3抑制剂可能是PLELC治疗的新的有效的治疗方案。然而这需要未来更多的观察和实验研究来证明。
其他的ICIs治疗获得性耐药机制在其他肿瘤中也有发现, 包括抗原递呈缺陷, T细胞反应的启动和浸润缺陷, 其他免疫检查点受体上调和抑制性肿瘤微环境[48]。但是这些机制在PLELC中均没有被证明。在一例PLELC病例报导中, 为了克服ICIs耐药, 在纳武利尤单抗治疗进展后加用了一线治疗有效的化疗药物, 患者又维持了5个月的疾病稳定。化疗联合ICIs可能是克服免疫治疗耐药的一个选择。在未来, 需要更多深入的实验研究以阐明PLELC用ICIs治疗耐药的机制并探寻解决的方案。
PLELC是一种特殊而罕见的肺癌亚型, 多见于亚洲人群。病理上, 其表现为肿瘤区域有大量淋巴细胞浸润的未分化癌。PLELC的驱动基因突变频率较低, 靶向治疗不能取得良好的治疗效果。已有证据证明EBV在PLELC的发生发展中起着重要的作用, 然而, 其具体致癌机制仍未清楚。和其他病毒相关性肿瘤一样, ICIs在PLELC治疗中取得良好的治疗效果。PIK3CA和IL-7R扩增, TIM-3上调, 可能是PLELC用ICIs治疗的耐药机制。在较大的随机对照临床试验中论证PLELC用ICIs治疗的有效性并阐明耐药机制是PLELC未来研究的重点。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|