| 杨帆,北京大学人民医院副院长,主任医师、教授,博士生导师。主要研究方向为肺癌的个体化治疗和靶向治疗。 美国胸心血管外科学会(American Association for Thoracic Surgery,AATS)会员,中国抗癌协会肺癌专业委员会常务委员,中国临床肿瘤学会(Chinese Society of Clinical Oncology)非小细胞专业委员会常务委员,CSCO老年肿瘤防治专家委员会常务委员,北京肿瘤学会肺癌专业委员会常务委员,北京市抗癌协会肺癌专业委员会委员。兼任《Lung Cancer》杂志副主编。发表多篇SCI论文,主持多项国家、省部级课题。 |
Tada H, Mitsudomi T, Misumi T, et al. Randomized phase Ⅲstudy of gefitinib versus cisplatin plus vinorelbine for patients with resected stage Ⅱ-ⅢA non-small-cell lung cancer with EGFRmutation (IMPACT)[J]. J Clin Oncol, 2022, 40(3):231-241.
1b。
尽管术后辅助化疗是可切除Ⅱ~Ⅲ期非小细胞肺癌(non-small-cell lung cancer, NSCLC)患者的标准治疗方案, 临床预后结果却差强人意。新型化疗药物的出现在一定程度上改善了NSCLC患者的临床预后。一项针对顺铂联合长春瑞滨化疗(cis/vin, n=1 888)的荟萃分析显示, 5年生存率可以提高8.9%, 风险比(hazard ratio, HR)为0.80。
早期针对NSCLC进行的术后辅助厄洛替尼/吉非替尼相关临床试验并未对EGFR突变状态进行区分, 结果也未能发现无病生存期(disease-free survival, DFS)或总生存期(overall survival, OS)的获益。RADIANT临床试验结果表明, 厄洛替尼辅助治疗可以给患者带来DFS获益, 但无OS获益。本研究开展于2011年, 当时奥希替尼尚未可及。
在进行了完全切除、EGFR敏感突变型的Ⅱ~Ⅲ期NSCLC患者中, 评估吉非替尼作为术后辅助治疗的疗效是否优于顺铂+长春瑞滨。
• 研究条件:来自日本的25个研究中心参加的临床研究(WJOG6410L, IMPACT, UMIN000006252)。
• 研究时间:2011年9月至2015年12月。
• 研究方法:多中心、开放标签, 随机对照的Ⅲ期临床试验。
• 研究对象:完全切除、病理分期Ⅱ~Ⅲ期、携带EGFR敏感突变(19外显子缺失或21外显子L858R突变)的NSCLC患者, ECOG PS评分0~1分, 血液系统及器官功能健全。排除5年内出现任何器官同步或异时性癌症、过去5年内曾接受过抗癌药物治疗或放疗(包括术后放疗)、严重的术后并发症、间质性肺炎等。
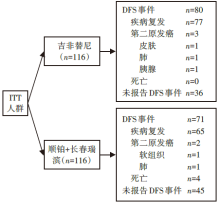
• 干预措施:234例患者进行入组评估, 按1:1比例随机分配成2组, 在吉非替尼组中, 2例患者自动退组, 剩余232例患者构成意向治疗(intent-to-treat, ITT)人群, 每组各有116例患者, 均纳入全分析集。一组接受吉非替尼治疗(250 mg qd), 共24个月; 另一组注射顺铂(80 mg/m2 d1)+长春瑞滨(25 mg/m2 d1, d8)每3周一次, 共4个疗程。患者完全性切除术后5~10周内开始治疗, 未复发的患者不允许进行后续药物治疗或术后放疗。每8周通过胸片、体格检查评估, 每6个月通过对比胸腹部CT评估疗效, 每12个月通过头颅MR、PET-CT或骨扫描评估疗效, 盲态独立中心审查(blinded independent central review, BICR)委员会评估每1例患者, 直到试验治疗计划完成或患者疾病复发或第二原发癌被发现或死亡或无法耐受的毒副反应出现。IMPACT研究的流程见图1。
• 评价指标:主要终点指标为DFS, 次要终点包括OS、复发类型(局部复发vs. 远处转移)和不良事件等。
中位随访时间为70个月, 吉非替尼组116例患者中, 有70例患者(61.2%)接受吉非替尼治疗满2年, 45例终止了治疗(其中19例患者因疾病复发、6例患者因不良事件停用吉非替尼)。顺铂+长春瑞滨化疗组的116例患者中, 89例(78%)患者完成4周期化疗, 26例终止了治疗(其中2例因疾病复发和14例患者因不良事件停用化疗)。
吉非替尼组有80例(77例复发, 3例第二原发肿瘤)、顺铂+长春瑞滨化疗组有71例(65例复发, 2例第二原发肿瘤和4例死亡, 其中3例为与治疗相关的死亡)患者报告DFS事件。
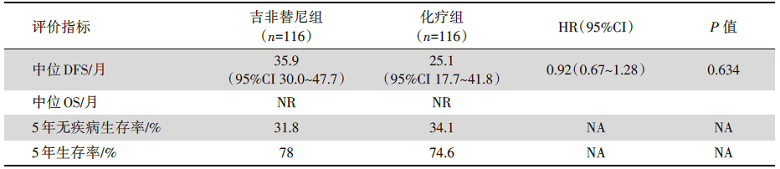
吉非替尼组中位DFS为35.9个月[95%可信区间(confidence interval, CI)30.0~47.7], 数值上高于联合化疗组25.1个月(95%CI 17.7~41.8)。中位OS未达到。但两组DFS的Kaplan-Meier曲线显示, 吉非替尼组的DFS与顺铂/长春瑞滨化疗组无统计学差异[HR=0.92(95%CI 0.67~1.28), P=0.63]。K-M曲线提示, 吉非替尼组DFS起初优于顺铂/长春瑞滨化疗组, 但在手术后约4年左右开始出现相交。对4年这个时间点进行了事后时间线分层, 在此之前的HR为0.828, 在此之后的HR为2.702, 并且也体现在K-M曲线的形状上。两组OS的K-M曲线无明显分离[HR=1.03(95%CI 0.65~1.65), P=0.89]。对于完成2年吉非替尼辅助治疗的70例患者, 从停药至疾病复发的中位DFS为29.8个月。吉非替尼和顺铂/长春瑞滨化疗组的5年无进展生存率分别为31.8%和34.1%, 3年无进展生存率分别为48%和45%, 2年无进展生存率分别为64%和52%。5年总生存率分别为78%和74.6%, 3年总生存率分别为92%和88%, 5年总生存率分别为94%和94%。IMPACT 研究的主要疗效结果指标见表 1。
| 表1 IMPACT研究的主要疗效结果 |
两组间探索性亚组分析结果显示, 没有亚组患者从吉非替尼辅助治疗中获益, 虽然样本量相对较少(n=46), 吉非替尼组在年龄≥70岁患者中OS更优(HR=0.589, 95%CI 0.101~0.981, P=0.018)。
安全性分析:每组各115例患者纳入到安全性分析。吉非替尼组和顺铂+长春瑞滨化疗组分别有5例患者(4.3%)和71例患者(61.7%)发生4级或更高级别不良事件(adverse event, AE)。吉非替尼组最常见不良反应为谷丙转氨酶水平升高(69%)和谷草转氨酶水平升高(65%), 其次为皮肤毒性。联合化疗组最常见为中性粒细胞减少(95.7%)、白细胞减少(90.4%)、恶心(90.4%)、厌食(83.55%)。
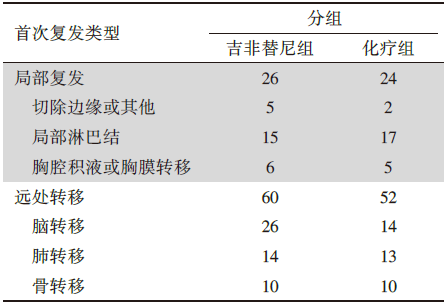
吉非替尼组有77例患者, 顺铂+长春瑞滨化疗组有65例患者在随访期间出现疾病复发。两组的复发部位数量无明显差异(8 vs. 9), 但吉非替尼组脑转移更多(26 vs. 14, P=0.07)。IMPACT研究首次复发类型详见表2。
| 表2 IMPACT研究首次复发类型 |
后续治疗:吉非替尼组有76例患者在疾病复发后接受后续治疗, 顺铂+长春瑞滨化疗组有71例。疾病进展后, 顺铂+长春瑞滨化疗组交叉到吉非替尼组的比例(59/71, 83%)高于吉非替尼组交叉到化疗组(23/76, 30%)。
吉非替尼辅助靶向治疗并未显著延长完全切除、EGFR敏感突变NSCLC患者的DFS和OS, 仅能延缓疾病复发。因此, 含铂双药治疗应继续作为标准治疗, 之后进行辅助奥希替尼靶向治疗。但对于不适合含铂双药辅助化疗的患者, 吉非替尼辅助靶向治疗也是一种治疗选择。
IMPACT研究[1]曾得到了很多关注和期待。然而在结果公布的时候, 却多少有些被冷落、被忽略。
从辅助靶向治疗研究的发展历史来看, IMPACT研究同钟文昭所长、吴一龙院长牵头的ADJUVANT研究[2], 都是开创性的、里程碑式的研究:两项研究都是第一次在EGFR经典突变患者中评价辅助靶向治疗的随机对照试验(randomized control trial, RCT); 都是第一次把辅助靶向和标准辅助化疗(顺铂/长春瑞滨)进行“头对头”的开创性研究; 试验药物都是一代EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)吉非替尼; 使用周期都是2年; 选取的也主要都是Ⅱ~Ⅲ期的NSCLC。而且, 两项研究几乎是同时构思、同时开始, 第一例患者入组时间分别是2011年9月3日和9月19日, 仅仅相差十几天。
然而, 同样的开头并没有同样的进程。ADJUVANT研究在2017年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)年会上大会发言, 首次报告了研究的主要终点指标DFS, 2018年1月在《Lancet Oncol》全文发表[2]。相比之下, IMPACT研究似乎“命途多舛”。虽然研究入组开始时间与ADJUVANT研究相近, 但入组速度较慢, 而且因为统计学假设的差别而需要积累更多事件数, 满足其主要分析(primary analysis)数据随访需持续到2020年岁末(12月28日数据截止)。待IMPACT研究DFS结果在2021年ASCO年会报告时, 距ADJUVANT的“头彩”已过去了4年, 甚至比数据提前揭盲而“早产”并“一炮走红”的ADAURA研究, 还晚了一届ASCO。
IMPACT研究遭遇的“冷落”, 不但是“赶了晚集”, 更是始料未及的“阴性”结果。在一众“阳性”辅助靶向研究中, 这个格格不入、特立独行的“阴性”, 让人有点避之不及。
为了更好地理解IMPACT研究, 要先抛开“阴阳”不论, 解读数据的细节, 而不是统计学的“终审宣判”。
首先, 从具体数据看, IMPACT研究非常好的重复了和彼此印证了ADJUVANT研究的数据。比如两项研究中, DFS曲线都是先分离再重合的“纺锤形”。从曲线分开的程度上, 都是靶向吉非替尼治疗结束时候, 也就是大约24个月, 分开程度最大; 而且中位DFS的延长几乎完全一致, IMPACT研究10.8个月, ADJUVANT研究10.7个月; DFS曲线由分开到重合, 两项研究也是相同的4年重合, 也就是2年的吉非替尼辅助治疗后, 再过约2年, 吉非替尼组的复发“追上”辅助化疗组, DFS获益消失[1, 2]。
然后, 我们再来探讨一下为什么DFS的K-M曲线的细节如此相似, P值却是“阴阳两别”。这个问题也不难回答, 原因是ADJUVANT研究给出的DFS统计是中位随访36.5个月时的数据, 而IMPACT研究则是70个月。前面提到的数据显示, 48个月的时候, 辅助吉非替尼带来的DFS获益已经消失了。在IMPACT研究的后续分析中, 48个月之前的HR为0.828, TKI有益, 而48个月之后的HR为2.702, 所以综合下来HR没有统计学差异。当然随访时间的不同并不能完全解释统计结果的区别, 毕竟ADJUVANT研究80个月随访时DFS仍然存在统计学的显著差别。IMPACT研究者在文中对此也有分析:IMPACT研究随访间隔短(8周vs. 12周); 删失患者少(5年时删失30例vs. 55例)和独立盲法评估委员会的存在, 都被列为是可能的影响因素。但更可能的, 是两个研究入组患者群的不同, 比如IMPACT研究入组患者中约八成是PS 0分, 而ADJUVANT研究两臂中这一比例仅二到三成。另外IMPACT研究中包括少量N0的患者, N2患者比例也略低。这些因素对于DFS曲线的走行都会产生影响, 进而也影响统计学“宣判”[1, 2]。
在赞同前述分析的IMPACT研究和ADJUVANT研究相互印证基础上, 下面可以把这两项随访时间最长、报告数据最充分的Ⅲ期研究合并一起, 来看看究竟可以带来什么样的印象。
第一个印象, 一代TKI吉非替尼辅助2年治疗可以推迟疾病的复发, 获得大约10个月的中位DFS获益, 但无法增加疾病的治愈, 表现为DFS曲线在停药后2年左右时的重合, 和OS曲线的重叠[2, 3]。更为有趣的是, IMPACT研究中, 接受辅助吉非替尼满2年的70例患者, 停药后至复发的中位时间为29.8个月[1], 也类似化疗组DFS的25.1个月, 说明TKI是对肿瘤的抑制而非杀灭。如果认可这个观点, 就会产生一个问题:既然吉非替尼辅助可以抑制肿瘤, 得到了推迟复发的DFS获益, 同时不改变肿瘤在停药后的自然复发病程, 为什么没有OS获益?刚刚发表在《Nat Commun》杂志的MINERVA模型回答了这个问题, 因为不是所有的携带敏感经典突变的患者都能从一代TKI辅助治疗中获益。MINERVA模型把患者分为三类人群:35%辅助TKI高度获益人群、51%的辅助TKI获益人群和14%的辅助化疗获益人群[4]。这个里程碑式的模型代表了精准辅助治疗的未来方向, 但仍需要更多数据的独立验证, 比如不同药物、特别是不同代药物的数据。
第二个印象也和前面的观察相关。如果TKI对于疾病更多是控制, 停药后的复发几乎都是敏感细胞的“卷土重来”, 那延长治疗时间, 是否能进一步延长DFS获益时间?现有的辅助靶向治疗时长的对比研究数据很少, 目前仅阿法替尼和埃克替尼进行的两项Ⅱ期研究探索了不同辅助靶向治疗时长与疗效之间的关系, 美国斯隆-纪念凯特琳癌症中心(Memorial Sloan Kettering Cancer Center, MSKCC)完成的3个月与2年阿法替尼辅助治疗的小样本对照研究, 2年无复发生存率(recurrence free survival, RFS)分别为70%和81%(P=0.55), 中位DFS分别为42.8m和58.6m[5]。类似的结果来自我国的1年对比2年辅助埃克替尼对照研究, 中位DFS分别为32.9m和48.9m(P=0.002 9)[6]。从这两项研究中均提示延长治疗时长可以延长DFS获益时间, 但多长时间合适仍是未解之谜; 而且随着辅助治疗时间延长, 药物经济学和可能过度治疗问题也更加凸显。
第三个印象是关于复发模式。IMPACT研究观察到了辅助吉非替尼组的颅内转移的增加(26例vs. 14例); ADJUVANT研究中也观察到颅内转移是吉非替尼辅助组最常见的复发模式, 占27.4%, 而化疗组最常见模式则是颅外复发[1, 7]。在RADIANT研究第一次报告的EGFR突变亚组数据中, 就观察到辅助靶向治疗组中更高的颅内转移率(37.1% vs. 12.9%安慰剂组)[8]。所有这些数据都提示, 一代EGFR-TKI靶向治疗增加了颅内复发的风险, 其原因, 很可能与一代药物透过血脑屏障能力不佳有关[9]。这与一代EGFR-TKI在晚期NSCLC一线治疗中观察到的高颅内进展风险相一致。
谈完印象谈“敢想”也就简单了。辅助EGFR-TKI靶向治疗已经成为部分NSCLC的标准辅助治疗手段, 未来我们如何让辅助靶向治疗做的更好, 正如前面谈到的一代药物辅助靶向治疗所暴露出的问题和不足, 解决以上问题和不足正是我们未来的改善方向。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|