| 钟文昭,胸部肿瘤外科学博士,广东省人民医院主任医师,广东省肺癌研究所所长,广东省人民医院肿瘤医院副院长,香港中文大学(深圳)、华南理工大学医学院、南方医科大学博士生导师;中国临床肿瘤学会理事,青年委员会副主任委员,肺癌专业组组长;中华医学会肿瘤早诊早治学组副组长;中国研究型医院学会胸外科专业委员会青年委员会副主任委员;广东省医学会肺部肿瘤学分会副主任委员;国际肺癌联盟IASLC官方杂志《J Thorac Oncol》副主编。 主要研究方向为以肺癌外科为主单病种多学科综合治疗,包括ⅢA期N2肺癌、肺部孤立结节/肺腺癌/GGO分类诊断和处理、胸腔镜微创肺癌根治术、肺癌病理分类和临床实践、人工智能影像-液体活检肺癌早筛分诊系统等;主持四项国家自然科学基金;研究结果发表在《Lancet Oncol》《J Clin Oncol》《J Thorac Oncol》《J Extracell Vesicles》《Nat Commun》《J Hematol Oncol》等杂志。 |
Wu YL, Tsuboi M, He J, et al. Osimertinib in resected EGFR-mutated non-small-cell lung cancer[J]. N Engl J Med, 2020, 383(18):1711-1723.
Wu YL, John T, Grohe C, et al. Postoperative chemotherapy use and outcomes from ADAURA: Osimertinib as adjuvant therapy for resected EGFR-mutated NSCLC[J]. J Thorac Oncol, 2021, S1556-0864(21)03285-8. Online ahead of print.
1b。
非小细胞肺癌(non-small-cell lung cancer, NSCLC)占所有肺癌的85%, 其中约30%的患者在诊断之初可以实现手术切除, 包括早期和局晚期患者。对可手术切除的Ⅱ~ⅢA期和部分ⅠB 期NSCLC患者, 推荐在手术后接受以铂为基础的辅助化疗。
既往大型随机试验和荟萃分析显示, 早期NSCLC患者接受术后辅助化疗其5年总生存率提高5%。但总体而言, 患者在接受手术和辅助化疗后依然具有较高的疾病复发和死亡风险。数据显示, ⅠB 期、Ⅱ期和Ⅲ期的术后5年复发风险分别达45%、62%和76%。
在表皮生长因子受体(epidermal growth factor receptor, EGFR)突变的晚期NSCLC患者中, 奥希替尼被证实与对照组EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)(厄洛替尼/吉非替尼)相比能显著改善患者的无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS), 具有统计学意义和明确的临床意义, 在合并脑转移的患者中同样具有确定疗效, 而奥希替尼在早期EGFR突变的NSCLC患者中术后辅助应用尚未得到证实。
比较早期EGFR突变的NSCLC患者的术后辅助奥希替尼的无病生存期(disease-free survival, DFS)是否优于安慰剂; 了解ADAURA研究中辅助化疗的使用情况及其对完全切除的EGFR基因突变阳性的NSCLC术后辅助奥希替尼疗效的影响。
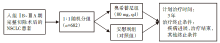
• 研究方法:全球26个国家参与的多中心、前瞻性、双盲、安慰剂对照、Ⅲ期、随机对照临床试验(NCT02511106)。
• 研究时间:2015年8月至2020年1月。
• 研究对象:接受完整手术切除的ⅠB~ⅢA期EGFR突变(19del/L858R)原发非鳞NSCLC患者,
≥18岁(台湾/日本≥20岁), PS 0/1分接受或不接受辅助化疗, 手术至随机:10周(无辅助化疗)/26周(有辅助化疗)。根据下列因素分层:临床分期(ⅠB 、Ⅱ或ⅢA期); EGFR突变类型(19del或L858R); 种族(亚裔或非亚裔)。
• 干预措施:随机1:1分组, 接受奥希替尼或安慰剂(见图1)。
• 评价指标:研究者评估Ⅱ~ⅢA期患者的DFS; 次要研究终点为总人群(ⅠB ~ⅢA)的DFS, 2年、3年、4年和5年的无病生存率, OS, 安全性和生活质量。按照患者年龄、疾病分期和地理位置分层后患者使用辅助化疗的情况; 按照是否接受辅助化疗和疾病分期分层后的患者DFS。
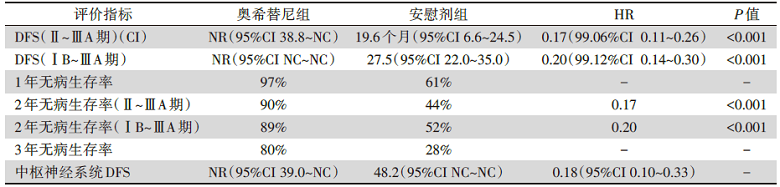
共有682例患者随机入组, 339例随机至奥希替尼组, 343例随机至安慰剂组。其中410例接受了辅助化疗(奥希替尼组:n=203; 安慰剂组:n=207)。数据截至时间为2020年1月17日。结果显示, 无论是Ⅱ~ⅢA期患者还是总人群(ⅠB~ⅢA期), 都达到了主要终点, 奥希替尼组的中位DFS显著优于安慰剂组; 此外, 辅助奥希替尼也显著降低脑转移复发的风险(表1)。
| 表1 ADAURA研究主要结果 |
在随后的亚组分析中, 奥希替尼可以为不同亚组患者带来显著DFS获益; 无论是按照性别、年龄、吸烟状态、种族(亚裔/非亚裔)、分期(ⅠB/Ⅱ/ⅢA期)、EGFR突变亚型(19del或L858R)、既往是否进行辅助化疗进行分层, 奥希替尼组均展现出明显DFS优势。
OS数据尚未成熟。辅助化疗更多得出现在以下分层的患者中:年龄<70岁的患者(338/559, 66%)多于年龄≥70岁的患者(72/173, 42%); ⅡA~ⅢA期(352/466, 76%)多于ⅠB期患者(57/216, 26%); 亚洲患者(268/414, 65%)多于其他地区的患者(142/268, 53%)。无论患者是否进行辅助化疗, 都可以从辅助奥希替尼中获益, 接受辅助化疗人群DFS的HR 0.16, 95%CI 0.10~0.26; 未接受辅助化疗患者的HR 0.23, 95%CI 0.13~0.40。
而在安全性上, 奥希替尼的安全性良好, 大部分不良反应(adverse event, AE)均为轻度即1~2级不良反应, 3级及以上AE发生率低, 未出现任何引起死亡的治疗相关AE。
对于ⅠB~ⅢA期EGFR突变的NSCLC患者中术后辅助奥希替尼是一个有效的、新的治疗方案, 无论既往是否接受过辅助化疗。
此项Ⅲ期全球双盲随机临床试验ADAURA(NCT02511106)研究证实, 无论患者是否经过辅助化疗, 相对于辅助安慰剂, 辅助奥希替尼在完全切除的ⅠB~ⅢA期EGFR突变阳性的NSCLC患者的DFS上显示出显著的临床获益[1, 2]。其主要研究终点:ⅡA~ⅢA期的24个月的无病生存率为奥希替尼组明显优于安慰剂组(HR=0.17, P<0.001)。第二研究终点ⅠB~ⅢA期24个月的无病生存率为奥希替尼组优于安慰剂组(HR=0.20, P<0.001), 相当于奥希替尼减少了80%的疾病复发或者死亡的风险。在所有的亚组分析中, 都观察到了奥希替尼的DFS获益:ⅠB期为HR=0.39, Ⅱ期为HR=0.17, Ⅲ期为HR=0.12。对于接受术后辅助化疗的人群来说, 89%接受奥希替尼治疗的患者和49%接受安慰剂治疗的患者在24个月时存活且无病(HR=0.16), 而未接受术后辅助治疗的患者, 24个月的无病生存率分别为奥希替尼组89% vs.安慰剂组58%(HR=0.23)。
对于早期肺癌患者来说, 外科手术仍是治愈癌症的首选方案[3]。早期NSCLC的治疗目的在于根治, 对于中国患者来说, 目前的诊疗存在三大重点:第一个是早期筛查:目前已有多种手段可以在早期发现肺癌, 而早期发现并在其出现转移之前进行R0手术切除, 是根治性治疗肺癌首要的一点[4]; 第二个是早期肺癌手术的规范化, 需要根据肿瘤直径、大小及影像学改变等进行规范化的手术切除, 同时对淋巴结进行清扫[3, 5, 6]; 第三个是肺癌围手术期的治疗, 通过术前新辅助、术后辅助或“夹心饼”式围手术期治疗, 能更好的清除血中残留微小病灶, 使患者获得最大的生存获益[7]。目前, 早期可切除NSCLC患者的标准辅助治疗是以铂类为基础的化疗, 但其5年OS的绝对获益仅约5%, 并且ⅠB 期肺癌患者的临床获益并不确定[3, 8, 9]。辅助化疗有效率低且不良反应常难以忍受, 早期肺癌患者亟需新的辅助治疗方案。
后辅助化疗时代研究者们进行了诸多辅助治疗模式的探索。2010年《Lancet》的一篇meta分析指出, 对于Ⅰ~Ⅲ期的肺癌手术患者, 术后适形放疗(postoperative radiotherapy, PORT)加上辅助化疗, 相对于单纯辅助化疗能提高患者的5年生存率[10]。而2021年随机临床试验PORT-C和2022年Lung-ART则表明接受了辅助化疗的ⅢA-N2期的NSCLC患者并不能从术后辅助放疗中获益[11, 12]。MAGRIT研究表明, 抗肿瘤疫苗不能给ⅠB~ⅢA期MAGE-A3阳性NSCLC患者带来OS或者DFS的显著获益[13]。另外, E1505研究表明辅助抗血管生成药物贝伐单抗联合辅助化疗对比单纯辅助化疗未能改善ⅠB~ⅢA期NSCLC的OS[14]。此外, JIPANG研究表示低毒性的辅助化疗(培美曲塞联合顺铂)对比辅助长春瑞滨联合顺铂也未能提高可手术肺癌患者的无复发生存期(recurrence free survival, RFS)和OS[15]。以上种种辅助治疗的尝试均未能突破辅助化疗对生存率提高的瓶颈, 辅助靶向能否走出这种困境?
辅助EGFR-TKI的探索以IPASS研究(吉非替尼vs.卡铂+紫杉醇)对晚期一线NSCLC的探索结果为界[16], 在此之前EGFR-TKI辅助治疗人群未经历生物标志物的筛选, 例如BR19、RADIANT[17, 18]等研究。在BR19的探索性分析中, 该研究中的15例EGFR基因突变阳性患者使用安慰剂或者吉非替尼并无DFS和OS的改善[17]。后来的RADIANT研究相对于BR19的进步是开始基于EGFR状态分层, 并将EGFR阳性患者的OS和DFS作为研究的关键次要终点[18]。但RADIANT中EGFR阳性是由免疫组化(immunohistochemistry, IHC)和荧光原位杂交(fluorescence in situ hybridization, FISH)决定的, 这在一定程度上导致了EGFR阳性患者相对于辅助安慰剂, 并未从辅助厄洛替尼中获得DFS的统计学获益, 但有显著改善的趋势(中位DFS:厄洛替尼46.4 vs. 安慰剂28.5, P=0.039)。SELECT研究虽然成功地将所有入组患者限定为EGFR基因突变阳性患者, 但是入组人群包含了45%的Ⅰ期人群和11%的ⅠB期人群, 而且该研究仅采用了历史对照的方式说明全人群的2年无病生存率及总生存率相对提高[19]。至此, 前IPASS研究们对于辅助EGFR-TKI的探索并没有带来阳性结果, 但是这些一代EGFR-TKI辅助治疗的早期经验让人们意识到精准筛选辅助治疗潜在获益人群的重要性。
IPASS研究结果公布后, 基于EGFR基因突变的辅助靶向临床研究逐步开展。后IPASS研究们(ADJUVANT[20]、EVEN[21]、ADAURA[1]、EVIDENCE[22]等)开始对入组患者进行了EGFR基因状态及分期更精准的筛选。中国的ADJUVANT研究首次在前瞻性随机对照试验中证实完全切除的EGFR基因突变的NSCLC患者(Ⅱ~ⅢA期N1~N2), 相对于辅助化疗, 辅助靶向吉非替尼有DFS获益, 虽然并没有转化为OS获益[20, 23]。之后的EVEN研究纳入的患者同样是中国人群, 虽然该研究证实了ⅢA期人群辅助厄洛替尼相对于辅助化疗的DFS及OS均有统计学差异(DFS:HR=0.268, P<0.001; OS:HR=0.165, P=0.001 3), 但是该研究分期较为局限且人群量较小。与此同时, 三代TKI药物——奥希替尼以FLAURA的亮眼成绩挺进晚期EGFR突变患者一线治疗的行列, 展现出相对于吉非替尼和厄洛替尼的PFS获益(中位PFS:18.9个月vs. 10.2个月, HR=0.46; 95%CI 0.37~0.57, P<0.001)。且无论患者有无中枢神经系统转移, FLAURA均展现出临床获益。同时与标准的EGFR-TKI药物相比, 奥希替尼的3级或以上不良事件发生率较低(34% vs. 45%)[24]。
以三代TKI在晚期EGFR突变NSCLC中的出色表现为基础, 吴一龙教授主持的全球双盲安慰剂对照的随机临床试验——ADAURA应运而生[24, 25]。ADAURA研究是全球首个EGFR-TKI辅助治疗的Ⅲ期注册临床研究, 该研究将奥希替尼应用分期前移, 同时吸取既往一代EGFR-TKI的经验教训, 专注于ⅠB~ⅢA期可切除EGFR突变阳性的NSCLC患者的辅助靶向治疗, 创造了肺癌辅助治疗的新格局。
首先, 该研究设计允许患者接受辅助化疗, 然后再随机分为奥希替尼治疗组与安慰剂对照组。这样设计的原因是不同分期NSCLC患者术后辅助化疗的获益与风险不同, 美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)指南推荐对ⅠB期患者术后进行观察, ⅠB高危人群推荐辅助化疗, 其他影响辅助化疗的因素包括患者偏好、全球不同地区辅助治疗使用差异等[3]。一些常规的EGFR-TKI药物辅助治疗研究设计如厄洛替尼(EVAN)[21]、吉非替尼(ADJUVANT/CTONG1104)[20]和埃克替尼(EVIDENCE)[22]都是直接进行了EGFR-TKI药物与辅助化疗的头对头比较。而ADAURA研究中纳入的人群可以根据医生和患者的选择决定是否接受辅助化疗, 采用“奥希替尼/安慰剂± 辅助化疗”的设计策略, 旨在进一步探索早期最佳辅助治疗模式。此设计更加符合临床实践, 同时该研究结果有助于医生更好得理解辅助化疗在EGFR-TKI辅助治疗中的定位, 有望回答辅助治疗中是否“去化疗”的问题:从24个月无进展生存率的角度观察, 化疗与否并不影响患者从辅助奥希替尼中DFS获益(化疗:HR=0.16, 非化疗:HR=0.23); 奥希替尼组未达到中位DFS(95%CI NC~NC)vs.安慰剂组中位DFS为33.1个月(95%CI 23~NC)[2]。
但该研究未能回答Ⅱ~ⅢA期EGFR突变阳性患者单纯辅助奥希替尼或者辅助化疗, 哪种方案的预后较好的问题。而ADJUVANT/CTONG1104纳入了Ⅱ~ⅢA期(N1~N2)EGFR突变阳性患者, 展示了辅助吉非替尼的DFS优于标准化疗。因此ADAURA和ADJUVANT结果可互相印证, 即:EGFR突变患者术后辅助治疗无论是否接受化疗均可以从TKI中获益。另外, ADAURA中术后辅助化疗更多的出现在以下分层的患者中:年龄<70岁的患者(338/559, 66%)多于年龄≥70岁的患者(72/173, 42%); ⅡA~ⅢA期(352/466, 76%)多于ⅠB期患者(57/216, 26%); 亚洲患者(268/414, 65%)多于其他地区的患者(142/268, 53%)。此外, 有评论认为奥希替尼惊艳的DFS获益一定程度上反映了安慰剂组较高的复发率, 这可能源于45%的安慰剂组患者未接受辅助化疗[2, 26]。但是ADAURA辅助治疗的亚组分析中, 26%的ⅠB期患者接受术后辅助化疗, 76%的Ⅱ~ⅢA期患者接受辅助化疗, 辅助化疗的使用情况与既往研究及临床实践中所观察到的情况是一致的。并且选择接受辅助化疗的患者(Ⅱ~ⅢA期占86%)的临床预后比未接受化疗的患者(Ⅱ~ⅢA期占41%)更差(无病生存率:49% vs. 58%; 中位DFS:22.1个月vs. 33.1个月)[2]。目前临床上对于术后患者是否必需要行辅助化疗尚无定论, 这不仅需要基于循证医学证据, 还需要综合患者意愿、经济问题等多因素进行决策。与ADAURA类似, RADIANT研究也采用了厄洛替尼对比安慰剂的设计[18]。
其次, 该研究纳入人群广泛:囊括了ⅠB~ⅢA期的患者, 分期是预设的分层因素(ⅠB/Ⅱ/ⅢA期), 但ⅠB期不纳入主要终点评估。不同分期患者预后差异大, ⅠB期患者复发率低于Ⅱ~Ⅲ期患者[27]。ⅠB期患者中辅助治疗的获益存在争议, 如主要终点中加入ⅠB期患者, 则可能稀释奥希替尼在Ⅱ~ⅢA期患者辅助治疗中的疗效获益[8]。主要终点与关键次要终点之间采用序贯多重检验策略, 这有助于满足确证性临床试验中控制总Ⅰ类错误率且保证总检验效能的要求。2020年4月研究团队应独立数据监查委员会(Independent Data Monitoring Committee, IDMC)要求提供ADAURA的疗效数据, 奥希替尼辅助治疗ⅠB~ⅢA期NSCLC患者取得了压倒性的疗效优势, IDMC审阅后建议提早揭盲并调整相应的统计分析计划。期中分析2(IDMC 2020)时已达到主要研究终点(H1:Ⅱ~ⅢA期患者的DFS有统计学意义, α =0.05)及DFS关键次要研究终点(H2:总人群ⅠB~ⅢA期的DFS有统计学意义, α =0.05), 研究成功, 后续不再进行DFS的统计学检验, 仅作探索性分析。既往的研究如ADJUVANT/CTONG1104, 限制纳入人群为Ⅱ~ⅢA(N1~N2)期[20], EVEN仅纳入ⅢA期患者[6]。而ADAURA研究大胆纳入占比将近三分之一的ⅠB期患者(奥希替尼组:32% vs.安慰剂组:32%), 其中26%的ⅠB期患者接受了辅助化疗。奥希替尼辅助治疗的DFS具有压倒性优势, 两条生存曲线从最初用药开始就截然分开, 一直都没有交叉。奥希替尼辅助治疗可使主要研究终点, Ⅱ期和ⅢA期患者的DFS疾病复发或死亡风险降低83%(HR 0.17, 99.06%CI 0.11~0.26, P<0.001)。在总体研究人群ⅠB~ⅢA期患者中, DFS结果显示奥希替尼可将疾病复发或死亡的风险降低80%(HR 0.20, 99.12%CI 0.14~0.30, P<0.001), 且无论既往是否接受过辅助化疗均有显著获益[2]。无论疾病分期如何, DFS的K-M曲线均显示出奥希替尼和安慰剂组的早期分离。对于接受辅助化疗的人群来说, 24个月时奥希替尼组和安慰剂组的DFS分别为ⅠB期81% vs. 66%; Ⅱ期91% vs. 59%; Ⅲ期89% vs. 33%。而对于未接受辅助化疗的人群来说, 奥希替尼组相对于安慰剂组仍旧显示出24个月时的DFS优势:ⅠB期90% vs. 74%; Ⅱ期89% vs. 47%; Ⅲ期86% vs. 27%。总体ⅠB期人群的DFS的HR值更是达到了0.39(95%CI 0.18~0.76)[1]。并且患者分期越晚, HR值越小, 这无疑扩大了EGFR-TKI辅助治疗的适用人群。与此研究设计类似, RADIANT研究也纳入了ⅠB~ⅢA期人群, 但是亚组EGFR突变阳性患者中, 中位DFS为HR=0.61(安慰剂组28.5个月 vs. 厄洛替尼组46.4个月, 95%CI 0.38~0.98, P<0.001), 其数据并不如ADAURA惊艳。但RADIANT中EGFR突变阳性患者中ⅠB期占比为厄洛替尼组 51% vs. 安慰剂组39%, 高于ADAURA(奥希替尼组:32% vs. 安慰剂组:32%), 并且总人群中ⅠB期亚组并没有观察到DFS的统计学优势(HR=0.98, 95%CI 0.710~1.352)。
另外, 不同于既往的EGFR-TKI辅助用药2年的时长, ADAURA术后辅助的时长为3年[1, 20]。这样设计的原因是考虑到本研究包含了大约30%的ⅠB期患者, 复发时间可能会长于Ⅱ~ⅢA期患者, 且大部分早期NSCLC患者的局部和远处复发发生在术后3年内和EGFR-TKI辅助治疗停药的12个月内[3, 18, 20, 28, 29]。并且既往的辅助EGFR-TKI研究显示在辅助TKI治疗2年后, 生存曲线开始聚合, 提示更长治疗周期可能提高整体预后[23]。此外, 既往研究表明奥希替尼的耐受性也较标准EGFR-TKI好(3级或更高级别的不良事件发生率:奥希替尼组:34% vs.标准EGFR-TKI组:45%), 表明辅助奥希替尼治疗较长时间的可能性高于其他EGFR-TKI[24]。但是这也引起了另一个对于ADAURA的争议:等待OS结果时可能存在过度治疗的问题[26]。长期的奥希替尼辅助治疗的随访数据是必要的, 只有如此人们才能弄清楚奥希替尼究竟是仅仅在术后3年内抑制了疾病的复发还是真正治愈了患者。此外, 奥希替尼并未回答辅助治疗使用时间长短的问题, 有可能像ER+或Her2+乳腺癌的辅助靶向药物治疗一样, 靶向辅助治疗时间越长, 患者预后越好[30]。Chao Lyu在2021年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)上汇报的ICOMPARE研究表明, 与1年治疗组相比, 埃克替尼辅助治疗2年后DFS得到显著改善, OS具有潜在获益, 且未增加毒性。该研究提示延长辅助EGFR-TKI暴露持续时间可能与生存结果的改善相关。
此外, ADAURA研究的主要终点为DFS。毫无疑问OS仍旧是临床试验研究主要终点的金标准, 但在NSCLC的仅辅助化疗时代, DFS和OS具有良好的相关性, 可以作为OS的有效替代终点[31]。在EGFRm NSCLC的辅助治疗中尚未确认DFS和OS相关性。与OS不同, 以DFS作为研究主要终点的优势为可以冲淡疾病复发后后续治疗方式对患者预后的影响, 更直接地反映研究药物的疗效。但正如吴一龙教授所说, “辅助治疗研究整体历时较长, OS数据揭晓甚至可达10年之久, 难以解决临床‘燃眉之急’, 因此结合临床实践情况, DFS更适合作为主要终点指标的代替指标, OS作为次要研究终点。鉴于ADAURA研究的惊艳的DFS结果, 该研究的OS结果也很有可能为阳性, 但是其实并不是特别重要。临床上, 相比‘带瘤生存’, 大部分患者更倾向于‘无瘤生活’, ‘无瘤生活’指的就是DFS, 因此DFS被接受的程度更好”。当然ADAURA研究是否可以转化为OS获益仍旧有待商榷, 这也是本研究争议较大之处[26]。来自加拿大皇后大学的Bishal Gyawali认为, 只有在几项前瞻性随机试验中显示, OS有显著改善后, 化疗才成为了Ⅱ~ⅢA期NSCLC患者的标准辅助治疗。而肿瘤学家们在尚未看到成熟的OS数据时就将奥希替尼加入术后辅助治疗的标准行列是非常自满的[3, 26]。因为既往有些辅助EGFR-TKI治疗的EGFR突变阳性NSCLC患者的DFS获益并未转化为OS获益, 例如ADJUVANT/CTONG1104[20]。
此外, 奥希替尼展现出对于中枢神经系统强有力的保护作用。肺癌最常见的远处转移部位之一是脑部, 且肺癌脑转移患者预后较差[32]。RADIANT、ADJUVANT研究提示一代EGFR-TKI治疗脑转移可能效果不佳[18, 20, 23]。ADAURA研究中, 奥希替尼辅助治疗可显著降低远处复发, 尤其降低了82%的中枢神经系统(central neural system, CNS)疾病复发或死亡风险(HR 0.18, 95%CI 0.10~0.33)[1]。
尽管围绕ADAURA的争议不断, 但从奥希替尼辅助EGFR突变阳性NSCLC患者在2020年ASCO大会上的首次惊艳亮相(ⅠB~ⅢA期患者的中位DFS的HR为0.21)[33], 再到2020年欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)大会的DFS获益更佳(ⅠB~ⅢA期患者的中位DFS的HR为0.20)[34], 再到2020年世界肺癌大会(World Conference on Lung Cancer, WCLC)ⅠB~ⅢA期患者的中位DFS更新为超强的0.16[35], 美国食品药品监督管理局(Food and Drug Administration, FDA)和中国国家药品监督管理局(National Medical Products Administration, NMPA)相继批准奥希替尼用于国内外EGFR突变阳性可手术NSCLC患者的辅助治疗。吴一龙教授就此话题谈到, “奥希替尼辅助治疗适应证在中国成功获批上市, 获批时间几乎与美国同步, 充分显示出我国药品审批改革的进步”。NCCN指南首次将奥希替尼推荐用于ⅠB~Ⅲ期术后携带EGFR突变NSCLC患者的辅助治疗, 彻底改变了二十余年来辅助化疗“一家独秀”的现状[3]。同时, 推荐ⅠB~Ⅲ期NSCLC患者术后手术组织/活检样本应进行EGFR基因检测[3]。ADAURA成为第一个基于生物标志物选择的并改变了可切除肺癌的标准治疗的辅助治疗临床试验; 奥希替尼成为国内首个获批辅助治疗适应证的EGFR-TKI药物, 亦是国内目前唯一覆盖ⅠB~ⅢA期的EGFR-TKI药物, 无疑在辅助治疗领域留下了足够浓墨重彩的一笔。
奥希替尼辅助治疗适应证的获批是目前肺癌术后辅助治疗领域的一次重大的创新性突破, 在此之后有几个重要的方向仍然需要探索。首先, 确实存在一部分患者即使接受奥希替尼辅助治疗后仍然复发转移, 那么需要寻找这些人群并给予个性化的治疗; 此外, 也有一部分EGFR突变患者单纯接受靶向治疗疗效不佳, 可能需要联合治疗; 其次, 通过液体活检、组织活检、影像学检查等手段及早发现复发迹象, 并进行干预, 进而治疗更多患者, 这些都是未来研究的方向。最后, 奥希替尼从FLAURA晚期EGFR突变阳性患者到可切除NSCLC患者辅助治疗站稳脚跟, 接下来它能否在新辅助治疗领域(NeoADAURA:NCT04351555)百尺竿头, 更进一步, 值得期待。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|