| 乔贵宾,广东省人民医院胸外科主任,主任医师,中山大学肿瘤学博士,德国石荷州大学医学博士,博士研究生导师。广东省医疗行业协会胸外科管理分会主任委员,广东省医师协会胸外科分会副主任委员,广东省医学会微创外科分会副主任委员,中国抗癌协会肺癌专业委员会委员,中国研究型医院学会胸外科学专业委员会常务委员,中国医疗保健国际交流促进会胃食管反流多学科分会常务委员,中国医师协会胃食管反流分会委员,广东省医学会胸外科学会常务委员兼肺癌学组副组长,《J Thorac Dis》《中国微创外科杂志》《国际肿瘤学杂志》编委。发表论文100余篇,近5年以第一负责人承担国家自然基金和省部级课题5项,主编主译专著3部,牵头制定了3部区域性和全国性胸外科行业共识。 |
Spicer J, Wang C, Tanaka F, et al. Surgical outcomes from the phase 3 CheckMate 816 trial: Nivolumab (NIVO) + platinum- doublet chemotherapy (chemo) vs chemo alone as neoadjuvant treatment for patients with resectable non-small cell lung cancer (NSCLC)[J]. J Clin Oncol, 2021, 39(15S):Abstr8503.
1b。
手术在早期至局部晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者中具有确切疗效, 但仍有30%~80%患者在术后可能复发。此前, 针对高危复发的患者可采取新辅助或辅助化疗。然而, 新辅助化疗的获益有限, 病理完全缓解(pathological complete response, pCR)率低。目前, 程序性死亡受体1(programmed death 1, PD-1)抑制剂已在晚期NSCLC患者中显示出生存获益的优势, 但尚未有针对可切除NSCLC的Ⅲ期随机对照研究结果公布。
评估纳武利尤单抗(nivolumab, Nivo)+化疗作为可切除NSCLC新辅助治疗的疗效。
• 研究条件:来自15个国家和地区的137个研究中心(NCT02998528)。
• 研究时间:2017年1月13日至2023年5月8日(预期主要完成时间)。
• 研究方法:多中心、开放标签、随机对照的Ⅲ期临床试验。
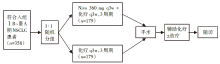
• 研究对象:初治的可切除ⅠB(≥4 cm)至ⅢA期NSCLC(依据第7版TNM分期), PS评分0~1分, 无已知EGFR敏感突变或ALK突变。
• 干预措施:患者按1:1随机分为两组, 分别接受3周期Nivo(360mg q3w)联合含铂双药化疗(q3w)新辅助治疗或单纯含铂双药化疗(q3w)新辅助治疗。探索组接受Nivo 3 mg/kg q2w(3周期)+伊匹木单抗(ipilimumab)1 mg/kg(仅第1周期)。术后可选择接受辅助化疗± 放疗, 见图1。
• 评价指标:主要终点是pCR、无事件生存率(event-free survival, EFS, 由盲态独立中央审查委员会或盲态独立病理学审查委员会评估)。次要终点是主要病理缓解(major pathology response, MPR, 由盲态独立病理学审查委员会评估), 总生存期(overall survival, OS), 至死亡或远处转移的时间。探索性终点是客观缓解率(objective response rate, ORR), 预测生物标志物, 包括程序性死亡配体1(programmed death ligand 1, PD-L1)、肿瘤突变负荷(tumor mutation burden, TMB)、循环肿瘤DNA(circulating tumor DNA, ctDNA)。
共358例患者入组(Nivo+化疗组, n=179; 化疗组, n=179)。截止2020年9月16日, 与化疗组相比, 意向性治疗(intented-to-treat, ITT)人群的Nivo+化疗组的pCR率更高[24.0% vs. 2.2%, 比值比(odds ratio, OR)13.94, 99%可信区间(confidence interval, CI)3.49~55.75, P<0.000 1], MPR率也更高(36.9% vs. 8.9%, OR 5.70, 95%CI 3.16~10.26)。Nivo+化疗在pCR率上的优势在各关键亚组中一致, 包括ⅠB/Ⅱ期(第七版分期, 26.2% vs. 4.8%), ⅢA期(23.0% vs. 0.9%), PD-L1[<1%(16.7% vs. 2.6%); ≥1%(32.6% vs. 2.2%)], 和TMB[低(22.4% vs. 1.9%); 高(30.8% vs. 2.7%)]。此外, Nivo+化疗组的ORR(53.6% vs. 37.4%)和影像学降期率(30.7% vs. 23.5%)也优于化疗组。
接受根治性手术的患者比例在两组分别为83.2%(Nivo+化疗组)和75.4%(化疗组)。每组各有2例因不良反应或疾病进展(12例vs. 17例)而取消手术。在Nivo+化疗组和化疗组中, 3~4级的毒性相关不良反应和手术相关不良反应分别占33.5%和36.9%以及11.4%和14.8%。
NIVO+化疗组和化疗组的微创切除率分别为30%和22%, 中转开胸率分别为11%和16%, R0切除率分别为83%和78%, 中位手术时间分别为184(130~252)min vs. 217(150~283)min, 中位住院时间分别为10.0(7~14)d vs. 10.0(7~14)d。Nivo+化疗组有2例5级手术相关不良反应, 而化疗组没有。化疗组有3例因手术不良反应而导致的死亡, 而Nivo+化疗组则没有。
纳武利尤单抗联合化疗的新辅助治疗方案可显著改善可切除NSCLC的病理反应。
外科手术是唯一有机会根治肺癌的治疗手段, 但即使是最早期的肺癌, 手术后5年内也有30%~50%的患者会出现复发和转移。因此, 自上世纪九十年代以来, 大量的研究探索了可手术NSCLC的围术期治疗以提高手术疗效, 但直到2005年术后辅助化疗的作用才得到确认。同期的一些研究还发现, 术前新辅助化疗与术后辅助化疗这两种治疗模式在生存获益方面没有显著差异, 但无论是术前新辅助化疗还是术后辅助化疗, 相较单纯手术, 5年生存率仅能提高5%。因此, 如何进一步提高药物疗效一直是近二十年来肺癌研究的热点。
随着靶向治疗药物的出现, 大量的研究表明, 对EGFR等驱动基因阳性的可切除肺癌患者进行围术期靶向治疗可提高疗效, 与化疗相比, 围术期靶向治疗不但延长了无疾病进展时间而且延长了术后总生存时间。然而对不存在激活基因突变的患者, 能否使用免疫治疗药物提高传统化疗的疗效是亟需回答的问题。
2018年, 《N Eng J Med》报道了第一个新辅助免疫治疗药物用于可切除NSCLC的队列, 虽然仅有21例患者入组, 但经过纳武利尤单抗新辅助免疫治疗后手术发现有45%的患者肿瘤出现了显著病理缓解(MPR), 经过中位12个月随访后, 20例手术患者中有16例患者仍然存活且无复发, 18个月无复发生存率为73%[1]。这个单臂的观察研究一石激起千层浪, 极大激发了研究者的兴趣, 随后有数十项新辅助免疫治疗的临床研究注册和开展。
由于围术期化疗被认为是可切除NSCLC的标准治疗, 因此大多临床研究在探讨免疫药物在新辅助治疗中的作用的时候, 设计的是化疗联合免疫治疗的方案。2020年一项来自西班牙的NADIM研究[2]发表在《Lancet Oncol》, 这是一项单臂多中心的Ⅱ期临床研究, 符合入组标准的ⅢA期患者接受纳武利尤单抗联合紫杉醇及卡铂治疗3周期后手术, 结果发现手术后显著病理缓解率(MPR)高达83%, 其中63%的患者达到病理完全缓解(pCR)。如此史无前例的效果在说明化疗联合免疫治疗能显著提高单纯化疗或者单纯免疫治疗的疗效的同时, 人们也更加期待大型随机对照试验(randomized control trial, RCT)研究来回答和验证这个结果。
随后, 在2021年举办的美国癌症研究协会(American Association for Cancer Research, AACR)和美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)年会上CheckMate 816的手术治疗结果。CheckMate 816研究是第一个新辅助化疗联合免疫治疗能够为可切除NSCLC患者病理完全缓解(pCR)带来显著获益的Ⅲ期RCT研究。研究结果显示, 与传统的化疗相比, 免疫治疗药物纳武利尤单抗的加入可提高10倍以上的pCR率, 次要研究终点MPR可提高4倍。而且研究还发现, 免疫药物的加入既没有影响手术切除率, 也没有影响手术切除的方式, 并且还未增加手术难度及术后不良反应的发生率。从数据上看, CheckMate 816以优异的结果达到了研究设计的主要终点和次要终点, 堪称NSCLC围术期治疗里程碑式的研究, 研究结果很可能改变未来的治疗模式和临床实践。
CheckMate 816惊艳的结果极大激发了新辅助免疫联合化疗在真实世界临床实践中的应用, 但这种治疗策略能否转化为被广泛接受的临床标准尚需大量的证据。尽管CheckMate 816研究达到了研究的主要终点和次要终点, 但卓越的pCR和MPR能否转化为最终的生存获益是影响其广泛推广的主要原因。由于肺癌新辅助治疗的长期生存数据难以获取, OS数据往往需要10年以上时间才能成熟, 但从免疫新辅助治疗的相关研究以及化疗新辅助治疗的数据, 我们乐观估计, CheckMate 816的高pCR和MPR以及达到阳性EFS终点, 极有可能会转化为最终的生存获益。研究方案与CheckMate 816基本类似的NADIM研究的生存数据显示, 虽然患者皆为分期相对较晚的ⅢA期, 但术后12个月、18个月和24个月的无进展生存率(progression-free survival, PFS)为95.7%、87%和77.1%; 12个月、18个月和24个月的总生存率分别为97.8%、93.5%和89.9%。进一步的分析还显示, pCR与免疫新辅助治疗后更好的PFS(HR=0.25, P=0.05)相关。此外, 既往关于肺癌新辅助化疗的研究也证实, 新辅助化疗后出现pCR的患者生存期更长(3年生存率100% vs. 49%)[3]。因此, 免疫联合化疗作为可切除肺癌新辅助治疗的标准治疗策略指日可待。
CheckMate 816研究取得了令人鼓舞的结果, 但依然有许多未明的问题需要回答和验证。比如, 为什么研究人群为ⅢA期分期偏晚的患者, 在NADIM研究中所取得的结果似乎要更好一些, NADIM研究的pCR率是CheckMate 816研究的将近3倍, 真实世界的研究中会是怎么样的结果?此外, 尽管CheckMate 816研究报告在药物治疗阶段和手术后有较高的安全性, 但在免疫治疗联合化疗组, 却出现了2例死亡(肺栓塞及主动脉破裂各1例), 虽然研究者否认2例死亡与免疫药物相关, 但新的药物的出现一定会出现新的问题, 这2例死亡事件值得临床医生重视。CheckMate 816研究结果显示, 与传统的化疗相比, 免疫药物的加入不会增加手术的难度, 但研究数据也显示开胸手术和中转开胸的比例相对较高, 说明手术具有一定的复杂性。因此, CheckMate 816研究给我们带来惊喜的同时, 也值得我们结合临床工作深入思考。当然, 关于免疫药物在新辅助治疗中的应用仍然有诸多未解的问题需要回答, 比如药物方案的优化、手术时机、疗效评价体系、有效的预测标志物和pCR的患者是否术后仍需药物治疗, 等等。
总之, CheckMate 816研究是一个潜在改变临床实践的研究, 免疫治疗药物的加入明显改善了传统的新辅助化疗对可切除、非驱动基因突变NSCLC对药物的反应, 并有可能最终给患者带来生存的获益, 这种免疫联合化疗的新的新辅助治疗模式未来可期。
| [1] |
|
| [2] |
|
| [3] |
|