| 陈椿,胸心外科福建省高校重点实验室、福建医科大学附属协和医院胸外科学科带头人,副院长,胸外科科室主任,二级教授,国家卫生计生突出贡献中青年专家,享受国务院特殊津贴。兼任福建省医师协会胸外科分会主任委员、福建省抗癌协会肺癌专业委员会主任委员、福建省医学会胸外科分会首任主任委员、中国抗癌协会纵隔肿瘤专业委员会副主任委员、中国医疗保健促进会胸外科分会副主任委员、海峡两岸医药交流协会胸外科分会副主任委员、中华医学会胸心血管外科分会委员、中国医师协会胸外科医师分会常务委员、中国医师协会胸外科微创专业委员会常务委员、中国抗癌协会肺癌专业委员会常务委员、中国抗癌协会食管癌专业委员会常务委员、福建省抗癌协会食管癌专业委员会副主任委员、国际肺癌研究学会会员、美国胸外科协会(AATS)会员。 作为负责人先后承担国家十一五科技支撑计划合作项目、卫生部医药卫生科技发展研究中心课题、福建省重大专项专题项目等课题10项。成果获福建省科技进步奖一等奖1项,三奖1项。发表论文78篇,其中SCI/EI收录41篇,单篇最高影响因子达32.956。出版专著3部,授权专利2项。先后培养了博士、硕士研究生46人,也是福建省特殊支持双百计划科技创新领军人才、福建省卫生计生有突出贡献中青年专家、福建省最美科技工作者。 |
Felip E, Altorki N, Zhou C, et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stageⅠB-ⅢA non-small-cell lung cancer (IMpower010): A randomised, multicentre, open-label, phase 3 trial[J]. Lancet, 2021, 398(10308):1344-1357.
1b。
约50%新确诊的非小细胞肺癌(non-small-cell lung cancer, NSCLC)患者为局限性(Ⅰ期或Ⅱ期)或局部晚期(Ⅲ期)。Ⅰ期和Ⅱ期以及部分Ⅲ期NSCLC患者可进行根治性手术。但是, 采用手术治疗的ⅢA期患者的5年生存率只有36%。我们需要开发新的辅助策略来优化早期NSCLC患者完全手术切除后的结局。
免疫检查点阻断抑制已经彻底改变了不可切除的局部晚期或转移性NSCLC的治疗, 程序性死亡配体1(programmed death ligand 1, PD-L1)抑制剂阿特珠单抗在转移性NSCLC中显示出临床益处和可耐受的安全性, 并已被批准用作一线和二线或后续治疗。
评估以铂类为基础的化疗后予以阿特珠单抗辅助治疗对比最佳支持治疗(best support care, BSC)对IB~ⅢA期完全手术切除后的NSCLC患者预后的影响。
• 研究条件:全球包括美国、澳大利亚、比利时、中国等22个国家和地区的227个临床中心开展的临床试验(NCT02486718)。
• 研究方法:随机、多中心、Ⅲ期、开放标签的临床试验。
• 研究时间:2015年10月31日至2027年12月17日。
• 研究对象:完全切除的ⅠB(肿瘤≥4 cm)~ⅢA期NSCLC患者。入组标准包括ECOG PS评分为0~1, 患者接受了肺叶切除术/全肺切除术并且能接受含铂化疗。
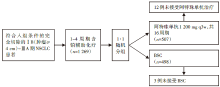
• 干预措施:共1 269例患者接受了含铂化疗, 1 005例患者以1:1随机分组, 其中阿特珠单抗组12例, BSC组3例没有接受指定的干预, 剩余990例患者, 495例接受阿特珠单抗, 495例接受BSC。患者在术后28~84天进入入组阶段, 患者接受4种以顺铂为基础的辅助化疗方案中的其中1种, 并进行4个周期的治疗。阿特珠单抗剂量为1 200 mg, q3w, 持续16个周期或一年。BSC包括观察和定期扫描监控疾病复发。研究干预流程图见图1。
• 评价指标:主要终点指标包括无病生存期(disease free survival, DFS)。次要终点指标包括意向性治疗(intented-to-treat, ITT)人群的总生存期(overall survival, OS)、3年无病生存率、5年无病生存率、不同亚组无病生存率、安全性等。
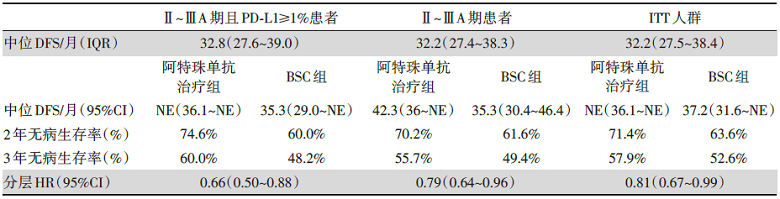
实际上入组Ⅱ~ⅢA期NSCLC患者882例。在对Ⅱ~ⅢA期人群中位随访32.2个月后, 与BSC相比, 阿特珠单抗显著延长了DFS。PD-L1表达≥1%的Ⅱ~ⅢA期患者:疾病进展或死亡风险降低34%[分层风险比(hazard ratio, HR)0.66, 95%可信区间(confidence interval, CI)0.50~0.88], 3年无病生存率更高(60.0% vs. 48.2%)。所有Ⅱ~ⅢA期患者:疾病进展或死亡风险降低21%(分层HR 0.79, 95%CI 0.64~0.96), 3年无病生存率更高(55.7% vs. 49.4%)。所有ITT人群(ⅠB~ⅢA期):疾病进展或死亡风险降低19%(分层HR 0.81, 95%CI 0.67~0.99), 3年无病生存率更高(57.9% vs. 52.6%)。PD-L1表达≥50%的Ⅱ~ⅢA患者:初步数据显示死亡风险降低57%(未分层HR 0.43)。研究中主要、次要终点指标见表1。
| 表1 阿特珠单抗在不同亚组中的疗效 |
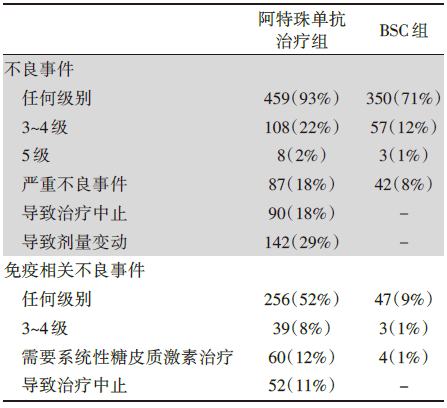
安全性上, 22%的患者发生3或4级与治疗相关的毒性作用, 安全性可耐受。不良事件总结见表2。
| 表2 不良事件总结 n(%) |
手术完全切除Ⅱ~ⅢA期NSCLC患者在辅助化疗后接受阿特珠单抗治疗的DFS获益优于BSC, 而且在PD-L1≥1%的亚组中优势更明显。
非小细胞肺癌(non-small-cell lung cancer, NSCLC)是临床最常见的肺癌类型, 临床首选外科治疗[1]。但很多患者确诊时已处于疾病中期, 单纯外科手术治疗容易复发转移, 远期预后较差。ⅠB~ⅢA期NSCLC占到初诊的NSCLC的50%左右, 虽可进行根治性手术, 但其治疗方案及和预后存在较大差异, 治疗模式一直存在争议, 尤其采用手术治疗ⅢA期NSCLC患者的5年生存率仅36%[2, 3, 4]。所以, 我们需要开发新的辅助策略来优化早期NSCLC患者完全手术切除后的结局。最新版美国国立综合癌症网络指南(National Comprehensive Cancer Network, NCCN)推荐该类患者(TNM:ⅠB~ⅢA)的治疗方法为手术切除/新辅助化疗/辅以PD-L1抑制剂治疗[5]。本文针对改变ⅠB~ⅢA期NSCLC辅助免疫治疗的临床指南的主要研究, IMpower 010研究进行介绍及讨论。
该研究是包括美国、澳大利亚、比利时、中国等22个国家和地区的227个临床中心开展的随机、多中心、Ⅲ期、开放标签的临床试验(NCT02486718)[6]。同时设置了入组标准, 即完全切除的ⅠB(肿瘤≥4 cm)~ⅢA期NSCLC患者, ECOG PS评分为0~1, 接受肺叶切除术/全肺切除术并且能接受含铂化疗。经过严格的筛选纳入共1 269例患者, 1 005例患者以1:1随机分组, 其中阿特珠单抗组12例, BSC组3例没有接受指定的干预, 剩余990例患者, 495例接受阿特珠单抗, 495例接受BSC。患者在术后28~84天进入入组阶段, 患者接受4种以顺铂为基础的辅助化疗方案中的其中1种, 并进行4个周期的治疗。阿特珠单抗剂量为1 200 mg, q3w, 持续16个周期或一年。BSC包括观察和定期扫描监控疾病复发。评价指标中, 主要终点指标包括无病生存期。次要终点指标包括意向性治疗人群的总生存期、3年无病生存率、5年无病生存率、不同亚组无病生存率、安全性等。该研究从2015年10月31日至2027年12月17日, 历时12年之久, 该研究报告为5年中期报告。
结果显示, 实际上入组Ⅱ~ⅢA期NSCLC患者882例。在对Ⅱ~ⅢA期人群中位随访32.2个月后, 与BSC相比, 阿特珠单抗显著延长了DFS。PD-L1表达≥1%的Ⅱ~ⅢA期患者:疾病进展或死亡风险降低34%(分层HR 0.66, 95%CI 0.50~0.88), 3年无病生存率更高(60.0% vs. 48.2%)。所有Ⅱ~ⅢA期患者:疾病进展或死亡风险降低21%(分层HR 0.79, 95%CI 0.64~0.96), 3年无病生存率更高(55.7% vs. 49.4%)。所有ITT人群(ⅠB~ⅢA期):疾病进展或死亡风险降低19%(分层HR 0.81, 95%CI 0.67~0.99), 3年无病生存率更高(57.9% vs. 52.6%)。PD-L1表达≥50%的Ⅱ~ⅢA患者:初步数据显示死亡风险降低57%(未分层HR 0.43)。综上得出结论:手术完全切除Ⅱ~ⅢA期NSCLC患者在辅助化疗后接受阿特珠单抗治疗的DFS获益优于BSC, 而且在PD-L1≥1%的亚组中优势更明显。
免疫治疗及分子靶向治疗逐渐成为治疗NSCLC的新方式, 如针对选择性的表皮生长因子受体突变(epithermal growth factor receptor, EGFR)和间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)融合基因阳性/ROS1融合基因阳性的NSCLC患者, 可分别采用酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)及克唑替尼治疗[7, 8]。阿特珠单抗作为免疫治疗药物, 2016年被美国食品药品监督管理局(Food and Drug Administration, FDA)批准上市治疗NSCLC。该药在美国可用于转移性NSCLC含铂方案化疗期间或之后病情进展, EGFR突变/ALK阳性经TKI等治疗后的二线治疗[9, 10]。所以在该研究中, 选择了手术切除+辅助化疗后进行阿特珠单抗治疗。除了PD-L1抑制剂药物选择, 研究在全球范围展开随机、多中心、Ⅲ期、开放标签的临床试验(n=1 269), 范围广、样本量大, 且经过严格的样本筛选和统一的指标录入采集, 试验设计合理、严谨, 整体上属于质量高的随机对照临床研究。既往未检索到已发表的相类似临床研究。
此外, 本研究也有一定的不足之处:虽然为随机、多中心研究, 但是一组开放标签的临床试验, 缺少双盲的试验设计, 这可能对试验结果产生一定的影响。从结果来看, 实验组的不良反应事件较多。相对于对照组, 阿特珠单抗组的NSCLC患者发生3~4级、5级等严重不良反应、导致治疗中止、导致剂量变动、免疫相关不良事件等人数比例均有不同程度的升高, 两组间具有显著的统计学差异。针对治疗的安全性还需要全面的评估。
作为PD-L1抑制剂中的新型药物, 阿特珠单抗的疗效及安全性研究近年来不断深入, 其潜在应用价值引起了肿瘤学、免疫学乃至医学生物学领域的广泛关注。近年来研究表明, PD-L1抑制剂在NSCLC手术切除/新辅助化疗后的治疗中具有重要作用, 但具体的调控机制尚未明确, 因此对NSCLC相关综合治疗的深入研究意义重大, 有望对NSCLC的突破现有治疗提供一个新的方向。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|