| 朱正飞,复旦大学附属肿瘤医院放疗科主任医师,博士生导师,复旦大学附属肿瘤医院临床研究中心主任,复旦大学胸部肿瘤研究所副所长。中国抗癌协会肺癌专业委员会委员,中国抗癌协会肿瘤放射治疗专业委员会委员,中国临床肿瘤学会(CSCO)青年委员会常务委员,CSCO非小细胞肺癌专业委员会委员,中国医药教育学会肿瘤放疗专业委员会副主任委员会委员,《Front Oncol》杂志副编辑(associate editor),《中国肺癌杂志》青年编委。主要从事胸部肿瘤放射治疗及综合治疗相关的临床与基础工作。2012年3月至2014年3月在美国MD Anderson肿瘤中心放疗科以访问学者身份学习两年。入选上海市浦江人才计划和上海市卫健委“医苑新星”杰出青年医学人才培养计划。以项目负责人身份承担国家自然科学基金(面上项目)、教育部留学回国人员科研启动基金、上海市自然基金、上海市卫计委课题(面上项目)等课题项目共10余项。以第一作者/通讯作者身份发表文章50余篇,其中SCI收录论文40余篇。获上海市抗癌科技奖一等奖(第一完成人)。 |
Wu Y, Zhou Q, Chen M, et al. LBA43 - GEMSTONE-301: A randomized, double-blind, placebo-controlled, phase 3 study of sugemalimab in patients with unresectable stage Ⅲnon-small cell lung cancer (NSCLC) who had not progressed after concurrent or sequential chemoradiotherapy (CRT)[J]. Ann Oncol, 2021, 32(5S):S1283-S1346.
Zhou Q, Chen M, Jiang O, et al. Sugemalimab versus placebo after concurrent or sequential chemoradiotherapy in patients with locally advanced, unresectable, stage Ⅲnon-small-cell lung cancer in China (GEMSTONE-301): Interim results of a randomised, double-blind, multicentre, phase 3 trial[J]. Lancet Oncol, 2022, 23(2):209-219.
1b。
自从PACIFIC临床研究结果公布后, 同步放化疗后免疫巩固治疗已成为不可手术Ⅲ期非小细胞肺癌(non-small cell lung cancer, NSCLC)的标准治疗。但是, PACIFIC研究也给我们留下了一个重要的问题, 序贯化放疗的患者是否也有相同获益?在实际临床工作中, 因为患者自身原因或医疗资源的差异等原因, 近50%的患者不能接受同步放化疗而只能接受序贯化放疗。因此, 验证序贯化放疗后免疫巩固治疗是否仍有生存获益显得尤为重要。
验证舒格利单抗作为同步或序贯放化疗后的免疫巩固治疗是否可提高不可手术Ⅲ期NSCLC患者的生存。
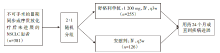
• 研究方法:中国50家中心参与的多中心、双盲、随机对照、Ⅲ期GEMSTONE-301临床试验(NCT03728556)。
• 研究对象:主要入组条件包括不可手术的Ⅲ期非小细胞肺癌行同步或序贯放化疗后未进展的患者, ECOG PS 0~1分, 没有驱动基因突变(EGFR, ALK, ROS1)。分层因素:ECOG PS(0 vs. 1), 放化疗方式(同步 vs. 序贯), 放疗总剂量(<60 Gy vs. ≥60 Gy)。
• 干预措施:GEMSTONE-301研究设计流程见图1。
• 评价指标:主要研究终点包括由盲法独立中央审查(blinded independent central review, BICR)判断的无进展生存期(progression-free survival, PFS)[根据实体瘤评价标准(Response Evaluation Criteria In Solid Tumors, RECIST)v1.1]; 次要研究终点包括:由研究者判断的PFS, 总生存(overall survival, OS), 客观缓解率(objective response rate, ORR), 反应持续时间(duration of response, DoR), 安全性, 至死亡或远处转移时间(time to death/distant metastasis, TTDM), 药物动力学等。
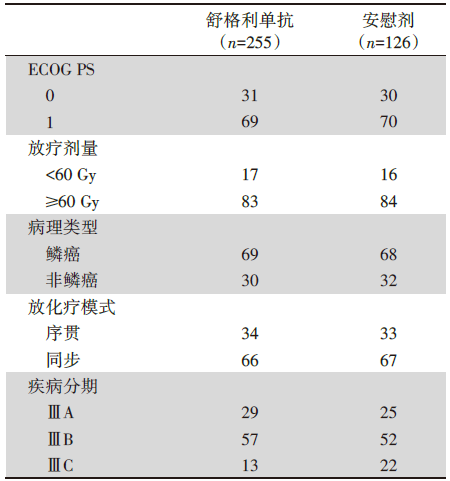
全国共50家中心成功入组381例患者, 患者基本特征见表1。
| 表1 入组患者基本特征 (%) |
本研究的患者有以下主要特点:约1/3的患者接受了序贯化放疗, 绝大多数为鳞癌患者, 绝大多数为ⅢB期患者。
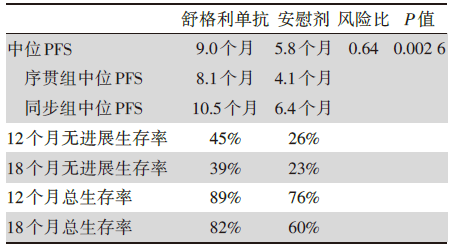
经过14个月的中位随访时间, 中期生存分析如下, 见表2。
| 表2 中期生存分析 |
以上结果可见舒格利单抗无论是在同步放化疗后还是序贯放化疗后使用, 与对照组相比, 都有显著的PFS生存获益。OS的数据仍未成熟, 但可以看见舒格利单抗生存获益的趋势。
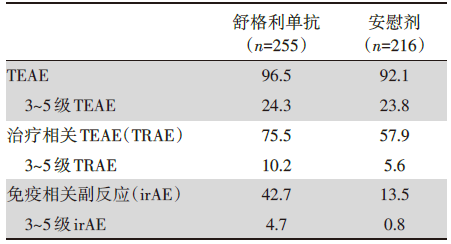
安全性分析发现两组患者出现不良事件的比例无明显差异。治疗引发不良事件(treatment emergent adverse events, TEAE)发生情况见表3。
| 表3 不良事件发生率(%) |
本研究发现在同步或序贯放化疗后使用舒格利单抗的患者与安慰剂对比, PFS有显著的提高, 同时, 有较好的耐受性。舒格利单抗可作为不可手术的Ⅲ期NSCLC接受同步或序贯放化疗后无进展人群的免疫巩固治疗。
初诊时即为Ⅲ期NSCLC的患者约占全部NSCLC的1/3[1], Ⅲ期NSCLC异质性高, 5年生存率从36%到13%不等[2]。对于Ⅲ期不可切除的患者, 放疗是主要治疗手段, 过去30年间, 围绕放疗开展的治疗不断革新。1990年《New Engl J Med》发文论证:相比单纯放疗, 序贯放化疗(sequential chemoradiotherapy, sCRT)有显著的OS获益, 中位OS分别为13.8个月和9.7个月[3]; 1992年《New Engl J Med》再次发文论证:相比单纯放疗, 同步放化疗(concurrent chemoradiotherapy, cCRT)亦有显著的OS获益, 3年总生存率分别为16%和2%[4]; 2010年《J Clin Oncol》对cCRT和sCRT进行了荟萃分析, 结果提示:相比sCRT, cCRT有显著的OS获益, HR值0.84, P值0.004, 5年总生存率提高4.5%, 虽然3级及以上急性食管毒性亦有显著增加, cCRT还是成为了标准治疗方案[5]; 而后在cCRT的基础上进行了多种优化探索, 包括cCRT后使用巩固化疗、cCRT前使用诱导化疗、对比不同的化疗方案或更高的放疗剂量, 但均无法进一步提高cCRT的OS, 直到PACIFIC研究横空出世。
PACIFIC研究纳入cCRT后未发生疾病进展的Ⅲ期不可切除NSCLC患者进行免疫巩固治疗, 结果证明度伐利尤单抗巩固治疗有显著的PFS和OS获益[6], 2021年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)公布的最新数据提示, 度伐利尤单抗巩固治疗的5年总生存率可达43%, 绝对值提高9%, OS和PFS的HR值分别为0.72(0.59~0.89)和0.55(0.45~0.68), 与既往结果一致[7]; 基于PACIFIC研究, cCRT后免疫巩固治疗已成目前新的标准治疗方案[8]。值得注意的是:在PACIFIC研究中, 患者在完成cCRT后入组, 且要求未发生疾病进展, 还需要他们在放化疗后仍有0分或1分的体能状态, 可以说PACIFIC研究纳入的是一群更适合该方案的患者; 其次, 在真实世界中, cCRT的使用率仅30%~55%[9, 10, 11, 12], 主要受限于cCRT的毒性, 导致很多患者无法耐受和依从, 而sCRT是中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)指南推荐的替代治疗方案; 再次, PACIFIC研究中亚裔患者较少(26.9%), ⅢA期患者(52.9%)和非鳞癌(54.3%)较多, 是否可外推至中国患者, 是否符合中国的临床实践犹未可知; 最后, 虽然PACIFIC模式已成标准治疗方案, 但目前有且仅有PACIFIC研究一个Ⅲ期研究的结果, 我们还需要更多的Ⅲ期研究加以验证。
GEMSTONE-301是吴一龙教授牵头设计并开展的全球第一个探索cCRT和sCRT后免疫巩固治疗的Ⅲ期注册随机对照临床研究, 达到了主要研究终点, 对于cCRT和sCRT后未发生疾病进展的患者使用舒格利单抗或安慰剂巩固治疗, PFS分别为9.0个月和5.8个月, HR值0.64, P值0.002 6, 有显著的PFS获益, OS尚未成熟[13, 14]; GEMSTONE-301是个特点鲜明的研究, 它的出现填补了PACIFIC研究的诸多“空白”。该研究最大的特点就是, 除了PACIFIC研究覆盖的cCRT患者外, 还纳入了大部分患者更易耐受的sCRT, 覆盖人群更广, 也更符合中国的临床实践; 其次, GEMSTONE-301研究排除了东亚人群更易发生的EGFR/ALK等突变, 减少了这部分患者可能带来的异质性; 最后, GEMSTONE-301研究纳入了sCRT的患者, 而此类患者相对预后较差, 因此研究中给予了患者2年的免疫巩固治疗, 而非PACIFIC研究中的1年。
GEMSTONE-301研究中, 最值得我们思考的问题是与PACIFIC研究的PFS差异, 虽然不同研究间直接对比没有意义, 但还是会引起我们的反思。首先, 基线的不同可能导致了最终PFS的不同, 在GEMSTONE-301研究中, 纳入了更多预后较差的患者, 比如更多的ⅢB期患者、更多的鳞癌患者; 其次, 在真实世界中, sCRT的患者基数较大, 因此入组也较快, 而cCRT的患者基数较小, 入组也较慢, 因此在第一次分析的时候, 更多的cCRT患者被删失, PFS会被低估, 相信随着数据的进一步成熟, PFS应该会更好; 最后, 虽然GEMSTONE-301研究中cCRT患者的PFS看似较短(10.5个月 vs. 16.8个月), 但两者的HR值非常接近(0.66 vs. 0.52), 18个月的无进展生存率也非常接近(43.5% vs. 44.2%), 均显示出显著的统计学获益和明显的临床获益, 同时考虑到GEMSTONE-301研究入组的患者本身预后欠佳, 因此PFS略短也不足为奇了。
GEMSTONE-301研究结果表明, 无论是cCRT还是sCRT后的Ⅲ期NSCLC患者, 舒格利单抗作为巩固治疗均有显著的疗效和良好的安全性。且随着数据的成熟, 相信PFS还会有增长, 目前OS尚未成熟, 但从趋势来看, 大概率是一个阳性结果。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|