| 刘安文,主任医师、教授、医学博士、博士生导师。南昌大学第二附属医院肿瘤综合诊治中心主任、南昌大学第二临床医学院肿瘤教研室主任、江西省肿瘤临床转化重点实验室主任。兼任江西省研究型医院学会肿瘤学分会主任委员、江西省抗癌协会放疗专业委员会副主任委员、江西省医学会第六届肿瘤学分会副主任委员、江西省抗癌协会第六届理事会副理事长,中国医师协会肿瘤多学科诊疗专业委员会第一届委员会常务委员,中国抗癌协会肺癌专业委员会常务委员,中国抗癌协会放疗专业委员会委员,国家自然科学基金一审专家。 研究方向为胸部肿瘤放化疗的相关临床与基础研究。2013年以访问学者身份在美国MD Anderson癌症中心学习。先后主持国家自然科学基金课题4项,省部级重点科研课题5项及厅级科研课题多项;入选江西省百千万人才工程,江西省卫生系统学术和技术带头人第四批培养对象和江西省高等学校第七批中青年骨干教师,以第一作者/通讯作者在国内外期刊上发表论文50余篇。 |
Jabbour SK, Lee KH, Frost N, et al. Pembrolizumab plus concurrent chemoradiation therapy in patients with unresectable, locally advanced, stage Ⅲnon-small cell lung cancer. The phase 2 KEYNOTE-799 nonrandomized trial[J]. JAMA Oncol, 2021, 7(9):1-9.
2b。
基于PACIFIC研究成果, 同步放化疗后未进展的Ⅲ期不可切除非小细胞肺癌(non-small cell lung cancer, NSCLC)患者接受度伐利尤单抗巩固治疗已成为标准治疗模式。然而22%~30%的Ⅲ期不可切除NSCLC患者因为不可耐受的治疗相关毒性未能完成同步放化疗或同步放化疗后进展进而不能接受度伐利尤单抗的免疫巩固治疗。LUN14-179 Ⅱ期研究证实了同步放化疗后帕博利珠单抗巩固治疗不可切除Ⅲ期NSCLC患者可延长至肿瘤远处转移或者至死亡的时间, 且毒副反应安全可控。免疫治疗前移扩大了接受免疫治疗的比例人群, 可能给更多Ⅲ期不可手术的NSCLC患者带来生存获益。本研究旨在探索帕博利珠单抗联合同步放化疗后帕博利珠单抗巩固治疗在不可手术Ⅲ期NSCLC的疗效及安全性。
评估帕博利珠单抗联合同步放化疗后帕博利珠单抗巩固治疗在不可手术Ⅲ期NSCLC的疗效及安全性。
• 研究条件:基于10个国家(美国、澳大利亚、法国、德国、韩国、新西兰、波兰、俄罗斯、西班牙和英国)的52个学术机构参与的研究(NCT03631784)。
• 研究方法:全球多中心、Ⅱ期、开放标签、多队列、非随机对照临床试验。
• 研究时间:患者入组时间: 2018年11月5日至2020年7月31日; 数据截止时间:2020年10月28日。
• 研究对象:年龄≥18岁, 诊断明确的ⅢA~C期不可切除NSCLC(第八版分期), 患者既往未经治疗, PS 0~1分, 并有足够的肺功能, 既往7天内无系统性免疫抑制治疗史。
• 干预措施:鳞癌患者只入选A队列, 非鳞癌患者可入选A队列或B队列, 由研究者选择化疗药物(见图1)。
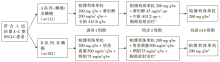 | 图1 KEYNOTE-799研究设计 注:a. 照射总剂量60 Gy(2 Gy/30 F); b. 治疗将至多14周期结束, 或疾病进展、无法耐受的不良事件、妨碍进一步治疗的并发疾病或退出研究。对于发展为≥3级或者复发性2级肺炎的患者, 将永久停止帕博利珠单抗治疗 |
• 评价指标:主要终点指标包括客观缓解率(objective response rate, ORR), ≥3级肺炎的发生率; 次要终点指标包括:无进展生存期(progression-free survival, PFS), 总生存期(overall survival, OS), 安全性等。
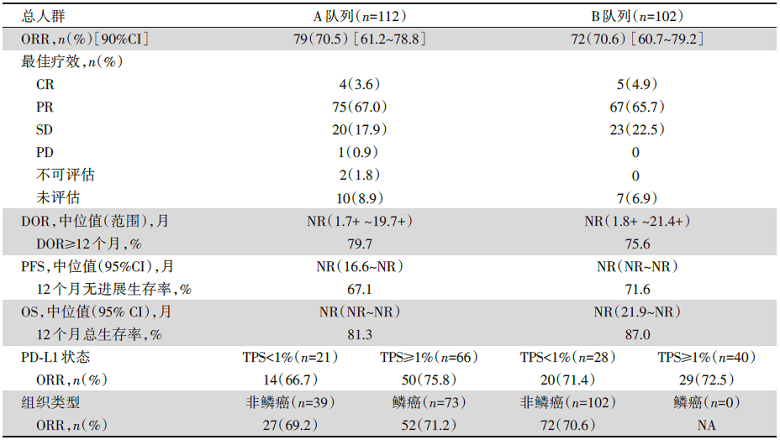
KEYNOTE-799研究共纳入216例患者, 2例退出, 最终队列A和队列B分别入组112例和102例。两个队列首次给药至数据截止时的中位随访时间分别为18.5个月和13.7个月, 治疗持续时间分别为9.1个月和7.7个月。队列A与B的ORR分别为70.5%和70.6%, 疾病控制率(disease control rate, DCR)为88.4%和93.1%。两个队列中, 分别有58.9%和39.2%的患者程序性死亡配体(programmed death ligand 1, PD-L1)表达≥1%。在队列A中, PD-L1<1%和≥1%的患者, ORR分别为66.7%和75.8%; 鳞癌和非鳞癌患者的ORR分别为71.2%和69.2%; 在队列B中, PD-L1 <1%和≥1%的患者, ORR分别为71.4%和72.5%。研究中位PFS及OS均未达到, 1年无进展生存率分别为67.1%和71.6%, 1年总生存率分别为81.3%和87.0%, 见表1。
| 表1 KEYNOTE-799疗效评价及生存数据 |
安全性分析发现, 队列A和队列B任何级别的治疗相关不良反应(adverse event, AE)分别有93.8%和97.1%, 其中, ≥3级肺炎(全因性)发生率分别为8.0%和6.9%, 3~5级治疗相关不良事件(treatment related adverse events, TRAEs)发生率分别为64.3%和50.0%。两队列分别有51.8%和41.2%的患者出现免疫相关的不良反应(immune-related adverse event, irAE), 其中, ≥3级irAE发生率分别为14.3%和8.8%。
不论PD-L1表达状态和肿瘤的组织类型如何, 帕博利珠单抗联合同步放化疗后帕博利珠单抗巩固治疗均显示出良好的抗肿瘤效应, 且毒副反应可控, 对于初治的不可手术切除、Ⅲ期NSCLC患者是一个有前景的治疗策略。
肺癌排在全球肿瘤发病率的第二位, 死亡率排在第一位, 而在中国, 其发病率和死亡率均排在第一位[1]。NSCLC占所有肺癌的85%左右, 其中大约25%初诊时为ⅢA至ⅢC期, 大部分失去手术治疗机会[2]。免疫治疗时代到来前, 含铂双药化疗与放疗同步治疗(concurrent chemoradiation therapy, cCRT)是Ⅲ期不可切除NSCLC患者标准治疗模式[3], 5年生存率在16%~32%之间[4, 5]。为了进一步提高Ⅲ期不可切除NSCLC患者的生存获益, 研究者进行了一系列以同步放化疗为基础的改进治疗方案尝试, 比如:不同的化疗方案[6], 在CRT之前[7, 8]或者之后加上化疗[9, 10], 同步放化疗联合靶向治疗[11, 12], 以及增加放疗剂量[13]等, 但疗效均未获得明显的提升。直至免疫治疗(immunotherapy, IO)时代的到来, PACIFIC研究引起肺癌治疗的“海啸”, 在同步放化疗后未进展的Ⅲ期不可切除NSCLC患者接受度伐利尤单抗巩固治疗, 可以使5年生存率由33.4%提升至42.9%, 并降低了28%的死亡风险, 目前已成为标准治疗模式。
然而22%~30%的Ⅲ期不可切除NSCLC患者因为不可耐受的治疗相关毒性未能完成同步放化疗或同步放化疗后进展进而不能接受度伐利尤单抗的免疫巩固治疗[14, 15]。免疫治疗前移, 同步放化疗时即联合免疫治疗能够覆盖这部分人群, 但是否生存获益仍需进一步探讨。基础研究显示, 放疗能够直接杀伤肿瘤细胞, 释放肿瘤相关性抗原; 放疗还能改善肿瘤微环境, 使“冷肿瘤”转变为“热肿瘤”; 另外, 放疗可以辅助抗原提呈和T细胞募集, 通过以上增加免疫治疗的疗效。PACIFIC研究亚组分析显示, 同步放化疗后与免疫治疗的间隔时间越短(1~14 d vs. 15~42 d), 预后更好, 显示出放疗与免疫的协同作用。KEYNOTE-001回顾性分析发现接受过放射治疗的NSCLC患者使用帕博利珠单抗获得PFS的时间明显长于没有接受过放射治疗的患者, 也预示着帕博利珠单抗与放疗的协同作用。DETERRED研究Part 1与Part 2比较发现, 免疫前移能够进一步提高患者的生存获益[16]。且帕博利珠单抗单药[17, 18]或联合化疗一线治疗晚期或转移性NSCLC患者, 无论PD-L1表达水平, 均明显获益[19, 20, 21]。这些研究结果为KEYNOTE-799研究设计提供了前期基础。
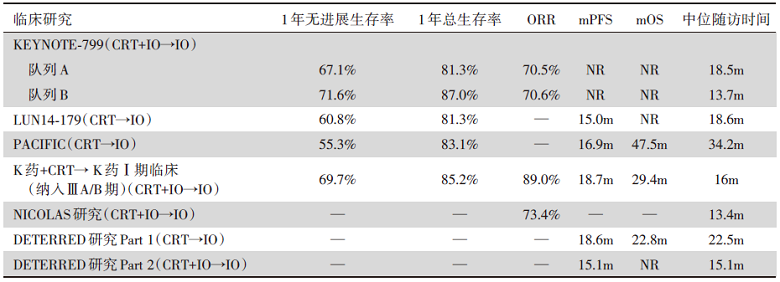
KEYNOTE-799研究疗效上优于同步放化疗后免疫巩固治疗(CRT → IO)相关临床研究, 同时不亚于同步放化疗联合其他免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)后免疫巩固治疗(CRT + IO → IO)(详见表2)。在KEYNOTE-799的2个队列中, 1年无进展生存率分别为67.1%(队列A)和71.6%(队列B), 1年总生存率分别为81.3%(队列A)和87.0%(队列B)。1年无进展生存率较LUN14-179(60.8%)、PACIFIC(55.3%)明显提高; 1年总生存率上3项研究类似(LUN14-179为81.3%; PACIFIC为83.1%)[22]。KEYNOTE-799研究的ORR(队列A:70.5%; 队列B:70.6%)与同步放化疗联合其他ICIs后免疫巩固治疗(CRT+IO→ IO)相当:帕博利珠单抗联合cCRT后免疫维持的Ⅰ期临床试验结果显示ORR为89%(17/19)[23], 该研究只纳入了ⅢA/B期患者, 并未纳入ⅢC期患者; NICOLAS研究结果显示, 纳武利尤单抗联合cCRT治疗, 其ORR为73.4%, 中位DOR为11.0个月[24]; 而DETERRED研究Part 2结果表明, 阿特珠单抗联合cCRT的mPFS为13.2个月, mOS尚未达到[16]。在亚组分析中发现, 无论疾病分期, 肿瘤组织学类型和PD-L1表达如何, 都观察到了KEYNOTE-799治疗方案的临床获益, 而PACIFIC研究PD-L1表达阴性人群是没有获益的。这与帕博利珠单抗联合化疗在PD-L1<1%的晚期NSCLC患者中的Ⅱ期和Ⅲ期试验的结果相似[25]。以上都是小样本的Ⅰ期或Ⅱ期临床研究, 目前也有多项Ⅲ期临床试验开展中, 如KEYLYNK-012、PACIFIC-2、ECOG-ACRIN EA5181、CheckMate 73L研究等, 这些研究结果将为局晚期NSCLC免疫联合同步放化疗的最佳模式提供更多的循证医学证据。
| 表2 免疫前移与单纯免疫巩固疗效比较 |
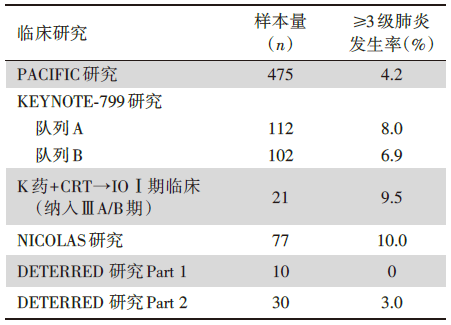
除了有效性外, 治疗相关的不良反应, 特别是肺炎, 是临床医生最为关注的问题[13, 26]。总体而言, KEYNOTE-799研究无新发不良反应事件, 最常见不良反应为免疫性肺炎和放射性肺炎, 其发生率并未明显增加。在PACIFIC研究中, 由于排除了同步放化疗后2级以上肺炎患者入组, 其≥3级肺炎的发生率略低, 为4.2%(20/475)[27]。在KEYNOTE-799中, 两个队列中≥3级肺炎的发生率在ICIs联合cCRT的预期范围内, 队列A为8.0%(9/112), 队列B为6.9%(7/102)。帕博利珠单抗联合cCRT的Ⅰ期临床研究3~5级肺炎的发生率为9.5%(2/21)[23]; 纳武利尤单抗联合cCRT治疗3~5级肺炎的发生率为11.7%(9/77)[24]; 而阿特珠单抗联合cCRT治疗3~5级肺炎的发生率为3.3%(1/30)(详见表3)[16]。
| 表3 临床研究3级及以上肺炎发生率比较 |
虽然KEYNOTE-799研究显示出良好的抗肿瘤效应, 且毒副反应可控, 但其设计存在一定的局限性。首先, 研究为非随机对照试验, 并没有设立标准治疗对照组, 正在进行的Ⅲ期KEYLYNK-012研究(NCT04380636)将弥补这一数据的缺失。其次, 队列B的随访持续时间有限, 因为许多患者仍在接受研究治疗。最后, 由于KEYNOTE-799研究设计是在PACIFIC亚组分析结果公布之前, 因此纳入人群中并未排除驱动基因阳性(EGFR/ALK/ROS1)患者, 而这部分患者是免疫治疗获益的劣势人群[28, 29]。
临床情况复杂多变, 应量体裁衣, 因人而异, 例如:(1)由于同步放化疗的毒性较大, 很多患者都无法耐受。即使PACIFIC研究结果公布之后, 欧美国家也只有60%~70%的Ⅲ期不可切除NSCLC患者能够接受同步放化疗。而在我国, 目前70%以上的医院仍采用序贯放化疗。因此, 序贯放化疗后免疫巩固治疗是否能够获益?值得欣喜的是, 我国吴一龙教授主导的GEMSTONE-301研究[30]提示我们序贯放化疗后免疫巩固治疗是能够获益的, 这种治疗模式也更符合真实世界情况; (2)对于老年或PS评分较差不能耐受化疗患者, 单纯放疗序贯免疫的去化疗模式是否可行?正在开展的DUART(NCT04249362)和TRADE-hypo(NCT04351256)研究将会告诉我们答案; (3)PACIFIC研究的复发模式仍是以局部复发为主, 增加放疗剂量是否能进一步提高局部控制率?RTOG 0617显示提高整体肿瘤的放疗剂量, 有害无益, 但自适应放疗技术增加PET-CT显示残留肿瘤区域剂量似乎能够带来获益(PET-boost:NCT02788461; RTOG 1106/ACRIN-6697:NCT01507428), 免疫治疗时代自适应放疗技术的应用是否能够进一步提高局部控制率及OS值得探索; (4)对于驱动基因阳性(EGFR/ALK/ROS1)Ⅲ期不可切除NSCLC患者, PACIFIC亚组突变人群及多个小样本回顾性研究分析同步放化疗后免疫治疗并不能获益, 是免疫治疗获益的劣势人群, 靶向治疗是其重要治疗手段, RECEL研究[31]显示厄洛替尼联合放疗对比同步放化疗能够获得PFS的获益, 同步放化疗后靶向维持治疗相关的Ⅲ期临床研究开展中(NCT03521154; NCT03396185; NCT04951635); (5)对于体力状态好, 免疫联合新型药物已初显成效(如COAST研究:NCT03822351), 值得我们期待。
总之, KEYNOTE-799研究结果表明, 帕博利珠单抗联合同步放化疗对于既往未经治疗的局部晚期Ⅲ期NSCLC患者有良好的抗肿瘤活性, 且安全性可控。至于应用于临床, 还有待Ⅲ期临床试验的结果公布。Ⅲ期不可切除NSCLC是一组异质性比较强的疾病群体, 未来需充分考虑患者一般体力状态、肿瘤大小、淋巴结累及范围、分子亚型等因素, 经多学科团队协作, 制定个体化精准治疗模式。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|