肖京(1984-),男,河南南阳人,医学硕士,主治医师,研究方向为脓毒症的诊治。Tel:0377-61660298,E-mail:liyou741lian@163.com。
目的 观察乌司他丁对脓毒症大鼠急性肺损伤的保护作用及具体作用机制。方法 80只大鼠随机分为假手术组、模型组、乌司他丁组、抑制剂组、乌司他丁+抑制剂组,各16只。乌司他丁+抑制剂组腹腔注射乌司他丁20 000 U/kg、solasodine 50 mg/kg;乌司他丁组腹腔注射乌司他丁20 000 U/kg、等量含5% DMSO生理盐水;抑制剂组腹腔注射solasodine 50 mg/kg、等量生理盐水;模型组与假手术组腹腔注射等量生理盐水、含5% DMSO的生理盐水。检测肺组织湿重/干重(wet weight to dry weight,W/D)比值;ELISA法检测肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素-6(interleukin 6,IL-6)、IL-10;HE染色观察肺组织病理学,评估肺损伤得分;TUNEL染色观察肺组织细胞凋亡;western blot检测磷酯酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶B(protein kinase B,Akt)、p-Akt、雷帕霉素靶蛋白(rapamycin target protein,mTOR)、p-mTOR蛋白相对表达量。结果 与假手术组比较,模型组、乌司他丁组、抑制剂组、乌司他丁+抑制剂组W/D值、TNF-α、IL-6、细胞凋亡率升高,IL-10降低,且W/D值、TNF-α、IL-6、细胞凋亡率,抑制剂组>模型组>乌司他丁+抑制剂组>乌司他丁组,IL-10,抑制剂组<模型组<乌司他丁+抑制剂组<乌司他丁组( P<0.05)。HE染色显示,与模型组、抑制剂组比较,乌司他丁+抑制剂组、乌司他丁组肺组织结构轻度紊乱,出血、水肿、肺泡壁增厚、炎性细胞浸润等异常改变减轻,其中乌司他丁组改善更显著;肺组织病理评分抑制剂组>模型组>乌司他丁+抑制剂组>乌司他丁组>假手术组( P<0.05);与假手术组比较,模型组、乌司他丁组、抑制剂组、乌司他丁+抑制剂组PI3K、p-Akt、p-mTOR蛋白相对表达量降低,乌司他丁组>乌司他丁+抑制剂组>模型组>抑制剂组( P<0.05)。结论 乌司他丁对脓毒症大鼠急性肺损伤有保护作用,机制可能与激活Akt信号通路相关。
Objective To observe the protective effect and mechanism of ulinastatin on acute lung injury in septic rats.Methods Eighty rats were randomly divided into sham operation group, model group, ulinastatin group, inhibitor group, ulinastatin + inhibitor group, 16 rats in each group. Ulinastatin + inhibitor group was intraperitoneally injected with ulinastatin 20 000 U/kg and solasodine 50 mg/kg. Ulinastatin group was intraperitoneally injected with ulinastatin 20 000 U/kg and 5% DMSO saline. In the inhibitor group, solasodine 50 mg/kg and the same amount of normal saline were injected intraperitoneally. The model group and sham operation group were intraperitoneally injected with the same amount of normal saline and normal saline containing 5% DMSO. The ratio of wet weight to dry weight (W/D) of lung tissue was detected, and tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6) and IL-10 were detected by ELISA. HE staining was used to observe lung histopathology and evaluate lung injury score. TUNEL staining was used to observe the apoptosis of lung tissue. Western blot was used to detect the relative expression of phosphatidylinositol 3-kinase (PI3K), protein kinase B (Akt), p-Akt, rapamycin target protein (mTOR) and p-mTOR.Results Compared with the sham operation group, W/D value, TNF-α, IL-6, apoptosis rate of model group, ulinastatin group, inhibitor group and ulinastatin + inhibitor group were increased, while IL-10 was decreased, and W/D value, TNF-α, IL-6, apoptosis rate, inhibitor group > model group > ulinastatin + inhibitor group > ulinastatin group, IL-10, inhibitor group < model group < ulinastatin + inhibitor group < ulinastatin group ( P<0.05). HE staining showed that compared with model group and inhibitor group, ulinastatin + inhibitor group and ulinastatin group had mild disorder of lung tissue structure, less abnormal changes such as bleeding, edema, alveolar wall thickening and inflammatory cell infiltration, especially in ulinastatin group. Pathological score of lung tissue: inhibitor group>model group > ulinastatin + inhibitor group > ulinastatin group > sham operation group ( P<0.05). Compared with the sham operation group, the relative expression of PI3K, p-Akt, p-mTOR protein in model group, ulinastatin group, inhibitor group and ulinastatin + inhibitor group decreased, ulinastatin group > ulinastatin + inhibitor group > model group > inhibitor group ( P<0.05).Conclusions Ulinastatin had protective effect on acute lung injury in sepsis rats, and the mechanism may be related to activation of Akt signaling pathway.
脓毒症是由感染引起的炎性细胞过度分泌炎症介质与细胞因子, 导致免疫功能紊乱、组织器官功能受损的全身炎症综合征, 肺脏是脓毒症患者最先损伤的靶器官之一, 通常会导致患者急性肺损伤, 发病率和病死率均较高, 是研究的热点与难点[1, 2]。乌司他丁是一种对热酸稳定的糖蛋白, 属于库氏类型的丝氨酸蛋白酶抑制剂, 可以减少多种炎症因子的生成和释放, 拮抗炎症反应, 将乌司他丁用于脓毒症可改善感染症状, 但其抑制炎症反应的机制很少报道[3]。本研究通过建立脓毒症急性肺损伤大鼠模型, 观察乌司他丁对脓毒症大鼠急性肺损伤的保护作用及可能机制, 旨在指导临床治疗脓毒症。
1.1.1 实验动物
无特定病原体(specific pathogen free, SPF)级SD(Sprague Dawley)雄性大鼠80只, 4周龄, 体质量(85± 10)g, 由上海杰思捷实验动物有限责任公司提供, 动物生产许可证号:SCXK(沪)2018-0004。大鼠购入后在清洁通风环境中适应性饲养7 d, 保持温度(23± 2)℃, 湿度(60± 5)%, 明暗周期12 h/12 h循环。
1.1.2 主要试剂与仪器
脂多糖(lipopolysaccharide, LPS)(上海源叶生物, 货号:S11060, 规格:100 mg), 乌司他丁(广东天普生化医药股份有限公司, 国药准字H19990133, 规格:10万IU× 1瓶/盒), Akt信号通路抑制剂solasodine(美国MedChem Express公司), 兔抗鼠磷酯酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)单克隆抗体, 兔抗大鼠Akt、p-Akt、雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)、p-mTOR多克隆抗体、辣根过氧化物酶标记的二抗(英国Abcam公司), 肿瘤坏死因子-α (tumor necrosis factor-α , TNF-α )、白细胞介素-6(interleukin-6, IL-6)、IL-10 ELISA试剂盒(美国Sigma公司), DM-35TV光学显微镜(江西道美智能科技有限公司)。
1.2.1 建模与分组
80只大鼠随机分为假手术组、模型组、乌司他丁组、抑制剂组、乌司他丁+抑制剂组, 各16只。除假手术组外, 其他组建立脓毒症急性肺损伤大鼠模型, 采用3%戊巴比妥钠按30 mg/kg腹腔注射进行麻醉, 仰卧固定, 正中切开颈前皮肤, 分离其皮下组织, 暴露气管, 200 μ g/mL脂多糖(lipopolysaccharide, LPS)按0.5 mL/kg注入气管, 注入后快速将大鼠直立旋转, 以便药物均匀分布双肺。其中, 假手术组同样手术, 不注射LPS。
1.2.2 干预方法
建模1 h后, 乌司他丁+抑制剂组腹腔同时注射乌司他丁20 000 U/kg(溶于5 mL生理盐水中)和solasodine 50 mg/kg(溶于DMSO中, 用生理盐水稀释, 使DMSO含量为5%); 乌司他丁组腹腔同时注射乌司他丁20 000 U/kg与等量含5% DMSO的生理盐水; 抑制剂组腹腔同时注射solasodine 50 mg/kg与等量生理盐水; 模型组与假手术组腹腔同时注射等量生理盐水与含5% DMSO的生理盐水。
1.2.3 组织取材
干预24 h, 各组大鼠注射3%戊巴比妥钠30 mg/kg麻醉后, 仰卧固定, 颈胸部去毛, 剖开颈部与胸腔, 分离肺脏, 用生理盐水冲洗双肺, 擦干表面液体, 备用。
1.2.4 肺湿重/干重(wet weight to dry weight, W/D)比值
取左肺(5只), 称量湿重后, 转移至65 ℃烘箱干燥48 h, 称量干重, 计算湿重/干重(W/D)比值。
1.2.5 TNF-α 、IL-6、IL-10水平检测
取左肺组织(5只)称重, 剪碎, 放入玻璃匀浆管中, 准备体积为组织块重量9倍的生理盐水, 提前预冷。将生理盐水倒入匀浆管中, 捣杆上下转动研磨10次(6~8 min), 充分研碎, 使组织匀浆化, 将制备好的10%匀浆用低温离心机3 000 r/min(离心半径8 cm), 离心15 min, 取上清液, 按照TNF-α 、IL-12、IL-18 ELISA试剂盒说明书加样, 用全自动酶标仪测定450 nm处的吸光度(A)值, 通过绘制标准曲线得出TNF-α 、IL-6、IL-10的浓度。
1.2.6 肺组织病理学变化及肺损伤评分
取大鼠右肺(5只), 4%多聚甲醛固定48 h, 常规脱水、石蜡包埋、切片(厚度4 μ m), HE染色, 中性树脂封片, 显微镜下观察大鼠肺组织病理学变化。肺损伤评分标准[4]:(1)肺组织中白细胞浸润范围:无浸润=0分, 小于25%=1分, 25%~50%=2分, 50%~75%=3分, 75%~100%=4分; (2)肺泡腔内白细胞数量:无白细胞=0分, 偶有白细胞=1分, 大量白细胞=2分, 几乎充满白细胞=3分, 被白细胞充满且扩张=4分; (3)肺泡腔渗出物:无渗出物=0分, 偶有渗出物=1分, 清晰可见渗出物=2分, 几乎充满渗出物=3分, 被渗出物充满并扩张=4分。得分越高, 病理变化越严重。每张切片取5个视野, 求平均值作为病理评分。
1.2.7 TUNEL染色观察肺组织细胞凋亡
取大鼠右肺(5只), 4%多聚甲醛固定, 常规脱水、石蜡包埋、切片(厚度4 μ m), 切片后脱蜡, 0.3% H2O2浸泡5 min, PBS清洗5 min× 2次; 蛋白酶K 37 ℃处理30 min, PBS清洗5 min× 3次; TUNEL反应液37 ℃染色60 min, PBS清洗5 min× 3次; 3% BSA处理20 min, PBS清洗5 min× 3次; POD转换液37 ℃湿盒处理30 min, PBS清洗5 min; DAB显色5 min, 苏木素复染, 脱水、透明、封片, 显微镜下观察, 每张切片选取5个视野, 计算凋亡率, 凋亡率=凋亡细胞数/细胞总数× 100%。
1.2.8 Western blot检测肺组织PI3K、Akt、p-Akt、mTOR、p-mTOR蛋白相对表达水平
取肺组织80 mg, 液氮速冻后冰上研磨, 加入蛋白提取裂解液, 冰上裂解, 离心, 取上清, BCA法进行蛋白定量, 100 ℃水浴使蛋白变性, 进行SDS-PAGE凝胶电泳, 电转至PVDF膜, 5%脱脂牛奶室温封闭2 h, 洗膜后加入1:1 000稀释的PI3K、Akt、p-Akt、mTOR、p-mTOR一抗, 4 ℃孵育过夜, 洗膜后加入1:4 000辣根过氧化物酶标记的二抗, 室温孵育1 h, 洗膜后加入ECL发光液显影, 采用Image J软件分析图像, 以β -actin为内参, PI3K、Akt、p-Akt、mTOR、p-mTOR相对表达量用蛋白条带灰度值/β -actin蛋白条带灰度值表示。
采用SPSS 25.0统计学软件分析数据, 计量资料用均数 ± 标准差(x ± s)表示, 多样本计量资料比较采用单因素方差分析, 两两样本比较采用LSD-t检验。P< 0.05为差异有统计学意义。
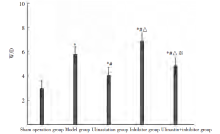
W/D值组间比较, 差异有统计学意义(P< 0.05)。与假手术组比较, 模型组、乌司他丁组、抑制剂组、乌司他丁+抑制剂组W/D值升高, 抑制剂组> 模型组> 乌司他丁+抑制剂组> 乌司他丁组。见图1。
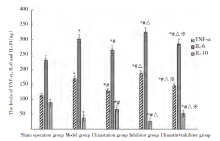
TNF-α 、IL-6、IL-10水平组间比较, 差异有统计学意义(P< 0.05)。与假手术组比较, 模型组、乌司他丁组、抑制剂组、乌司他丁+抑制剂组TNF-α 、IL-6水平升高, IL-10水平降低, 且TNF-α 、IL-6水平, 抑制剂组> 模型组> 乌司他丁+抑制剂组> 乌司他丁组, IL-10水平, 抑制剂组< 模型组< 乌司他丁+抑制剂组< 乌司他丁组。见图2。
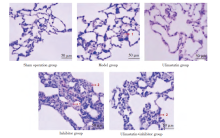
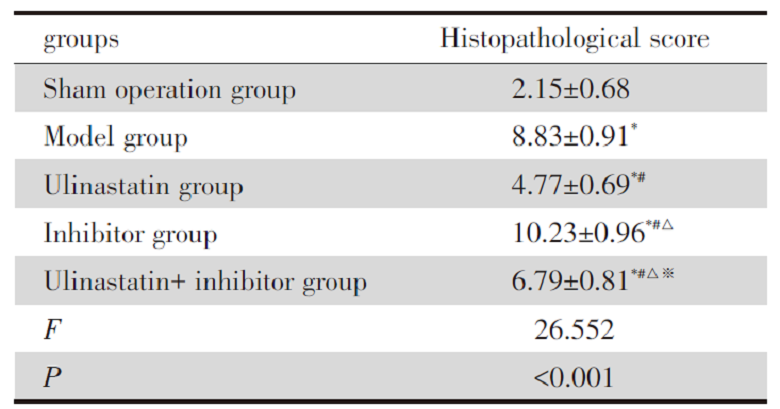
HE染色显示, 假手术组肺组织结构正常, 无水肿出血, 肺泡腔清晰无渗出物。模型组和抑制剂组肺组织结构紊乱, 水肿、出血, 肺泡壁增厚, 大量中性粒细胞浸润。与模型组、抑制剂组比较, 乌司他丁+ 抑制剂组、乌司他丁组肺组织结构轻度紊乱, 出血、水肿、肺泡壁增厚、炎性细胞浸润等异常改变减轻, 其中乌司他丁组改善更显著。肺组织病理评分抑制剂组> 模型组> 乌司他丁+ 抑制剂组> 乌司他丁组> 假手术组(P< 0.05)。见表1, 图3。
| 表1 肺组织病理学评分 (x ± s, n=5, 分) Tab.1 Histopathological score of lung (x ± s, n=5, score) |
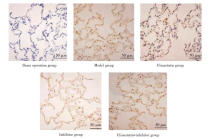
假手术组、模型组、乌司他丁组、抑制剂、乌司他丁+抑制剂组肺组织细胞凋亡率分别为:(2.89± 2.18)%、(37.42± 3.12)%、(13.61± 2.96)%、(48.87± 3.35)%、(25.76± 3.01)%。肺组织细胞凋亡率组间比较, 差异有统计学意义(P< 0.05)。与假手术组比较, 模型组、乌司他丁组、抑制剂组、乌司他丁+抑制剂组细胞凋亡率升高, 抑制剂组> 模型组> 乌司他丁+抑制剂组> 乌司他丁组(P< 0.05)。见图4。
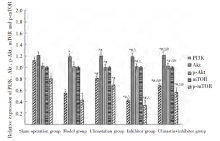
PI3K、p-Akt、p-mTOR蛋白相对表达量组间比较, 差异有统计学意义(P< 0.05); Akt、mTOR蛋白相对表达水平组间比较, 差异无统计学意义(P> 0.05)。与假手术组比较, 模型组、乌司他丁组、抑制剂组、乌司他丁+抑制剂组PI3K、p-Akt、p-mTOR蛋白相对表达量降低, 乌司他丁组> 乌司他丁+抑制剂组> 模型组> 抑制剂组(P< 0.05)。见图5, 图6。
脓毒症是一种失控性炎症反应, 肺组织浸润大量炎症细胞, 一方面启动TNF-α 级联反应, 在肺部聚集大量中性粒细胞, 促进其他炎症因子释放, 引起肺损伤, 另一方面中性粒细胞释放弹性蛋白酶, 促进大量中性粒细胞进入肺组织, 引起肺水肿, 蛋白渗漏, 加剧肺损伤[5, 6]。LPS直接刺激中性粒细胞释放炎症介质与弹性蛋白酶, 是导致脓毒症急性肺损伤的重要病原分子, 快速有效地控制或减轻肺部过度炎症反应是治疗的关键[7]。乌司他丁是一种从健康成年男性尿液中提取出来的糖蛋白, 它作为生理活性物质参与炎症部位的修复并且维持内环境稳态, 具有抗炎、抗氧化的作用[8]。
乌司他丁是一种广谱的蛋白酶抑制剂, 具有抑制细胞凋亡的作用, 同时能够抑制多种炎症介质释放, 清除氧自由基。研究发现[9], 乌司他丁能够抑制TNF-α 、IL-6的分泌, 抑制中性粒细胞与内皮细胞黏附, 减轻内皮损伤, 抑制免疫炎症级联反应。还有报道显示[10], 乌司他丁通过抑制弹性蛋白酶及炎性因子的活性, 发挥对急性肺损伤的治疗作用。临床研究发现乌司他丁通过抑制炎症介质释放, 预防细胞因子级联反应, 抑制白细胞过度激活, 阻断三者间的恶性循环, 对全身炎性反应疾病的肺损伤发挥保护作用[11]。本研究发现, 乌司他丁给药后大鼠肺组织W/D值降低, TNF-α 、IL-6水平降低, IL-10水平升高, HE染色显示肺组织结构紊乱、出血、水肿、肺泡壁增厚、炎性细胞浸润等异常改变明显改善, 这提示乌司他丁可减轻脓毒症急性肺损伤大鼠炎性反应, 缓解肺水肿, 减轻肺损伤。
PI3K/Akt/-mTOR通路是一种典型信号通路, 在多种炎症相关疾病发生发展中发挥重要作用。其中PI3K参与调节细胞增殖、分化、凋亡和葡萄糖转运等, 激活后在质膜上产生第二信使磷脂酰基醇-3-磷酸, 磷酸化Akt蛋白的Ser308, 导致Akt活化。活化的Akt磷酸化下游多种酶、激酶和转录因子, 调节细胞功能。mTOR是PI3K/Akt下游的丝氨酸-苏氨酸蛋白激酶, 通过激活核糖体激酶, 调节细胞增殖、存活和侵袭转移[12, 13]。研究发现[14], 电针处理急性肺损伤兔, p-Akt蛋白表达上调, 肺损伤减轻, 炎性因子水平降低, 提示电针对急性肺损伤发挥保护作用, 与PI3K/Akt/Nrf2信号通路水平有关。田婧等[15]发现PI3K/Akt信号通路激活可介导自噬, 参与脓毒症小鼠急性肺损伤时的内源性保护机制。这些研究均提示, PI3K/Akt/-mTOR信号通路可能在脓毒症急性肺损伤大鼠病情控制中发挥一定作用。本研究中结果显示, 乌司他丁给药后大鼠PI3K、p-Akt、p-mTOR相对表达量升高, 且经进一步应用通路抑制剂验证, 这提示乌司他丁可激活PI3K/Akt/-mTOR信号通路, 以抑制炎症细胞过度活化, 减轻炎症反应, 推测这是其发挥对脓毒症大鼠急性肺损伤保护作用的重要机制之一。
综上所述, 乌司他丁对脓毒症大鼠急性肺损伤具有保护作用, 且可能是通过激活Akt信号通路发挥作用, 为临床脓毒症急性肺损伤提供理论依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|