张可(1984-),男,河南永城人,主治医师,医学本科,主要研究方向为鼻咽喉头颈外科。
目的 研究微管相关蛋白(targeting protein for Xenopus kinesin-like protein 2,TPX2)在鼻咽癌增殖和转移中的作用及可能的分子机制。方法 构建TPX2siRNA质粒,同时设置空载对照,转染人鼻咽癌细胞CNE2Z,采用CCK-8检测细胞增殖情况,Transwell试验检测细胞的迁移和侵袭能力,Western blot法检测细胞周期相关蛋白表达情况和EMT标志物的表达变化。结果 TPX2siRNA转染能够显著抑制CNE2Z细胞中TPX2的表达,CCK-8分析发现TPX2的干扰会显著抑制CNE2Z细胞增殖,Western blot分析发现细胞周期蛋白中cyclinD1、cyclinE下调,p27上调;Transwell试验分析发现TPX2的干扰会显著抑制细胞的侵袭;Western blot分析发现TPX2干扰后,EMT通路相关指标检测分析发现上皮细胞分子标志物E-cadherin上调,间质细胞分子标志物Vimentin-N下调。结论 TPX2抑制了CNE2Z细胞的增殖、迁移、侵袭,随着TPX2在鼻咽癌中调控机制的深入研究,TPX2有望成为鼻咽癌诊断和治疗的新靶点。
Objective To investigate the role of microtubule-associated protein (targeting protein for Xenopus kinesin-like protein 2, TPX2) in the proliferation and metastasis of nasopharyngeal carcinoma and its possible molecular mechanism. Methods The TPX2siRNA plasmid was constructed, and a no-load control was set at the same time. The cells were transfected into human nasopharyngeal carcinoma cells CNE2Z. The cell proliferation was detected by CCK-8 and the cell proliferation was detected by the Transwell test. The expression of cell cycle related proteins and EMT markers were detected by Western blot. Results TPX2siRNA transfection can significantly inhibit the expression of TPX2 in CNE2Z cells. CCK-8 analysis found that the interference of TPX2 significantly inhibited the proliferation of CNE2Z cells. Western blot analysis showed that cyclinD1 and cyclinE were down-regulated and p27 was up-regulated in cyclin. Transwell test analysis found that interference of TPX2 can significantly inhibit cell invasion. Western blot analysis showed that after TPX2 interference, EMT pathway related indicators analysis showed that the epithelial cell molecular marker E-cadherin was up-regulated, and the stromal cell molecular marker Vimentin-N was down-regulated. Conclusions TPX2 has an important effect on the proliferation, migration, and invasion of CNE2Z cells. With the further study of the regulation mechanism of TPX2 in nasopharyngeal carcinoma, TPX2 was expected to become a new target for diagnosis and treatment of nasopharyngeal carcinoma.
鼻咽癌是发生在鼻咽粘膜上皮一种常见的上皮恶性肿瘤, 在东南亚国家以及我国南方沿海地区高发, 其发病主要与遗传和环境等多种因素有关[1]。目前鼻咽癌的临床治疗方法较多, 但是患者的长期生存率和生活质量未得到明显改善[2]。鼻咽癌患者出现预后不良的主要原因是出现局部的复发和全身转移。放疗和化疗虽然能够有效抑制鼻咽癌的发展, 但是具有明显的副作用, 降低患者的生活质量[3]。深入研究鼻咽癌细胞增殖和迁移的分子机制对有效控制疾病的发生和发展, 改善预后具有重要的作用。
微管相关蛋白(targeting protein for Xenopus kinesin-like protein 2, TPX2)是Xklp2的靶蛋白, 是一种微管相关蛋白[4]。Yan L[5]在爪蟾卵提取物实验的基础上首次提出了TPX2在纺锤体装配中的作用, 其表达和分布受细胞周期的严格调控, 与体内多种有丝分裂因子相互作用, 在细胞有丝分裂纺锤体形成过程中发挥重要功能。研究表明[6], 人类多种肿瘤中都存在TPX2的过表达, 其过量表达影响纺锤体的正常形成与分离, 导致异倍体的形成, 并有实验表明其与肿瘤的侵袭性和预后相关。目前, TPX2已作为一种新的候选癌基因被广泛关注, 对其进行深入的研究, 不仅有助于肿瘤的早期诊断、预后判断, 更能提供新的肿瘤治疗途径, 促进个体化治疗方案的选择, 为人类抗肿瘤治疗提供新的思路与方法。但是TPX2对鼻咽癌细胞增殖和转移的研究较少, 生物学功能和可能的机制尚不清晰。本研究意在探讨TPX2在鼻咽癌增殖及转移中的作用和分子机制, 为鼻咽癌患者的治疗提供新的靶点。
鼻咽癌细胞系CNE2Z购自美国ATCC公司, 由郑州大学附属儿童医院实验室保存; 胎牛血清; RPMI1640和DMEM培养基(Gibco公司); 二甲基亚砜(DMSO)(美国Sigma公司); CCK8、碘化丙啶、多聚甲醛(碧云天生物技术公司); ECL发光液(Thermo Fisher Scientific公司); Annexin VIFITC/PI细胞凋亡检测试剂盒(博谷生物科技有限公司); matrigel(美国Conrning公司); 反转录试剂盒(TaKaRa公司); SYBR、supermix(诺唯赞公司); Western Blot试剂(上海生工生物工程公司); 蛋白marker(NEB公司); Transwell小皿(Corning公司); TPX2抗体、β -actin、P21抗体(Abcam公司)、TPX2siRNA(吉码制药有限公司), 经本课题前期实验证明后, 选取1条最为有效靶点序列, 正义链:5′ -GCGAGAAUCAAAGAAGAAATT-3′ , 反义链:5′ -UUUCUUCUUUGAUUCUCGCTT-3′ [7]; 其他试剂为国产分析纯。
CNE2Z细胞常规培养于10%胎牛血清的RPMI-1640的培养基中, 37℃、5% CO2培养, 每隔2~3天观察细胞生长状况, 待细胞融合度达到80%以上时, 用0.25%胰蛋白酶消化, 传代。
设立TPX2siRNA转染组和空白转染组, 细胞株选择方面, 在多个鼻咽癌细胞及永生化上皮细胞株中检测TPX2表达, 筛选TPX2高表达的细胞系进行干扰实验, 细胞消化铺96孔板, 每孔细胞数量为5×103个, 体积100 μ L, 每组设定5个复孔, 于37℃、5% CO2培养箱培养24 h, 弃去培养基, 每孔加入10 μ L CCK-8和90 μ L 1640完全培养基, 另取3个没有接种细胞的孔加入等量的培养基和CCK-8作为空白对照, 培养箱中2 h, 测定OD值, 检测完毕后将各孔培养基更换为1640完全培养基, 并于48 h、72 h重复上述操作。
克隆形成实验将对照组、TPX2siRNA转染组的CCK8细胞接种于6孔板中, 每孔200个细胞, 接种7 d后, 废弃培养基, 每个孔用PBS仔细洗2次。使用4%多聚甲醛固定, 然后用Giemsa染色液染色。
Trizol法提取总RNA, 利用Takara反转录试剂盒将1 μ g总RNA反转为cDNA, 反转录体系为:总RNA 1.0 μ L, Random primer 0.5 μ L, RNase Inhibitor 0.25 μ L, dNTP mix 1 μ L, RNase free dH2O 3.75 μ L, 10×RT buffer 1 μ L。反应条件为30℃ 10 min, 42℃ 30 min, 95℃ 5 min, 5℃ 5 min, 终止反应, 反应所得cNDA暂存于-20℃备用。根据NCBI登录的人源TPX2基因序列设计并合成qPCR引物, 上游引物5′ -GTGGAAATATGCCCTTTCTTT-3′ , 下游引物5′ -AGAAAGGGCATATTTCCACTT-3′ ; 以GAPDH作为内参进行, 上游引物5′ -CAGCGACACCCA CTCCTC-3′ , 下游引物5′ -TGAGGTCCACCACC CTGT-3′ 。反转录体系为:总RNA 1.0 μ L, Random primer 0.5 μ L, RNase Inhibitor 0.25 μ L, dNTP mix 1 μ L, RNase free dH2O 3.75 μ L, 10×RT buffer 1 μ L。反应条件为30℃ 10 min, 42℃ 30 min, 95℃ 5 min, 5℃ 5 min, 终止反应, 反应所得cNDA暂存于-20℃备用。将所得cDNA进行50倍比稀释, 取5 μ L作为模板, 同时加入2 × SYBR SuperMix 10 μ L, 上下游引物分别为0.5 μ L, ddH2O 4 mL。
不同处理的CNE2Z细胞用PBS清洗3次, 加入蛋白酶/磷酸酶抑制剂和RIPA抑制剂, 冰上裂解15 min。将裂解的蛋白液收集到1.5 mL的管中, 4℃ 12 000 r/min离心10 min, 吸取上清至另一个EP管中。Bradford法检测蛋白浓度, 取部分蛋白液加入上样缓冲液, 100℃煮沸10 min。取处理好的蛋白样品各30 μ g, 进行SDS-PAGE凝胶电泳, 转膜, 封闭, 一抗4℃处理过夜, PBST清洗, 加入二抗, 室温孵育1 h, PBST清洗后加入ECL发光液(Emitter Coupled Logic), 利用凝胶成像仪对信号进行采集, 利用ImageJ比较蛋白表达水平。
将Transwell小室在37℃进行温育, RPMI-1640培养基重悬消化的细胞, 调整细胞浓度为2×105/mL; 小室内下层加入含血清的完全培养基, 上室加入100~150 μ L的细胞悬液, 培养箱中作用24 h, 取出Transwell皿, 吸取培养基, 甲醇固定30 min; Giemsa染色液室温处理15~30 min, 用湿润的棉棒蘸取上室底部膜表面的细胞, 然后反转底面朝上晾干, 显微镜下观察计数。
采用SPSS 20.0软件对数据进行统计分析, 以P< 0.05表示有显著性差异。
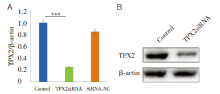
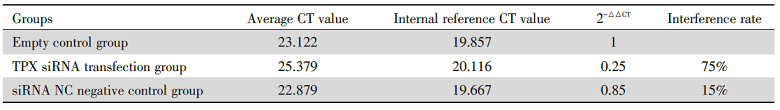
实时定量PCR检测TPX2siRNA干扰组、空载对照组。结果分析发现TPX2siRNA组TPX2 mRNA相比于对照组显著降低, 其mRNA沉默效率大约为75%(表1)。我们进一步采用Western blot方法检测了TPX2siRNA作用的细胞中TPX2的蛋白表达水平, 结果显示TPX2siRNA组比空白对照组蛋白表达水平显著降低, 表明靶向siRNA对细胞中的TPX2的表现具有显著的抑制作用, 抑制率大约为75%(图1)。
| 表1 TPXsiRNA转染抑制CNE2Z细胞中TPX2的mRNA水平 Tab.1 Inhibition of TPX2 mRNA level in CNE2Z cells by TPX siRNA transfection |
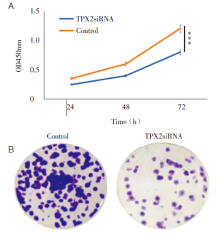
为了探讨TPX2siRNA转染对细胞增殖的影响, 本研究采用CCK-8克隆形成实验分析TPX2siRNA组和对照组细胞增殖情况, 分析发现随着细胞增殖分裂, TPX2siRNA组相比对照组细胞生长速度明显降低, TPX2siRNA转染显著抑制了细胞的增殖活性, 在72 h达到显著, P< 0.05(图2)。
为了分析TPX2敲减对细胞周期相关蛋白的影响, 本研究利用Western blot检测了细胞周期蛋白cyclinD1、cyclinE、p27的表达情况(图3), 结果显示在TPX2干扰后, 细胞周期相关蛋白中cyclinD1、cyclinE下调, p27上调, 以上结果说明干扰TPX2表达对细胞周期具有抑制作用。
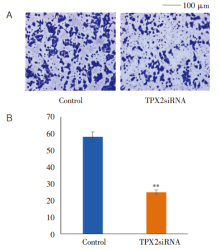
本研究采用Transwell试验分析细胞迁移能力, 将完成迁移的各组随机选取5个视野(200× ), 取平均值, 计算Transwell下室每个视野内细胞中数目。结果显示TPXsiRNA组细胞穿膜数显著小于对照组(图4), 以上结果说明TPX2敲减抑制细胞的迁移。
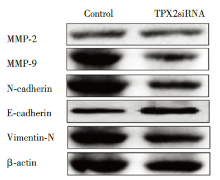
Western blot检测分析发现, CNE2Z细胞中转染TPX2siRNA后细胞迁移率标记蛋白(matrix metalloproteinase-2, MMP-2)和(matrix metalloproteinase-9, MMP-9)水平降低, 上皮细胞-间充质转化(epithelial-mesenchymal transition, EMT)通路相关指标检测分析发现上皮细胞分子标志物E-cadherin上调, 间质细胞分子标志物形蛋白(Vimentin-N)下调(图5), 以上结果说明TPX2siRNA可能通过影响EMT通路进而抑制细胞迁移。
TPX2作为新的候选癌基因, 受到越来越多的关注。许多实验表明人类肿瘤中存在TPX2的过表达, 过量的TPX2阻断了双极纺锤体的形成, 使纺锤体极结构异常增大, 导致异倍体的形成, 从而导致细胞生物学行为的异常[7, 8]。RNA干扰是一种转录后的基因沉默机制, siRNA的反义链和mRNA的同源区碱基互补配对, 核酸内切酶切割靶分子中与反义链互补区域, 特异性阻断基因表达[9, 10]。TPX2会对肿瘤细胞周期产生重要影响。研究发现[11]TPX2过表达与患者的存活率或肿瘤侵袭性存在相关性, 并且抑制TPX2的过表达可以有效减少组织培养中癌细胞的生长, 诱导凋亡, 抑制其在软琼脂和裸鼠中的生长, 并能够增加癌细胞对紫杉醇的敏感性。TPX2通过调控细胞周期蛋白cyclinD1、cyclinE、CDK4、p21、p27来调控肿瘤的恶性生物学行为[11]。本实验发现在TPX2干扰后进行Western blot检测分析, cyclinD1、cyclinE表达下调, P27表达上调, 该结果和Iyoda的研究较为接近。另外, TPX2会对肿瘤细胞的增殖产生影响, TPX2敲低促进细胞凋亡并增加细胞在G2/M期的比例; 此外, 它还抑制胆管癌的入侵和迁移[12, 13, 14]。
TPX2对肿瘤细胞的迁移、侵袭产生重要影响。当用TPX2siRNA干扰细胞TPX2蛋白表达时, 促进细胞的凋亡; 将细胞周期阻滞于G2/M期而不能进行正常的有丝分裂; 抑制细胞的迁移和侵袭能力[15, 16, 17]。研究的结果提示了这些患者中TPX2表达的预后价值。在有丝分裂期间, TPX2能够与下游伴侣(包括AuroraA激酶)相互作用, 导致AuroraA定位于有丝分裂纺锤体的微管。此外, TPX2通过将其锁定在活性构象中来激活AuroraA的激酶活性[18, 19]。本实验通过RNA干扰技术下调TPX2表达, 发现CNE2Z细胞的迁移以及侵袭能力显著下降。干扰TPX2的表达会使上皮表型标志物E-cadherin上调, 而间质表型标志物Vimentin显著降低, 结果提示EMT过程可能受到抑制。EMT在鼻咽癌的发生、发展以及转移中产生了重要作用, TPX2对EMT过程具有重要的调控作用, 提示其可以作为癌症治疗的干预靶点[20]。
总的来说, TPX2能够诱导EMT的发生调控鼻咽癌细胞的迁移和侵袭, TPX2的表达降低并且伴随EMT标志物的改变。TPX2可能通过cyclinD1、cyclinE、CDK4、p21、p27来调控CNE2Z细胞的增殖、迁移、侵袭。随着TPX2在鼻咽癌中调控机制的深入研究, TPX2有望成为鼻咽癌诊断和治疗的新靶点。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|