作者简介:
伍华英(1976-),女,湖南常德人,医学学士,主治医师,主要研究方向为血液内分泌治疗。
目的 探讨不同化疗方案对初始诱导失败急性髓性白血病(acute myeloid leukemia,AML)患者近期疗效、生存期及不良反应的影响。方法 回顾性纳入2017年1月~2019年12月华北石油管理局总医院收治的120例初始诱导失败AML患者,按照治疗方案的不同分为FLAG方案[氟达拉滨(fludarabine,Flud)联合阿糖胞苷(cytarabine,Ara-C)及粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)]组、CAG方案[阿柔比星(aclarubicin,Acla)联合Ara-C及G-CSF]组及MAC方案[米托蒽醌(mitoxantrone,MTZ)联合环磷酰胺(cyclophosphamide,CTX)及Ara-C]组,每组40例。比较3组的近期疗效、生存期及不良反应。结果 MAC方案组的完全缓解率(complete response,CR)明显高于FLAG方案组及CAG方案组(52.50% vs. 32.50%、35.00%, P<0.05),总缓解率(overall response rate,OR)明显高于FLAG方案组(65.00% vs. 42.50%, P<0.05),3组之间的部分缓解(partial response,PR)比较差异无统计学意义( P>0.05);MAC方案的总生存期(overall survival,OS)均明显高于FLAG方案组及CAG方案组[32.6个月(2.0~47.5) vs. 19.7个月(1.5~28.4)、13.0个月(1.6~25.2), P<0.05],3组之间的无病生存率(disease-free survival,DFS)比较差异无统计学意义( P>0.05);MAC方案及CAG方案组的感染发生率均明显高于FLAG方案组(82.50%、77.50% vs. 50.00%, P<0.05),3组之间的其他不良反应发生率比较差异无统计学意义( P>0.05)。结论 MAC方案能够明显提高初始诱导失败AML患者的近期疗效及生存期,而感染发生率较高,但不是严重不良反应,总体价值相对高于FLAG方案及CAG方案。
Objective To investigate the effects of different chemotherapy regimens on short-term efficacy, survival and adverse reactions in patients with acute myeloid leukemia (AML) after initial induction failure. Methods 120 cases of AML patients after initial induction failure were retrospectively included in Huabei Petroleum Administration Bureau General Hospital from January 2017 to December 2019. According to different treatment regimens, they were divided into FLAG regimen [fludarabine (Flud) combined with cytarabine (Ara-C) and granulocyte colony stimulating factor (G-CSF)] group, CAG regimen [aclarubicin (Acla) combined with Ara-C and G-CSF] group, and MAC regimen [mitoxantrone (MTZ) combined with cyclophosphamide (CTX) and Ara-C] group, with 40 cases in each group. The short-term efficacy, survival time and adverse reactions were compared among the three groups. Results The complete response (CR) rate of MAC regimen group was significantly higher than that of FLAG regimen group and CAG regimen group (52.50% vs. 32.50%, 35.00%, P<0.05), overall response rate (OR) was significantly higher than that of FLAG regimen group (65.00% vs. 42.50%, P<0.05). There was no significant difference on partial response (PR) among the three groups ( P>0.05). The overall survival (OS) of MAC regimen group was significantly higher than that of FLAG regimen group and CAG regimen group [32.6 months (2.0~47.5) vs. 19.7 months (1.5~28.4), 13.0 months (1.6~25.2), P<0.05]. There was no significant difference on disease free survival (DFSP among the three groups ( P>0.05). The incidence of infection of MAC regimen group and CAG regimen group was significantly higher than that of FLAG regimen group (82.50%, 77.50% vs. 50.00%, P<0.05). There was no significant difference on incidence of other adverse reactions among the three groups ( P>0.05). Conclusions MAC regimen could significantly improve the short-term efficacy and survival time of AML patients after initial induction failure, while the incidence of infection was higher, but not serious adverse reactions, and the overall value was relatively higher than FLAG regimen and CAG regimen.
急性髓性白血病(acute myeloid leukemia, AML)是髓系造血干/祖细胞恶性疾病, 以骨髓与外周血中原始和幼稚髓性细胞异常增生为主要特征[1]。目前, AML的发病机制还不够清楚, 也无特效治疗方法。临床上常采用联合序贯化疗, 即获得初始诱导后进行缓解后治疗; 初始诱导方案取决于患者的年龄和有无血液学疾病史, 缓解后治疗方案取决于细胞遗传学危险因素[2]。目前关于初始诱导失败AML患者的挽救治疗方案尚无统一标准, 而FLAG方案:氟达拉滨(fludarabine, Flud)联合阿糖胞苷(cytarabine, Ara-C)及粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)及CAG方案:阿柔比星(aclarubicin, Acla)、Ara-C及G-CSF, 是应用比较广泛的2种挽救方案, 治疗AML患者的完全缓解率(complete response rate, CR)在40%~50%[3]。有研究[4]证实, MAC方案:米托蒽醌(mitoxantrone, MTZ)联合环磷酰胺(cyclophosphamide, CTX)及Ara-C, 能够对病情进行有效的控制, 提高CR, 但其与FLAG方案及CAG方案在疗效及安全性方面的差异还没有确切的定论。基于此, 本研究将通过探讨FLAG方案、CAG方案及MAC方案对初始诱导失败AML患者近期疗效、生存期及不良反应的影响, 以期为临床提供参考。
回顾性纳入2017年1月~2019年12月华北石油管理局总医院收治的120例初始诱导失败AML患者, 按照治疗方案的不同分为FLAG方案组、CAG方案组及MAC方案, 每组40例。3组患者的一般资料比较均无统计学差异(P> 0.05), 见表1。本研究经过医学伦理审查(伦理号:ZYY-ZQTY-2019-30), 患者及家属均知情同意。
| 表1 3组患者一般资料的比较 Tab.1 Comparison of general data between 3 groups (n=40) |
入选标准:①均符合《成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)》[5]的诊断标准; ②患者年龄≥ 18岁; ③初始诱导失败; ④预期生存时间超过3个月。排除标准:①伴有其他类型恶性肿瘤、血液系统疾病及内分泌代谢系统疾病等; ②伴有感染、消化到出血、重要脏器功能障碍的等; ③妊娠及哺乳期女性。
FLAG方案组:Flud(山西普德药业股份有限公司, 国药准字H20067309), 30 mg/(m2· d), d1~d3; Ara-C(Hospira Australia Pty Ltd, 国药准字H20120187), 1~2 g/(m2· d), d1~d5; G-CSF(山东齐鲁制药集团, 国药准字S20063065), 5 μ g/(kg2· d), d0~d5; Flud用药完毕4 h后再给予Ara-C。CAG方案组:Acla(深圳万乐药业有限公司, 国药准字H10910093), 20 mg/d, d1~14; Ara-C 15 mg/m2, bid, d1~d14; G-CSF 5 μ g/(kg2· d), d1~d14。MAC方案组:MTZ(四川升和制药有限公司, 国药准字H10960191), 8~10 mg/(m2· d), d1~d3; CTX(Baxter Oncology GmbH, 国药准字H20120181), 400 mg/(m2· d), d2、d5; Ara-C 100 mg/(m2· d), d1~d7。
按照《成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)》进行近期疗效的判定:①CR:骨髓原始细胞小于0.05, 外周血中性粒细胞绝对值超过1.0× 109/L, 血小板计数超过100× 109/L, 有发生髓外浸润; ②部分缓解率(partial response rate, PR):骨髓原始细胞在0.05~0.25之间, 其余同CR标准。总缓解率(overall response rate, OR)=CR+PR。
随访时间截至2020年12月31日。①生存期:无病生存期(disease-free survival, DFS)和总生存期(overall survival, OS), 计算中位值。②不良反应:按照美国卫生及公共服务部国立卫生研究院国家癌症研究所常见不良反应事件评价标准4.0版对不良反应进行评价。
使用SPSS 22.0统计软件。符合正态分布的计量资料以(x ± s)表示, 两两比较采用t检验, 三组之间的比较采用单因素方差分析; 计数资料以[n(%)]表示, 比较采用χ 2检验; 生存期以OS表示, 采用KM法及Log Rank检验进行分析; 以P< 0.05表示差异具有统计学意义。
3组方案之间的PR比较差异无统计学意义(P> 0.05); MAC方案的CR均明显高于FLAG方案组及CAG方案组(P< 0.05), MAC方案的OR明显高于FLAG方案组(P< 0.05), FLAG方案组与CAG方案组之间的CR及OR比较差异均无统计学意义(P> 0.05), 见表2。
| 表2 3组方案近期疗效的比较 Tab.2 Comparison of short-term efficacy between 3 groups [n(%), n=40] |
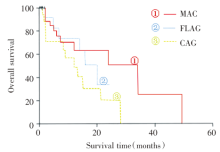
3组方案之间的DFS比较差异无统计学意义(P> 0.05); MAC方案的OS均明显高于FLAG方案组及CAG方案组(P< 0.05), FLAG方案组与CAG方案组之间的OS比较差异均无统计学意义(P> 0.05)。见表3、图1、图2。
| 表3 3组方案生存期的比较 Tab.3 Comparison of survival time between groups (n=40) |
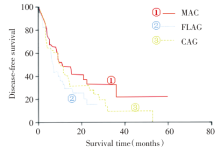 | 图1 3种化疗方案治疗初始诱导失败AML患者的DFS曲线Fig.1 DFS curves of three chemotherapy regimens on AML patients after initial induction failure |
所有患者均发生不同程度的骨髓抑制。3组方案之间恶心呕吐、腹泻、肝损伤及肾损伤发生率的比较差异无统计学意义(P> 0.05); MAC方案及CAG方案组的感染发生率均明显高于FLAG方案组(P< 0.05), MAC方案与CAG方案组的感染发生率比较差异无统计学意义(P> 0.05); 所有不良反应均经过对症处理后缓解, 无患者中途退出治疗, 见表4。
我国急性白血病比慢性白血病多见, 其中AML最多(1.62/10万), 目前尚无统一的标准治疗方案, 对这类患者的治疗策略主要包括联合化疗方案、逆转耐药、造血干细胞移植、免疫调节治疗, 以及中医药辅助治疗等。初始诱导治疗后进行巩固治疗的联合序贯化疗是临床上治疗AML的主要方法, 如果初始诱导治疗不敏感发生失败, 会对患者的预后产生严重的影响。《复发难治性急性髓系白血病中国诊疗指南(2017年版)》对复发性AML患者建议采用未使用过、无交叉耐药性的药物进行治疗[6], 例如可以将传统的柔红霉素改为去甲氧柔红霉素、阿克拉霉素或米托蒽醌, 或加用高三尖杉酯碱、Flud、依托泊苷等原方案中未使用过的药物; 也可用以中到大剂量Ara-C为主联合一些新药的化疗方案, 利用其协同作用增强疗效; 也可采用预激方案, 利用G-CSF使处于G0/G1期的白血病干细胞进入增殖期, 从而有利于其被化疗药物所杀灭。而对于初始诱导失败AML患者的挽救方案也还没有统一的标准, FLAG、CAG及MAC方案是临床治疗初始诱导失败AML患者的主要化疗方案。
| 表4 3组不良反应的比较 Tab.1 Comparison of adverse reaction between groups [n(%), n=40] |
FLAG方案中的Ara-C是作用于细胞增殖S期的嘧啶类抗代谢药物; Flud为抗病毒药阿糖腺苷的氟化核苷酸类似物, 可相对地抵抗腺苷脱氨基酶的脱氨基作用, 降低Ara-C的代谢水平, 提高Ara-C活性代谢物的浓度, 增强对抗肿瘤细胞的毒性作用; G-CSF能促进中性粒细胞数的增加。国外学者[7]采用FLAG方案对年龄超过60岁的耐药性AML患者进行治疗, CR、血小板未完全恢复的完全缓解(CR with incomplete platelet recovery, CRp)及血细胞计数未完全恢复的完全缓解(CR with incomplete count recovery, CRi)分别为30.3%、9.1%、6.1%, 患者耐受性比较好, 因副作用而退出治疗的病例数较少; 而本研究中FLAG方案的CR为32.50%, PR为10.00%, OR为42.50%, 与国内学者的研究[8]报道基本一致。CAG方案中的Acla是一种新蒽环类抗肿瘤抗生素, 通过对生物大分子及RNA的合成进行抑制而产生抗肿瘤作用。刘英[9]等采用联合地西他滨对35例老年AML患者进行治疗, OR为51.4%, 2年存活率为23.5%; 张小可[10]等采用CAG方案对32例AML患者进行治疗, OR为50.0%, 不良反应较少; 本研究中, CAG方案的CR为35.00%, PR为17.50%, OR为52.50%, 与以上结论基本一致。国内外以往的大量研究[11, 12]已经证实, FLAG方案及CAG方案的OR在40%~53%, 化疗耐受性比较好, 不良反应少, 是比较公认的初始诱导失败AML患者的挽救方案之一。
MAC方案中的MTZ是细胞周期非特异性药物, 通过和DNA分子结合, 抑制核酸合成而导致肿瘤细胞死亡, 与蒽环类药物没有完全交叉耐药性; CTX属于广谱抗肿瘤药物, 是细胞周期非特异性药物, 通过与DNA发生交叉联结, 抑制DNA的合成, 干扰RNA的功能而发挥抗肿瘤细胞的活性。马忠正[13]等采用氟达拉滨+环磷酰胺(FC)方案对慢性淋巴细胞白血病进行了治疗, OR为58.8%, 中位PFS为36个月; 李琳琳[14]等采用地西他滨辅助MAC方案治疗复发难治性AML患者, 总有效率为75.31%, 可改善患者血液学指标水平, 降低外周血SPF、TK1水平, 提高远期生存率。国外学者Kell J的研究[15]显示, MAC方案用于≥ 60岁初始诱导失败AML患者的挽救化疗, CR > 50%, 而OR可达55.4%~62.7%, 且患者的耐受性良好; 本研究中MAC方案的CR为52.50%, PR为22.50%, OR为65.00%, 与王慧[16]等的研究结论基本一致。
本研究的结果显示, MAC方案组的CR明显高于FLAG方案组及CAG方案组, 明显高于FLAG方案组; MAC方案的OS均明显高于FLAG方案组及CAG方案组; MAC方案及CAG方案组的感染发生率明显高于FLAG方案组, 提示MAC方案用于初始诱导失败AML患者的化疗, 能够延缓疾病的进展, 延长生存期。MAC方案是基于MA方案所制定的一种新型挽救化疗方案, 通过增加烷化剂类抗肿瘤药物CTX, 有效干扰肿瘤细胞增殖周期, 阻断DNA合成缓解, 继而达到广谱肿瘤细胞作用。既往临床研究[17]证实, CTX可针对性抑杀淋巴细胞白血病肿瘤细胞, 故以往常规用于淋巴细胞白血病患者化疗; 也可能与CTX在AML化疗中的应用比较少, 对肿瘤细胞的敏感性比较高有关。3组之间大部分不良反应均无明显差异, 但是MAC方案的感染发生率较高, 但是本研究中没有因为感染导致的死亡病例, 也没有因为不良反应而中途退出研究的患者, 至于其感染发生率高的原因, 可能与患者之间个体耐受度和老年人群比例差异有关, 但是具体机制还需要进一步研究。
综上所述, MAC方案能够明显提高初始诱导失败AML患者的近期疗效及生存期, 而感染发生率较高, 但不是严重不良反应, 总体价值相对高于FLAG方案及CAG方案, 此研究结果可能为AML患者造血干细胞移植治疗提供参考依据; 但是本研究还存在一定的局限性, 在条件允许时还需进行大样本量多中心研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|