作者简介:
蒋振江(1991-),男,河南驻马店人,在读硕士研究生,主要研究方向为心血管内科学专业。
肺肉瘤样癌(pulmonary sarcomatoid carcinoma,PSC)是一种少见、分化较差的非小细胞肺癌(non-small cell lung cancer,NSCLC),手术根治切除是早期主要的有效治疗手段,中期能切除者以手术切除为主的综合治疗,不能切除者以根治性放化疗为主,对于晚期则根据肿瘤病理类型及基因检测的结果制定个体化的全身治疗方案。目前的大多数研究表明PSC患者的预后比其余的NSCLC患者更差。随着分子检测技术在临床的广泛应用,发现69%~80% PSC患者包含至少一个基因突变。本文为陕西省人民医院肿瘤内科收治的PSC术后迅速多发转移患者,通过基因检测指导治疗,患者获得较明显的缓解,报道其诊疗过程以期为PSC治疗提供临床参考。
Pulmonary sarcomatoid carcinoma (PSC) was a rare, poorly differentiated non-small cell lung cancer (NSCLC), for which radical surgical resection was the main effective treatment in the early stage. For those who can be resected in the middle stage, surgery was the main comprehensive treatment, however, those who cannot be resected are treated mainly with radical radiotherapy. For advanced stages, individualized systemic treatment protocols were developed based on tumor pathology and genetic testing results. Most of the current studies have shown that the prognosis of PSC patients was worse than the rest of NSCLC patients. With the widespread use of molecular testing techniques in clinical practice, 69% to 80% of PSC patients were found to contain at least one genetic mutation. In this paper, a patient with rapid multiple metastases after PSC surgery admitted to the Department of Medical Oncology of Shaanxi Provincial People’s Hospital was treated with genetic testing to guide treatment, and the patient achieved more significant remission, and the treatment process was reported in order to provide clinical reference for PSC treatment.
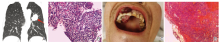
男性患者, 55岁, 以无明显诱因黑便20余天于2021年4月23日入陕西省人民医院普外科, 无恶心、呕吐、腹痛、腹胀、腹泻等症状。既往吸烟30余年, 平均20支/天, 饮白酒20余年, 平均50~100 mL/天; 于冷库工作30多年, 环境潮湿, 且多接触氨气、氟剂。其父亲曾患肺癌。查体:T:36.2℃, P 77次/分, R 18次/分, BP 125/70 mmHg, H 162 cm, W 60.0 kg, BMI 22.9 kg/m2, 神志清, 精神可, 贫血貌, 结膜苍白, 全身浅表淋巴结未触及肿大, 心、肺、腹查体未见异常。入院化验提示:血红蛋白 78 g/L, 粪便隐血阳性。胃镜示, 慢性萎缩性胃窦炎, 结肠镜检查未见异常, 胸部CT提示:左肺上叶舌段及下叶背段占位伴周围少许渗出(图1-A)。转入胸外科, 行正电子发射计算机断层扫描(positron emission tomography/computed tomography, PET-CT)示, 左肺跨叶生长软组织肿块伴高代谢, 符合恶性(肺癌可能性大)。双侧肾上腺小结节伴高代谢, 转移性病变待排。腹腔、肠系膜区轻度增大淋巴结, 伴代谢增高。为明确肿物性质, 2021年5月12日, 患者行CT引导下穿刺活检, 病理提示肉瘤样癌可能(图1-B)。完善术前准备后, 并于2021年5月19日行胸腔镜下左胸探查+左肺上叶切除+左肺下叶楔形切除+肺门纵隔淋巴结清扫术。术后病理:肉眼见一叶肺, 体积22× 15× 13 cm3, 距支气管切缘1 cm处见一灰白色肿物, 已剖开, 体积4.5× 3.7× 3.2 cm3, 肺门旁检见淋巴结1枚, 径约0.3 cm。另送:第5组淋巴结:检见淋巴结1枚, 直径1.1 cm; 第7组淋巴结:检见淋巴结1枚, 直径1.3 cm; 第9组淋巴结:检见淋巴结3枚, 直径0.4~0.6 cm; 第10组淋巴结:检见淋巴结1枚, 直径1.4 cm; 第11组淋巴结:检见淋巴结2枚, 直径0.7~1.1 cm; 第12组淋巴结:检见淋巴结3枚, 直径1.2~2.1 cm。免疫组化:CK少数(+)、CK8/18部分(+)、CK7部分(+)、Vimentin(+)、TTF-1(-)、NapsinA(-)、S-100(-)、P63(-)、P40(-)、CK5/6(-)、SMA(-)、CR(-)、INI-1(+)、EMA部分(+)、Desmin部分(+)、MyoD1(-)、LCA(-)、MUM-1(-)、CD38(-)、CD138(-)、SATB-2少数(+)、Villin(-)、NUT(-)、Bcl2(-)、CD99(-)、CD68(-)、Ki-67指数约为70%。病理诊断:(左肺)分化差的恶性肿瘤, 结合免疫组化倾向肉瘤样癌, 侵及脏层胸膜。支气管切缘、下叶切缘未见癌组织。送检淋巴结均未见癌转移。病理分期为:pT3N0M0, 临床分期为Ⅱ B期。西安交大一附院病理科会诊后示:左肺肉瘤样低分化腺癌伴广泛性坏死。术后3天患者上颚中切牙后出现肉芽样肿物, 质韧, 伴发声不能、左侧颌下、左腋窝、左滑车上淋巴结肿大, 考虑患者术后体力较差, 暂不能耐受进一步治疗, 给予输血、补液、营养支持等治疗, 病情好转后出院。
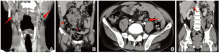
术后23天因胸、腹部痛、重度贫血再次入胸外科, 查体:上颚中切牙后肿物增大至中切牙前, 大小约5.0× 3.5 cm2, 质韧, 色红似肉芽, 伴出血、咀嚼困难(图1-C); 双侧颌下淋巴结增大融合成团, 质硬, 边界不清, 压痛明显, 左侧腋窝、左侧滑车上淋巴结较前增多。颈部、腹部、盆腔增强CT提示多处转移(图2)(上颚, 下颌区、锁骨上窝、左侧腋窝、纵膈及腹腔淋巴结, 盆腔等部位均见新发病灶), 化验提示:白细胞20.91× 109/L、血红蛋白59 g/L, 给予输血、抗感染等治疗。
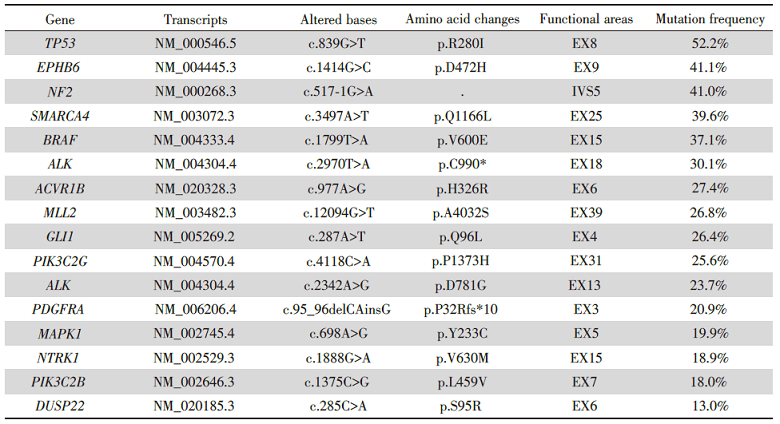
后转入肿瘤内科, 完善骨髓穿刺提示粒系感染中毒表现, 未见肿瘤转移。行上颚肿物穿刺细胞学检查, 病理提示肿瘤转移(图1-D)。经过科室讨论, 评估病情后考虑患者术后肿瘤快速多发转移, 现无化疗禁忌, 于2021年6月22日行姑息化疗, 根据美国国立综合肿瘤网络(National Comprehensive Cancer Network, NCCN)、中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)指南推荐, 结合患者肿瘤组织学特点为非鳞状非小细胞肺癌(低分化腺癌)(non-small cell lung cancer, NSCLC), 故给予培美曲塞700 mg d1+奈达铂60 mg d1, 70 mg d2, q3w方案, 行一个周期化疗, 输注过程顺利, 未见明显不适, 建议患者行肿瘤基因检测。结果为: PD-L1 扩增(-), PBRM1 失活突变(-), 微卫星稳定性为:微卫星稳定(MSS), 肿瘤突变负荷(TMB)为:肿瘤突变负荷-高(TMB-H, 14.4 Muts/Mb, 89%)该患者的 TMB 值高于吉因加 89%的NSCLC患者(见表1)。
| 表1 点突变, 小片段的插入缺失检测结果 Tab.1 Point mutations, insertion deletion detection results of small fragments |
以上结果提示可能对免疫检查点抑制剂敏感, 根据该患者基因检测结果, 在以铂为基础的化疗上加用PD-1免疫抑制剂替雷利珠单抗、抗血管生成药安罗替尼; 于2021年7月16日、2021年8月6日分别予以“ 培美曲塞 500 mg d1+奈达铂70 mg d1-2, q3w” 化疗, 联合“ 替雷利珠单抗200 mg d1, q3w” 免疫治疗和“ 安罗替尼12 mg, d1-14, q3w” 靶向治疗, 治疗后口腔转移灶较前明显减小、左侧腋窝及左侧滑车上淋巴结未触及, 下颌淋巴结明显缩小, 发音功能明显改善, 未出现相关的不良反应, 未诉特殊不适。2021年8月31日入院全面检查, 口腔转移灶较前基本消失(图3-A), 肾上腺结节较前稍减小(图3-B), 部分腹腔淋巴结较前消失(图3-C), 评估疗效为部分缓解后再次行第三周期上述方案治疗。
肺肉瘤样癌(pulmonary sarcomatoid carcinoma, PSC)是一种少见、分化较差的NSCLC, 占所有肺恶性肿瘤的0.1%~0.4%[1, 2], 具有快速生长、高侵袭性、易转移、预后差的临床特点。常好发于长期大量吸烟的老年男性, 平均年龄 65~75岁[3, 4]。根据2004年, 世界卫生组织(World Health Organization, WHO)的肺肿瘤分类中, PSC是含有肉瘤或肉瘤样成分的一类 NSCLC的统称, 有多形性癌、梭形细胞癌、巨细胞癌、癌肉瘤和肺母细胞瘤5种亚型[5]。组织学上, 梭形细胞癌和巨细胞癌被定义为纯PSC, 因为它们是纯肉瘤样成分。其他亚型被定义为双相PSC, 因为NSCLC的常规成分与肉瘤样成分混合[6]。PSC本质是一种上皮源性的恶性肿瘤, 肉瘤样成分起源于上皮癌组织, 经稳定的上皮-间充质转化[7, 8], 上皮细胞失去了细胞极性, 失去与基底膜的连接等上皮表型, 获得了较高的迁移与侵袭、抗凋亡和降解细胞外基质的能力等间质表型。PSC的免疫组织化学特点:上皮标志物和间质标志物均可呈阳性表达。常用的上皮生物学标志物是细胞角蛋(cytokeratin, CK)、上皮细胞膜抗原(epithelial membrane antigen, EMA)、抗细胞角蛋白单克隆抗体 (anti-pancytokeratin antibody, AE1/AE3)、甲状腺转录因子-1(thyroid transcription factor-1, TTF-1)、癌胚抗原(carcinoembryonic antigen, CEA)等, 间质成分标志物包括波形蛋白(vimentin)、结蛋白(desmin)等[9]。手术根治切除是早期主要的有效治疗手段, 对于中期能切除者以手术切除为主的综合治疗, 不能切除者以根治性放化疗为主, 对于晚期则根据肿瘤病理类型及基因检测的结果制定个体化的全身治疗方案[10]。但国内报道表明化疗疗效差, 不能提高患者生存期及减少复发。目前的研究大多数认为PSC患者的预后比其他类型的NSCLC患者更差[1, 2], 中位生存期仅6.4个月, PSC的1年、3年和5年生存率分别为33.7%、18.4%和14.4%[11]; 其原因主要是PSC对传统治疗方法响应较差, 对常规化疗的耐药性和对放疗的低反应性, 并且手术切除后复发较快[2, 12]。
随着分子检测技术如ARMS-PCR, 二代测序技术在临床的广泛应用, 发现PSC是一种基因突变频率较高的NSCLC, 69%~80% PSC患者包含至少一个基因突变[12], 目前有文献报告的PSC相关基因有TP53、EGFR、KRAS、MET和ALK等, 这些基因改变可单独存在, 也可同时发生, 并且在不同的人群中有不同结果的突变谱[13, 14]。这有望从相应的靶向药物治疗中获益。另外, 免疫系统在肿瘤发生中起着非常重要的作用, 逃避免疫监视是癌症公认的特征之一[15]。特异性免疫检查点抑制剂主要作用于阻断抑制性T淋巴细胞所介导的免疫反应, 如程序性细胞死亡蛋白1(programmed death 1, PD-1)和程序性死亡配体1(programmed death ligand 1, PD-L1)的抗体, 正在成为许多NSCLC患者标准治疗的一部分[16]。PD-1是近年发现的一种负性共刺激分子。PD-L1是PD-1的配体, PD-1与PD-L1结合后可提供抑制性信号, 诱导T细胞凋亡, 抑制T细胞的活化和增殖。PD-L1/PD-1抗体属于免疫检查点抑制剂(immune checkpoint inhibitor, ICIs), 帮助T细胞恢复对肿瘤细胞的识别和杀伤能力[17]。替雷利珠单抗(tislelizumab)是一种对PD-1具有高度亲和力和特异性的人源化单克隆抗体, 国家药品监督管理局在2020年4月21日正式受理了替雷利珠单抗联合紫杉醇或紫杉醇(白蛋白结合型)和铂类, 用于一线治疗晚期鳞状NSCLC这一新适应证的上市申请[18]。NCCN临床实践指南(2019年, V7), 针对PD-L1高表达(PD-L1≥ 50%)且EGFR、ALK阴性的晚期NSCLC, 组织类型为非鳞癌者, 推荐化疗联合ICIs(1类)。CSCO指南(2019)也是相似的推荐[19]。
该例肺肉瘤样癌患者术后迅速多发转移, 且病理提示为低分化腺癌, 故给予铂类联合培美曲塞治疗, 此为晚期非小细胞非鳞状细胞肺癌患者的一线化疗方案。根据基因检测结果提示:BRAF V600E, 突变频率37.1%, 由于肺癌分子发病机制中致癌驱动突变的特征研究取得显著进展[20]。ALK重排、ROS1重排和EGFR+激活的突变已被确定为肺癌分子发病机制的致癌驱动因素, 这已导致针对NSCLC患者的靶向治疗和更个性化的治疗策略的快速发展[21, 22, 23]。而激活BRAF突变被认为是NSCLC中的另一种致癌驱动因素, 在含有EGFR突变、ALK重排或ROS1重排的肿瘤中几乎从未观察到这种情况[20]。在晚期NSCLC患者中, 大约2%的病例中观察到BRAF突变[24]。BRAF V600E突变的NSCLC患者临床上受益于BRAF靶向药物[25]。研究结果显示, 达布非尼联合曲美替尼治疗未经治疗的BRAF V600E突变转移性NSCLC患者具有显著的抗肿瘤活性[20]。根据NCCN指南(2020)以及CSCO指南, 对于BRAF V600E突变的NSCLC患者推荐使用达拉非尼联合曲美替尼。该患者基因检测结果符合BRAF靶向药物, 建议其行达拉非尼联合曲美替尼治疗, 并告知其风险、适应证及相关费用后, 患者因经济原因拒绝上述方案治疗。针对NTRK突变的靶向药物最早于NCCN指南得到获批, 我国对该类药物的可及性差, 虽然该患者NTRK1突变频率18.9%, 有使用恩曲替尼或劳拉替尼等靶向药物的指征, 考虑到药物可及性对患者病情的影响, 故而未予以选择。另外, 患者虽PD-L1扩增(-), 但是肿瘤突变负荷高(high tumor mutation burden, TMB-H), 研究[26]显示TMB-H的肿瘤(包括NSCLC)对PD-1抗体(帕博利珠单抗/纳武利尤单抗)治疗敏感, 具有更好的获益。2017年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)[27]一项研究报道了不同肿瘤类型的患者TMB与预后以及抗PD-1/PD-L1免疫治疗的疗效的相关性, 包括NSCLC、黑色素瘤以及其它19个肿瘤类型, 结果显示, 高TMB与更好的预后相关, 且是独立的预测因子; 在抗PD-1/PD-L1免疫治疗的患者中也有同样的结果, 接受抗PD-1/PD-L1单药治疗的响应者与非响应者的中位TMB分别为18.0和5.0 mut/Mb(P< 0.000 1)。该患者可能对免疫检查点抑制剂敏感, 故联合替雷利珠单抗行免疫治疗。考虑患者身体状况可耐受化疗, 且肿瘤含有肉瘤样成分, 血管丰富, 故加用安罗替尼抗血管治疗。两个周期后评估疾病进展情况, 为部分缓解(partial response, PR), 口腔肿物明显缩小, 颈部淋巴结未触及, 治疗效果满意。
综上所述, 肺肉瘤样癌比较少见, 恶性程度高, 早期不易发现, 发现时多有全身转移。通过对我科收治的该例患者的病史回顾、诊治过程、效果评估等内容的梳理总结, 我们不难看出对于PSC这种手术切除后复发较快、对常规放、化疗响应较差的NSCLC类型, 通过以基因检测结果为指导的免疫联合治疗效果更佳, 通过对该病例的分析, 以期为临床诊治提供参考。另外, 随着基因检测技术的进展及肿瘤免疫相关领域的深入研究, 未来将会有更多有效的免疫药物问世, 通过以基因检测结果为指导的个体化治疗, 将会更好改善晚期肿瘤患者的生存质量, 延长患者生命。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|