| 任胜祥,同济大学附属上海市肺科医院教授、主任医师、博士研究生导师,现为同济大学附属上海市肺科医院肿瘤科行政副主任。担任国际肺癌联合会(International Association for the Study of Lung Cancer,IASLC)教育委员会委员,中国医促会胸部肿瘤分会秘书长,中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)非小细胞肺癌委员会常务委员,CSCO免疫专家委员会常务委员,CSCO青年委员会常务委员,CSCO老年肿瘤防治专家委员会委员,中国抗癌协会肿瘤药物临床研究青年委员会副主任委员,上海市抗癌协会肺癌分子靶向和免疫治疗委员会副主任委员,上海市医学会肿瘤靶分子专科分会青年委员会副主任委员,中国老年病协会肿瘤专业委员会常务委员等。临床主攻晚期肺癌精准治疗,以通讯或第一(含共同)作者在《Ann Oncol》《Nat Commun》《Mol Cancer》《Signal Transduct Target Ther》《J Thorac Oncol》《Clin Cancer Res》《Cancer Immunol Res》《J Hematol Oncol》等杂志发表SCI论著60余篇。入选上海市优秀学术带头人、上海市曙光计划、浦江人才计划、上海市人才发展计划;获国家科技进步二等奖(6/10)、上海市科技进步一等奖(2/10)、US-CACA学者、IASLC学者奖及上海市医疗系统“银蛇奖”等。 |
研究一:Saalfeld FC, Wenzel C, Christopoulos P, et al. Efficacy of immune checkpoint inhibitors alone or in combination with chemotherapy in NSCLC harboring ERBB2mutations[J]. J Thorac Oncol, 2021, 16(11):1952-1958.
研究二:Yang G, Yang Y, Liu R, et al. First-line immunotherapy or angiogenesis inhibitor plus chemotherapy for HER2-altered NSCLC: a retrospective real-world POLISH study[J]. Ther Adv Med Oncol, 2022, 14:17588359221082339.
2b。
人表皮生长因子2(human epidermal growth factor 2, HER2)突变或扩增在非小细胞肺癌(non-small cell lung cancer, NSCLC)患者中并不常见, 占比分别为1.6%~3%和2%~4%, 常见突变位点为20外显子插入突变。既往研究显示HER2突变为预后不良因素, 生存期约9.9个月~10.7个月。目前尚无获批的靶向治疗药物, 一线治疗仍以化疗为主, 免疫检查点抑制剂(immune checkpoint inhibitor, ICI)能否为该部分患者带来获益, 仍无定论, 缺乏大规模前瞻性临床数据支持, 多数报道均为回顾性数据分析。
研究一:免疫联合化疗或单用免疫治疗在HER2突变NSCLC患者中的临床疗效评估;
研究二:化疗联合免疫治疗或化疗联合抗血管生成治疗在HER2突变NSCLC患者中一线治疗评估。
研究一:
• 研究条件:德国多家中心组成的国家网络基因医药联盟(National Network Genomic Medicine Lung Cancer, nNGM)进行的多中心回顾性分析。
• 研究时间:2016年至2020年。
• 研究方法:回顾性临床研究。
• 研究对象:接受过标准panel基因测序的晚期NSCLC患者, 至少包含有HER2 8、19、20外显子; 入组标准为不能根治性Ⅲ 期或Ⅳ 期NSCLC患者, HER2测序异常(不包括扩增), 接受过免疫联合或不联合化疗; 排除标准为同时有其他EGFR、BRAF-V600, KRAS, ALK, ROS1突变或融合。
• 评价指标:总缓解率(overall response rate, ORR), 无进展生存期(progression-free survival, PFS), 总生存期(overall survival, OS)。
• 评价方法:疗效评估使用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)1.1标准; 生存分析使用Kaplan-Meier方法。
研究二:
• 研究条件:中国医学科学中心国家癌症中心的单中心回顾性数据。
• 研究时间:2015年11月30日至2021年9月1日。
• 研究方法:回顾性临床研究。
• 研究对象:携带HER2变异、接受过一线系统性治疗的转移性NSCLC患者; 入组标准为年龄≥ 18岁, 病理学或细胞学证实的NSCLC, 基线通过组织或血液二代测序(next generation sequencing, NGS)检测HER2突变或扩增[拷贝数(copy number, CN)≥ 3.62], 既往接受过一线治疗; 排除标准为接受过HER2靶向治疗、抗血管生成治疗或免疫治疗, 或免疫治疗联合抗血管生成联合或不联合化疗; 无法获得疗效评估数据的患者。
• 评价指标:ORR, 疾病控制率(disease control rate, DCR), PFS, OS。
• 评价方法:疗效评估使用RECIST 1.1标准; 生存分析使用Kaplan-Meier方法。
研究一:
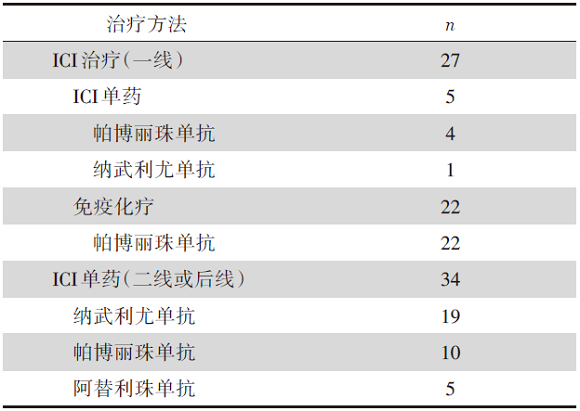
(1)基线特征:共纳入61例HER2突变患者, 中位年龄为61岁, 女性占56%, 腺癌占93%, 约50%患者程序性死亡配体1(programmed death ligand 1, PD-L1)表达低于1%, HER2 20外显子插入突变为主要突变类型, 占66%。入组患者的治疗方式见表1。
| 表1 研究一患者治疗方式 |
(2)研究结果:对于一线联合治疗可评估的21例患者, ORR为52%, 中位PFS为6个月, 1年OS率为88%, 中位OS数据尚未成熟。单用免疫治疗患者仅有1例部分缓解(partial response, PR), 目前已经治疗6个月, 2例疾病稳定(stable disease, SD), 分别已经治疗18个月, 26个月, 目前仍接受治疗中, 2例疾病进展(progression disease, PD)。中位随访时间为11个月。
二线及后线治疗的患者单用免疫治疗ORR仅16%(5/31), 中位PFS为4个月, 1年OS率为36%, 中位OS为10个月, 中位随访时间为15个月。
HER2 20外显子插入突变与其他突变类型相比, ORR、PFS及OS均无明显差异。
研究二:
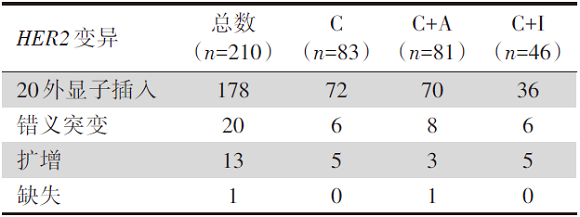
(1)基线特征:共筛选293例携带HER2扩增或突变患者, 均为腺癌; 患者基因变异类型分布见表2。
| 表2 研究二患者基因变异类型分布 |
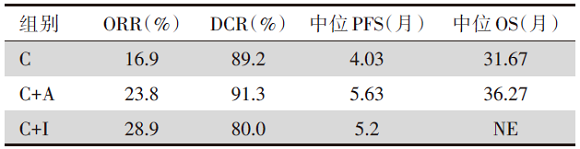
(2)研究结果:与单纯化疗(C)相比, 化疗联合抗血管生成(C+A)延长患者PFS[5.63个月 vs. 4.03个月, 风险比(hazard ratio, HR)0.64, 95%可信区间(confidence interval, CI)0.46~0.88, P=0.006]; 化疗联合免疫治疗(C+I)并未改善患者PFS(C+A vs. C+I:5.63个月 vs. 5.20个月, HR=0.84, 95%CI 0.56~1.25, P=0.37; C+I vs. C:5.20个月 vs. 4.03个月, HR=0.77, 95%CI 0.52~1.14, P=0.20), 且与PD-L1表达或肿瘤突变负荷(tumor mutation burden, TMB)高低无关。不同治疗方式疗效及生存结果见表3。
| 表3 研究二不同治疗方式疗效及生存结果 |
研究一:以免疫为基础的治疗可作为HER2突变NSCLC患者的标准治疗方式;
研究二:对于HER2变异NSCLC患者, 化疗联合抗血管生成治疗较单纯化疗可改善患者PFS, 而免疫为基础的治疗并未优于化疗为基础的方案。
表皮生长因子受体2(HER2)是非小细胞肺癌(NSCLC)一种重要的分子亚型, 约占NSCLC的1%~5%[1]。HER2突变的生物学行为和人群基线特征与HER2扩增以及HER2高表达明显不同[2], 对于传统化疗以及靶向治疗(拉帕替尼、达克替尼等)疗效不佳, 预后极差, 亟需探索新的治疗手段[3, 4]。
随着新型靶向治疗药物(吡咯替尼、poziotinib[5])和HER2-抗体药物偶联物(antibody-drug conjugate, ADC)药物(T-DM1、DS8201a)的问世, HER2突变肺癌患者靶向治疗迎来了春天。目前, 中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)指南推荐吡咯替尼作为HER2突变肺癌患者后线治疗方案, 此外, 美国综合肿瘤网络(National Comprehensive Cancer Network, NCCN)指南也将T-DM1、DS8201a作为其后线治疗的选择。然而, 指南推荐药物单药治疗ORR为31%~55%, 中位PFS为5个月~8.2个月[6, 7, 8], 和理想的治疗方案之间还存在较大距离。
2015年免疫二线治疗方案获批, 开启了NSCLC免疫治疗新时代。目前免疫联合含铂双药化疗方案已经成为了EGFR/ALK野生型晚期NSCLC患者标准一线治疗方案。也就是说, 原则上HER2突变患者标准一线治疗方案也应为免疫联合化疗。然而, 包括IMMUNOTARGET在内的诸多研究均显示[9], 除了EGFR/ALK融合患者外, 诸多少见突变患者接受免疫治疗疗效欠佳。然而, 这些研究仅入组少量HER2突变患者, 亟需高质量证据来指导免疫治疗在HER2突变患者中的应用。从本文两篇文献结论来看, 后线免疫单药治疗HER2突变患者曙光初现, 但一线联合化疗结果似乎相互矛盾。HER2突变患者免疫治疗的地位究竟如何?需考虑以下几个问题:
第一, 目前仍缺乏前瞻性随机研究数据来支持或否定HER2突变晚期NSCLC患者一线治疗标准为化疗联合免疫治疗。由于HER2突变少见, 本文评价的2项研究均为回顾性研究。回顾性研究往往存在选择偏倚, 在缺乏研究对照时, 研究证据等级更低。研究一为单臂回顾性研究, 入组27例一线接受化疗联合免疫治疗患者, ORR为52%, 中位PFS为6个月, 1年OS率为88%, 疗效与野生型人群接受这一方案相似。而研究二为病例对照研究, 回顾性收集了210例HER2变异患者, 接受化疗联合免疫治疗患者与含铂双药化疗患者的PFS无显著性差异, 但数值上劣于化疗联合抗血管新生治疗患者。研究二虽然纳入了2种不同治疗方案作为对照, 但缺乏统计时人群倾向评分匹配, 影响了其结论的证据等级。因此, 目前研究结果尚不能做出完全支持或者否定化疗联合免疫治疗HER2突变晚期NSCLC患者一线治疗的地位。
第二, 两项研究结果差异的主要原因是什么?回顾性研究的特征往往存在选择偏倚。分析两项研究入组人群基线特征, 不难发现研究二中不吸烟患者66.2%, 显著高于研究一中的25%; 研究一入组了13.1%胞外段突变HER2 S310F患者, 而研究二未纳入这一人群。既往研究提示具有驱动基因突变的吸烟肺癌患者更能从免疫治疗中获益[10], 这也部分解释了研究一中HER2突变肺癌患者接受化疗联合免疫治疗疗效具有优势。此外, 本文纳入两项研究肿瘤疗效评估指标主要为ORR和PFS, 疗效评价时不同靶病灶的选取、影像学不同评估手段(CT vs. MRI, 平扫vs. 增强等)、疗效评估间期和患者依从性均会对ORR和PFS有一定的影响, 这也可能是研究二中3个治疗组中ORR较研究一偏低的一个重要原因。
第三, HER2突变晚期NSCLC患者免疫一线治疗前景如何?研究二中化疗联合抗血管对比化疗组结果提示, BEYOND研究治疗模式同样适用于HER2突变肺癌患者, 化疗联合抗血管治疗为当前这类人群优选一线治疗方案。而随着靶向治疗的发展, 以DS8201a为代表的ADC类药物也有望冲击一线治疗的地位。这也使得化疗联合免疫成为HER2突变晚期NSCLC患者标准一线治疗地位受到越来越多的挑战。IMpower150治疗模式在EGFR突变人群中显示成功[11], HER2突变肺癌一线能否采用IMpower150治疗模式?此外, ADC类药物联合免疫治疗能否成为新的一线标准?目前DS8201a联合度伐利尤单抗治疗HER2变异的临床研究(NCT04686305)也在开展之中, 期待这些探索能够开启一线治疗新的大门。
第四, 后线免疫治疗在HER2突变患者中的地位如何?研究一纳入的HER2突变肺癌二线治疗疗效患者ORR, 中位PFS均与既往Ⅲ 期研究报道类似。因此, 免疫治疗是HER2突变肺癌后线治疗的可选择方案。但免疫治疗特点是长尾效应, 免疫时代更关注的是长期生存。纳入后线治疗患者的中位OS为10个月, 和多个NSCLC免疫二线治疗数据还存在一定差距[12]。且目前免疫治疗临床研究已经公布了其优异的3年和5年生存率, HER2突变患者免疫二线治疗能否稳固, 还需要随访获得这类人群接受免疫治疗后长期生存随访的循证医学证据。
综上所述, 目前证据尚不支持HER2突变晚期NSCLC患者一线治疗标准为化疗联合免疫治疗。当前HER2突变肺癌免疫治疗的主要应用场景在后线治疗, 但仍缺乏免疫治疗长期生存的循证医学证据。未来新联合治疗模式有望探索出HER2突变晚期NSCLC患者一线免疫治疗新方案。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|