| 王燕,中国医学科学院肿瘤医院内科主任医师,博士研究生导师。主要擅长肺癌、胸腺瘤、间皮瘤等胸部恶性肿瘤的规范化和个体化治疗,其中对肺癌的精准治疗,包括化疗和分子靶向免疫治疗,以及转化医学研究有较深造诣。近年来尤其在罕见靶点和靶向治疗耐药机制及应对策略上投入了大量精力,大力推广精准检测,提倡精准治疗。现任中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)理事、中国抗癌协会肺癌专业委员会委员、北京肿瘤防治研究会转化医学分委会候任主任委员、北京抗癌协会肺癌专业委员会副主任委员、北京癌症防治学会肺癌免疫治疗专业委员会副主任委员、北京肿瘤学会肺癌专业委员会副主任委员等,在国内外重要肿瘤专业学术杂志,如《Clin Cancer Res》《Lung Cancer》《Theranostics》等以第一或通讯作者发表论文60余篇。参与《临床肿瘤内科手册》《抗肿瘤药物手册》等10余部肿瘤学经典专著的编写,并担任多个肺癌相关专业杂志的编委。主要负责并参与完成了二十余项国际和国内的靶向药物及免疫治疗药物的临床研究,主持国自然1项,承担多个部级和院校级课题。 |
研究一:Le X, Cornelissen R, Garassino M, et al. Poziotinib in non-small-cell lung cancer harboring HER2exon 20 insertion mutations after prior therapies: ZENITH20-2 trial[J]. J Clin Oncol, 2022, 40(7):710-718.
研究二:Song Z, Li Y, Chen S, et al. Efficacy and safety of pyrotinib in advanced lung adenocarcinoma with HER2mutations: a multicenter, single-arm, phase Ⅱ trial[J]. BMC Med, 2022, 20(1):42.
2b。
• Erb-B2受体酪氨酸激酶2(erb-b2 receptor tyrosine kinase 2, ERBB2)突变, 也称为人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)突变, 是肺癌较为少见的驱动基因之一。其中, HER2的第20外显子插入突变在非小细胞肺癌(non-small-cell lung cancer, NSCLC)的发生率为2%~5%, 好发于非吸烟者、女性及腺癌病理类型。目前针对此类患者, 临床上仍没有正式获批的靶向药物。
• 既往数据显示, 吡咯替尼、poziotinib作为不可逆的泛HER家族抑制剂可能对HER2突变的NSCLC患者有一定的疗效。
评估吡咯替尼、poziotinib治疗HER2突变型晚期NSCLC患者的疗效及安全性。
研究一:
• 研究方法:多中心, 单臂, 开放标签的Ⅱ 期临床试验(NCT03318939)。
• 研究对象:经治的HER2第20外显子插入突变的晚期NSCLC患者, 年龄≥ 18岁, 有可测量病灶, 无症状脑转移或脑放疗后病灶维持稳定超过4周。
• 干预措施:入组患者口服poziotinib 16 mg QD。
• 评价指标:主要研究终点为肿瘤客观缓解率(objective response rate, ORR), 次要研究终点为疾病控制率(disease control rate, DCR), 缓解持续时间(duration of response, DOR), 无疾病进展生存期(progression-free survival, PFS), 安全性, 耐受性及健康相关生活质量。
研究二:
• 研究方法:多中心, 单臂, 开放标签的Ⅱ 期临床试验(ChiCTR1800020262)。
• 研究对象:不可切除的Ⅲ B期或Ⅳ 期、初治或经治、HER2突变型NSCLC患者, 年龄≥ 18岁, PS 0~2分, 有可测量病灶。
• 干预措施:入组患者口服吡咯替尼 400 mg QD。
• 评价指标:主要研究终点为6个月无疾病进展生存率, 次要研究终点为ORR, PFS, 总生存期(overall survival, OS), DCR和安全性。
研究一:
自2017年10月至2021年3月期间, ZENITH20研究-队列2共入组90例患者, 中位年龄为60岁。其中64.4%的患者为女性, 65.6%的患者既往无吸烟史。组织病理学方面, 96.7%的患者为腺癌, 3.3%的患者为鳞状细胞癌, 同时有15.6%的患者为无症状的稳定脑转移患者。所有纳入研究的患者既往都接受过治疗(1~6线), 其中27.8%的患者接受过抗HER2治疗。该研究的中位随访时间为9个月, 到数据截止时间(2021年3月5日), 仍有1例患者在接受治疗, 其余89例患者已停止治疗, 停药的主要原因是疾病进展(53例, 58.9%)和不良事件(adverse event, AE)(13例, 14.4%)。
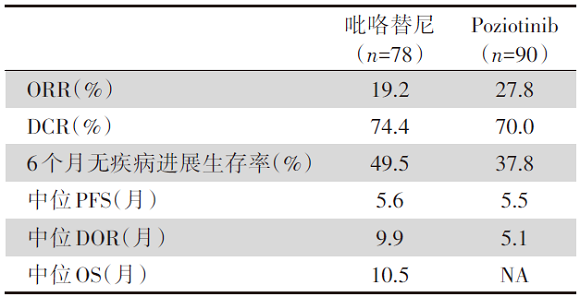
在纳入研究的90例患者中, ORR为27.8%[95%可信区间(confidence interval, CI)18.9~38.2], DCR为70.0%(95%CI 59.4~79.2), 有25例患者疗效评估为部分缓解(partial response, PR), 在这25例患者中, 中位治疗至反应时间为32天, 中位DOR为5.1个月, 其中24%的患者DOR> 6个月。研究中无患者疗效评估为完全缓解(complete response, CR), 大部分患者在治疗后评估有肿瘤缩小(67/90, 74.4%), 患者的中位PFS为5.5个月, 其中37.8%的患者PFS> 6个月。
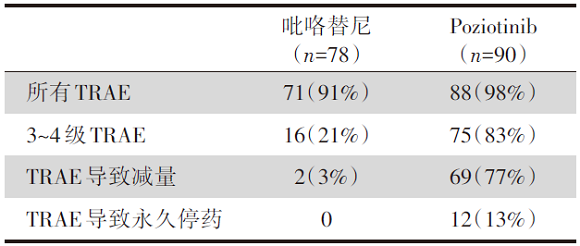
研究中有88例(97.8%)患者报告了治疗相关不良事件(treatment-emergent adverse event, TRAE), 其中71例(78.9%)为3级AE, 4例(4.4%)为4级AE。最常见的TRAE为皮疹(91.1%)、腹泻(82.2%)和口腔粘膜炎(68.9%), ≥ 3级的TRAE为皮疹(48.9%)、腹泻(25.6%)和口腔粘膜炎(24.4%), 治疗相关的皮疹、腹泻和口腔粘膜炎的中位发病时间分别为8天、6天和7天, 有14.4%的患者发生了严重的TRAE, 其中12例(13.3%)患者因TRAE而永久停止治疗。
研究二:
自2018年12月至2020年4月, 该项研究共有78例患者被纳入疗效及安全性分析。中位年龄是62岁, 所有患者均为Ⅳ 期、腺癌, 其中20例患者在入组前诊断有脑转移。7例患者为PS 2分, 其余均为PS 0~1分。21例曾使用过阿法替尼。
在入组的78例患者中, 62例携带有HER2第20外显子突变(79.5%), 其中Y772_A775dup和G776delinsVC分别为42例和11例, 其他20外显子突变类型有9例。16例(20.5%)为非第20外显子突变。2例患者同时携带2个HER2突变位点。在总共检测到的81个HER2突变位点中, 73个在激酶结构域, 3个在跨膜结构域, 3个在胞外结构域, 另外2个在编码区其他区域。
主要研究终点:6个月PFS率为49.5%(95%CI 39.2~60.8), 12个月的PFS和OS发生率分别为28.4%和38.6%。中位PFS和OS为5.6个月(95%CI 2.8~8.4个月)和10.5个月(95%CI 8.7~12.3)。中位持续缓解时间为9.9个月(95%CI 6.2~13.6), DCR为74.4%(58/78)。ORR为19.2%(15/78), 15例患者PR, 其中11例为第20外显子突变, 3例为19外显子突变, 1例为17外显子突变。
20外显子突变患者的ORR为17.7%, 其中Y772_A775dup, G776delinsVC和其他20外显子突变亚型的ORR分别为23.8%, 0和11.1%。此外, 非20外显子突变患者的ORR为25.0%, 与20外显子相比, 没有统计学差异。值得注意的是, 在6例19外显子突变患者中, 3例获得PR, ORR高达50%。
任何级别的TRAE发生率为91.0%(71/78), 绝大多数为1级或2级。最常见的TRAE是腹泻(85.9%), 其次是疲劳(57.7%)、贫血(35.9%)、头晕(33.3%)、食欲下降(32.1%)、手足综合征(32.1%)、恶心(32.1%)。16例(20.5%)患者发生3级TRAE, 包括腹泻13例(16.7%), 贫血2例(2.6%), 疲劳1例(1.3%)。本研究没有发生4级或更高级别的治疗相关不良事件。4例患者因TRAE中断治疗, 21例患者因毒性减量。
两种pan-HER抑制剂的疗效及安全性数据对比见表1和表2。
| 表1 吡咯替尼 vs. poziotinib疗效比较 |
| 表2 吡咯替尼 vs. poziotinib安全性比较 |
pan-HER抑制剂吡咯替尼和poziotinib在HER2突变型NSCLC患者中显示出一定的抗肿瘤活性。
HER2作为非小细胞肺癌(NSCLC)少见驱动基因, 其主要活化致癌形式为第20号外显子插入突变, 发生率约占肺癌的2%~5%[1]。携带HER2基因20号外显子插入突变的NSCLC恶性度高, 传统化疗治疗此类人群的ORR约10%~43.5%, 中位PFS仅为4.3~6.0个月[2, 3]。传统的特异性抗HER2小分子酪氨酸激酶抑制剂如阿法替尼、达可替尼、奈拉替尼对其有效率更低, ORR仅为3.8%~12%[4, 5, 6]。至今, 国际仍尚无获批抗HER2小分子激酶抑制剂特定治疗携带HER2突变的NSCLC。长期以来, 在NSCLC中HER2突变作为预后不良的分子标志物, 一直缺乏有效的全身治疗方案。基于此, 近年来, 一些新型泛HER激酶抑制剂在HER2突变型NSCLC研究中崭露头角, 相关大样本临床试验显示出了其较好的临床活性, 为此类患者的靶向治疗带来了新希望。
作为一种新型EGFR/HER2/HER4激酶抑制剂, poziotinib在最初体外细胞实验中被发现对EGFR和HER2基因20号外显子插入突变有着不错的抗肿瘤活性[7, 8]。研究一ZENITH20研究-队列2是目前样本量最大的NSCLC HER2基因20号外显子插入突变研究队列, 结果表明poziotinib(16 mg 口服, 每日1次)治疗既往经一线治疗耐药进展的HER2基因20号外显子插入突变NSCLC患者ORR为27.8%, DCR为70%, 中位PFS为5.5个月, 中位DOR为5.1个月。且poziotinib在既往经多种治疗模式后耐药、存在中枢神经系统转移和不同插入突变亚型患者中均显示出了临床获益[9]。
吡咯替尼(pyrotinib)作为另一种中国原研新型泛HER抑制剂, 同样可抑制EGFR/HER2/HER4激酶。在NSCLC中, 体外动物实验模型也表明吡咯替尼相较于阿法替尼或抗体偶联药物T-DM1, 对携带HER2基因20号外显子插入突变的细胞有着更强的抗肿瘤活性[10]。研究二的结果表明, 吡咯替尼单药治疗经一线化疗耐药的HER2基因20号外显子插入突变NSCLC, ORR为30%, 中位PFS为6.9个月[11]。随后, 在另一项Ⅱ 期多中心、单臂临床试验中, 吡咯替尼(400 mg口服, 每日一次)治疗HER2突变型NSCLC的半年PFS率为49.5%, ORR为19.2%, 中位PFS为5.6个月, 中位DOR为9.9个月, 中位OS为10.5个月。治疗相关不良事件均为3级及以下, 最常见不良反应为腹泻(85.9%)。携带20号外显子插入突变和非20外显子突变的患者ORR分别为17.7%和25.0%。HER2突变消失和EGFR/HER2扩增的出现在吡咯替尼耐药进展后被检测发现[12]。
上述临床研究在NSCLC抗HER2靶向治疗领域, 让肿瘤内科医生和患者受到了鼓舞, 也看到了未来靶向治疗的新希望。但是, 我们在NSCLC抗HER2靶向治疗这条路上, 还需要理性思考, 因为还有下述几个临床存在但尚未解决的问题:
第一, poziotinib和吡咯替尼在大样本临床试验中均展示了对既往治疗失败的HER2突变NSCLC有着不错的临床疗效, 但相较于已获批的DS-8201, 无论是ORR还是PFS都不占优势, 因此后续获批过程中会受到挑战。而且这两个前瞻性研究均为单臂Ⅱ 期研究, 尤其是研究二与之前另一个Ⅱ 期研究的结果有较大差异, 更是提醒我们要审慎看待, 所以特别期待吡咯替尼与多西他赛随机对照研究的结果早日公布。同样是泛HER抑制剂, poziotinib和吡咯替尼孰优孰劣?有无必要进行随机对照研究?大家也是拭目以待。此外, 鉴于传统的一线含铂方案化疗以及化疗联合免疫在此类患者中疗效极其有限[13], 一线新型抗HER2靶向治疗, 包括小分子药物和抗体偶联药物(antibody-drug conjugate, ADC), 能否有勇气前移?如果进一步拓展, 如何设计HER2突变晚期NSCLC的前瞻性多队列联合治疗临床试验, 也是值得关注的。
第二, 虽然poziotinib和吡咯替尼在HER2突变型NSCLC的相关研究中显示出临床获益, 但药物治疗副反应较为明显。poziotinib的3级以上不良事件主要为皮肤及消化道毒性, 包括皮疹、腹泻、胃炎, 且16 mg每日一次的试验剂量下, 76.7%患者被迫由于治疗毒性进行药物减量, 13.3%的患者因治疗毒性永久停药。从药物安全性及口服耐受性角度来看, poziotinib对皮肤及消化道毒性的制药工艺优化处理或每日给药剂量的探索性调整, 是后续研究中需要注意的问题。虽然吡咯替尼治疗相关不良事件均为3级及以下, 但最常见不良反应依旧集中在消化道, 腹泻高达85.9%。后续临床实践中如何有效降低此类泛HER激酶抑制剂的皮肤和消化道毒性, 是后续药物研发和临床治疗应用中需要面对的问题。
第三, poziotinib和吡咯替尼单药二线或二线以上治疗HER2突变NSCLC的ORR在30%左右, 中位PFS为5.5~6.9个月, 疗效数据上还不足以满足患者的治疗需求。在EGFR突变NSCLC中, EGFR靶向治疗药物联合抗血管生成药物的“ A+T” 治疗模式, 对比酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)单药治疗, 疗效进一步提高, OS也进一步延长。但在HER2突变中, 目前抗HER2靶向治疗药物均为单药治疗, 尚未有前瞻性联合治疗模式的探索性研究面世。2021年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)会议报道, 吡咯替尼联合阿帕替尼治疗耐药性HER2突变NSCLC, 虽然相较单药吡咯替尼, 在ORR(45.5% vs. 30%)和中位OS(12.9个月 vs. 10.9个月)数值上有一定提高, 但中位PFS(6.8个月 vs. 6.9个月)未见提高[14]。后续新型抗HER2靶向治疗药物的有效联合治疗模式, 也是未来临床探索的方向。
第四, HER2突变消失和EGFR/HER2扩增的出现在吡咯替尼耐药进展后被发现, 目前可能为吡咯替尼治疗后的耐药原因, 但目前世界上普遍缺乏NSCLC中对抗HER2靶向治疗进展的耐药原因分析。NSCLC中HER2突变的治疗耐药, 更多的依赖HER2通路, 还是旁路信号转导通路的激活目前尚不清楚, 未来需要开展更多细胞学实验或借助类器官模型研究NSCLC中HER2靶向治疗耐药原因, 以便开展克服耐药性的新一代靶向药物研发工作。
第五, 无论poziotinib还是吡咯替尼在相关临床研究数据中都显示出了一定的入脑活性, 但相比EGFR/ALK靶向治疗药物, 其抗脑转移治疗活性远远未达到临床需求。在HER2阳性脑转移的乳腺癌中, 新型抗HER2靶向药物tucatinib显现出了强大的入脑活性, 能较好的抑制HER2阳性乳腺癌患者的脑转移灶, 但在NSCLC中, 目前tucatinib尚未有临床研究进行探索。提高泛HER激酶抑制剂对HER2靶点的选择性, 以及提升该类药物透血脑屏障的能力, 是未来制药和临床研究人员需要优化的问题。
综上所述, 以poziotinib和吡咯替尼为代表的新型泛HER激酶抑制剂在HER2突变晚期NSCLC中展现出了良好的抗肿瘤能力, 但仍需要进一步研究证实。也期待在HER2突变NSCLC研究领域, 能尽早有小分子靶向药物上市, 为患者提供更多治疗选择。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|