| 徐崇锐,医学博士,广东省肺癌研究所、广东省人民医院肺内科副主任医师,主要研究方向为肺癌多学科综合治疗;美国纽约纪念斯隆凯特琳肿瘤中心(Memorial Sloan Kettering Cancer Center, MSKCC)访问学者。 目前担任中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)青年委员会常务委员,广东省基层医药协会肺癌专业委员会副主任委员。以第一或共同第一作者在《Cancer Cell》《J Thorac Oncol》《J Hematol Oncol》等杂志发表SCI论文10余篇,荣获中华医学科技奖一等奖1项、广东省科学技术奖励一等奖1项。 |
研究一:Li B T, Michelini F, Misale S, et al. HER2-mediated internalization of cytotoxic agents in ERBB2 amplified or mutant lung cancers[J]. Cancer Discov, 2020, 10(5):674-687.
研究二:Mazieres J, Lafitte C, Ricordel C, et al.Combination of trastuzumab, pertuzumab, and docetaxel in patients with advanced non-small-cell lung cancer harboring HER2 mutations: results from the IFCT-1703 R2D2 trial[J]. J Clin Oncol, 2022, 40(7):719-728.
研究三:Li B T, Smit E F, Goto Y, et al. Trastuzumab deruxtecan in HER2-mutant non-small-cell lung cancer[J]. New Engl J Med, 2022, 386(3):241-251.
1b。
人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)是一种跨膜受体酪氨酸激酶, 主要变异形式为突变, 扩增或者过表达。HER2主要在15%~20%乳腺癌、胃癌中过表达, 在非小细胞肺癌(non-small-cell lung cancer, NSCLC)患者中HER2突变约占3%左右。目前靶向HER2的治疗包括HER2酪氨酸酶抑制剂(tyrosine kinase inhibitor, TKI)、抗体和抗体药物偶联物(antibody-drug conjugate, ADC)。HER2-TKI、HER2-ADC已经改变了HER2阳性乳腺癌、胃癌的治疗标准。但是HER2靶向治疗尚未被批准用于NSCLC患者。目前, HER2突变(大约3%)的NSCLC患者以接受标准化疗或者免疫治疗为主, 疗效有限。在既往接受HER2-TKI的患者中, 客观有效率为0~30%不等。而靶向HER2的ADC作为近年来的新的突破, 在肺癌中的临床疗效及生物标志物罕有探索。
• 研究一:整合临床试验的疗效与实验室体内体外实验的反应机制, 探索提高HER2-ADC疗效的策略。
• 研究二:评估曲妥珠单抗、帕妥珠单抗联合多西他赛治疗HER2突变NSCLC的有效性与安全性。
• 研究三:评估trastuzumab deruxtecan(T-DXd)治疗HER2突变NSCLC的有效性与安全性。
研究一:发表于《Cancer Discov》, 关于恩美曲妥珠单抗(trastuzumab emtansine, T-DM1)的研究。
• 研究方法:前瞻性、单中心Ⅱ 期临床试验和实验室体内体外平行实验。
• 研究时间地点:截止2019年8月1日在纪念斯隆凯特琳癌症中心(Memorial Sloan Kettering Cancer Center, MSKCC)Ⅱ 期篮子试验入组的HER2变异肺癌患者(NCT02675829)。
• 研究对象:HER2突变或者扩增、过表达的患者, 将它们的肿瘤样本接种至6周龄雌性(nonspecific interaction, NSI)裸鼠上使用T-DM1进行治疗平行实验。在乳腺癌细胞系(MCF10A)及肺癌细胞系(NCI-H2030)中通过慢病毒转染构建不同变异形式HER2细胞株, 使用一种pH敏感的染料(PHRODO-T-DM1)来表征HER2-ADC的内化作用, 以判断HER2-ADC的抗肿瘤作用。
• 干预措施:临床试验给予患者T-DM1 3.6 mg/kg静脉注射, 每21天为一个疗程。裸鼠接种的人源肿瘤异种移植模型(patient-derived xenograft, PDX)长至100 mm3后用T-DM1、来那替尼和T-DXd治疗。
• 评价指标:主要终点是T-DM1的有效率与安全性, 通过动物实验与临床实验评估最佳疗效标志物, 比较不同方法对HER2-ADC内化作用和T-DM1的影响。
研究二:发表于《J Clin Oncol》, 关于曲妥珠单抗+帕妥珠单抗+多西他赛的研究。
• 研究方法:前瞻性、单臂、多中心Ⅱ 期临床试验(NCT03845270)。
• 研究时间地点:2019年5月至2020年10月, 在法国多家医院接受治疗的HER2突变肺癌患者。
• 研究对象:纳入标准为组织学或细胞学证实的不可手术和不适合放射治疗的Ⅲ 期或Ⅳ 期非鳞NSCLC; 法国国家癌症研究所检测核实的HER2驱动基因突变; 治疗前至少接受过一次铂类为基础的治疗; 既往未接受HER2抑制剂治疗; 有可评价测量病灶等。
• 干预措施:帕妥珠单抗首次负荷量为840 mg, 3周一次一周期; 第2周期维持剂量420 mg, 3周一次。曲妥珠单抗首次负荷量为8 mg/kg, 3周一次一周期; 第2周期维持剂量6 mg/kg, 每3周一次。多西他赛75 mg/平方米体表面积, 每3周一次。
• 评价指标:主要终点为纳入患者的客观缓解率(objective response rate, ORR); 次要终点为无进展生存期(progression-free survival, PFS)、应答持续时间(duration of response, DOR)、总生存期(overall survival, OS)等等。
研究三:发表于《N Engl J Med》, 关于T-DXd的研究。
• 研究方法:前瞻性、开放、国际多中心Ⅱ 期临床试验(NCT03505710)。
• 研究时间地点:2018年5月30日至2020年7月21日的北美、欧洲、日本的HER2突变或过表达肺癌患者。
• 研究对象:纳入标准为组织学或细胞学证实的不可手术的Ⅲ 期或Ⅳ 期非鳞NSCLC; 治疗前接受标准治疗或标准治疗复发患者; 组织测序证实HER2驱动基因突变; 既往未接受HER2抗体或HER2-ADC药物治疗; 有可评价测量病灶等。
• 干预措施:T-DXd 6.4 mg/kg, 每3周一次。
• 评价指标:主要终点为纳入患者的ORR; 次要终点为DOR、疾病控制率(disease control rate, DCR)、PFS、OS等等。
• 研究一:
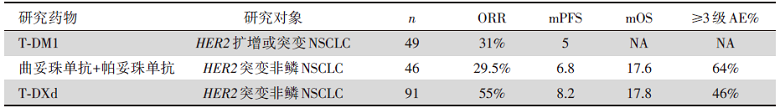
在慢病毒转染的HER2基因突变乳腺癌及肺癌细胞系中, 研究发现HER2突变或者扩增肿瘤更容易介导HER2-ADC的内化从而更好地控制肿瘤的生长, 锆89-T-DM1标记的PET-CT成像也显示T-DM1在HER2突变或扩增的肿瘤中聚集。在49例入组的HER2突变或扩增NSCLC患者中, 根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)1.1评价标准, T-DM1的ORR为31%[13/42, 95%可信区间(confidence interval, CI):18~47], 中位PFS为5个月。动物实验及临床患者治疗显示T-DM1联合来那替尼的抗肿瘤效果及耐受性良好; T-DXd则相较T-DM1显示出更强的抗肿瘤疗效。
• 研究二:
在接受治疗的44例可评价患者中, ORR为29.5%(13/44, 95%CI 17.8%~40.0%)。中位PFS为6.8个月(95%CI 4.0~8.5); 1年PFS率为29%(95%CI 15.2%~44.4%); 中位DOR为11.0个月(95%CI 2.9~14.9); 中位OS为17.6个月(95%CI 11.6%~18.9%)。在14例脑转移患者中, 2例患者获得了客观缓解。没有患者因为毒副反应而停止治疗。64%的患者观察到3/4级治疗相关不良事件。最常见的3级以上治疗相关不良事件是中性粒细胞减少(33%)、腹泻(13%)和贫血(9%)。
• 研究三:
在接受T-DXd治疗的91例患者中, 86例(95%)患者既往接受了铂类为主的治疗, 60例(66%)患者接受了程序性死亡受体1(programmed death 1, PD-1)/程序性死亡配体1(programmed death ligand 1, PD-L1)抑制剂治疗。独立评审委员会确认的ORR为55%(50/91), DCR为92%(95%CI 85%~97%)。中位DOR为9.3个月(95%CI 5.7~14.7), 中位PFS为8.2个月(95%CI 6.0~11.9), 中位OS为17.8个月(95%CI 13.8~22.1)。在33例中枢神经系统转移的患者中, 中位PFS为7.1个月(95%CI 5.5~9.8), 中位OS为13.8个月(95%CI 9.8~20.9)。42例(46%)发生了3级或以上的药物相关不良事件。最常见的3级或以上的药物相关不良事件是中性粒细胞减少(19%)和贫血(10%)。24例(26%)患者发生了与药物相关的间质性肺疾病。
通过3个系列研究的结果对比(表1), 证实了HER2-ADC在治疗HER2突变NSCLC的有效性与安全性。HER2-ADC, 尤其是T-DXd在HER2经治患者中体现出持久的抗肿瘤活性与较好的安全性, 已经被美国综合肿瘤网络(National Comprehensive Cancer Network, NCCN)指南推荐为HER2突变NSCLC的标准治疗。
| 表1 3个研究中HER2-ADC在HER2变异型肺癌中的疗效与安全性对比 |
人表皮生长因子2(human epidermal growth factor 2, HER2, erbB-2/neu)是表皮生长因子酪氨酸激酶家族的成员之一。在肿瘤细胞中, HER2变异后可不依赖于配体, 直接通过形成二聚体, 激活酪氨酸激酶, 活化下游信号通路, 导致肿瘤细胞增殖、侵袭及转移。因而HER2成为药物研究开发的重要靶点, 也是常用的生物标志物之一。
在肺癌中, HER2变异包括突变、扩增、过表达三种形式, 突变的发生率为2%~4%[1], 扩增采用荧光原位杂交(fluorescent in situ hybridization, FISH)和二代测序(next generation sequencing, NGS)的检出率分别为10%~20%和2%~4%[2], 过表达(免疫组化2+或3+)的阳性率为2%~30%[2], 而针对HER2变异的治疗刚刚崭露头角, 本篇循证评价纳入了3篇肺癌领域针对HER2突变的研究。Bob Li等发表于《Cancer Discov》上的研究[3]通过PDX动物模型验证了ADC恩美曲妥珠单抗和trastuzumab deruxtecan(T-DXd)对HER2突变或过表达型肺癌的疗效。DESTINY-Lung01研究中[4], 91例HER2突变NSCLC患者接受T-DXd治疗, 客观有效率(objective response rate, ORR)为55%, 中位无进展生存期(progression free survival, PFS)为8.2个月, 46%的病例出现3级以上不良反应, 其中间质性肺炎的发生率为26%, 2例因此死亡。IFCT-1703-R2D2研究[5]采用曲妥珠单抗/帕妥珠单抗/多西他赛二线治疗45例HER2突变晚期NSCLC患者, ORR为29%, 疾病控制率(disease control rate, DCR)为87%, 中位PFS为6.8个月, 3/4级不良反应发生率达到64%, 这一结果显示了二线化疗联合HER2单克隆抗体的有效性与安全性。
由于DESTINY-Lung01研究的成功, 2022-08-11美国FDA批准T-DXd用于HER2突变晚期NSCLC的治疗, HER2突变毋庸置疑将成为肺癌下一个治疗靶点, 但依然有以下问题值得进一步探索:
(1) HER2突变之外, HER2扩增与过表达的肺癌患者是否可以从抗HER2的治疗中获益?
HER2变异包括突变、扩增与过表达3种, 在乳腺癌中, 曲妥珠单抗治疗的疗效与HER2过表达、扩增明确相关, 而T-DXd在HER2高表达[6]乃至低表达[7]的乳腺癌中均有出色的疗效, 但在肺癌中抗HER2治疗的疗效似乎在HER2突变人群中更加明确, DESTINY-Lung01已发表的结果显示, HER2突变患者的疗效与HER2基因的表达或扩增无明显相关, 而DESTINY-Lung01研究的另外一部分中, T-DXd治疗49例HER2过表达(免疫组化3+或2+)肺癌患者, ORR为24.5%, DCR为69.4%, 中位PFS为5.4个月, 中位OS为11.3个月, 3度以上药物相关不良反应达到55.1%, 间质性肺炎的发生率为16.3%[8]。Bob T. Li的研究[3]也提示HER2-ADC作用于肺癌细胞可能更加依赖于HER2突变而不是过表达。这均提示从HER2-ADC治疗中获益的人群在肺癌和乳腺癌中可能具有不同的分子特征。
(2) HER2-ADC药物和HER2酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI)及单克隆抗体药物的选择?
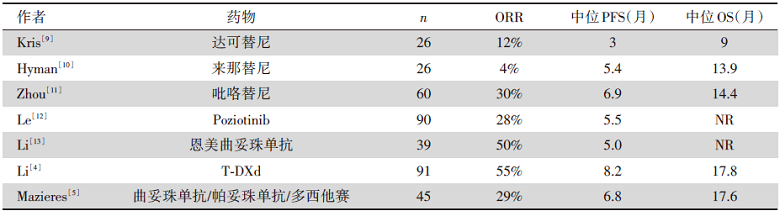
以HER2为靶点的药物目前包括3大类, 分别是抗体类:曲妥珠单抗、帕妥珠单抗等; TKI类:阿法替尼、达可替尼、拉帕替尼、吡咯替尼、来那替尼、tucatinib、poziotinib、mobocertinib、tarloxotinib等; ADC类:恩美曲妥珠单抗、T-DXd、trastuzumab duocarmazine, ZW-49等。在肺癌中, 多个小样本的单臂研究采用不同药物进行了尝试(见表2), 结果大相径庭, 初步看来, ADC药物的效果要优于其他两类药物。目前更多的研究都着眼于ADC药物, 但ADC和其他两类药物的联合使用是否可以提升疗效值得进一步研究。
| 表2 不同抗HER2药物在HER2突变肺癌中的疗效 |
(3) T-DXd的合适剂量?
在T-DXd的Ⅰ 期研究[14]中, 5.4 mg/kg和6.4 mg/kg作为后续研究的推荐剂量。DESTINY-Lung01研究选择了6.4 mg/kg, 在这一剂量下, 不良反应发生率较高, 尤其是间质性肺炎的发生率达到26%, 2例患者因间质性肺病(interstitial lung disease, ILD)死亡。而乳腺癌中的DESTINY-Breast01[6]和DESTINY-Breast03[15]研究采用的剂量为5.4 mg/kg, ILD的发生率为13.6%和10.5%。因此在肺癌中降低T-DXd的剂量至5.4 mg/kg可能是获得更好安全性的方法之一。
(4) ADC药物与免疫治疗之间的关系?
目前对于驱动基因阴性晚期NSCLC, 一线治疗的首选方案是铂类为基础的双药化疗联合免疫治疗, Saalfeld的研究[16]显示, 对于HER2突变晚期NSCLC患者, 一线免疫治疗客观有效率为52%, 中位PFS为6个月, 1年PFS率21%, 这一结果数值上与目前HER2-ADC的结果相近。一线治疗选择铂类为基础的双药化疗联合免疫治疗还是HER2-ADC, 目前, 头对头比较两个方案的Ⅲ 期临床研究DESTINY-Lung04研究[17]正在开展中, 其结果有望回答这个问题。
(5) HER2不同突变类型之间的差别?
肺癌EGFR基因活化突变主要见于激酶区, 其它区域的突变与TKIs治疗的疗效无明确相关性。而HER2突变发生的区域, 除了最常见的位于激酶区的20外显子插入突变外, 其它的突变类型还包括激酶区L755S、V777L、跨膜区V659E、胞外区S310Y/F等, 因肺癌HER2突变发生率低, 具体分型每种突变类型的病例极为少见, 不同类型突变对于抗HER2治疗的疗效仅见于个案报道, 是否需要区分不同类型突变选择治疗方案尚没有答案。
总的来说, HER2-ADC药物进入肺癌领域, 尤其是T-DXd在HER2突变肺癌中的出色疗效, 使HER2突变成为肺癌的下一个治疗靶点, 为HER2突变肺癌提供更多的治疗手段。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|