作者简介:
徐娟(1983-),女,山东淄博人,主治医师,医学硕士,主要研究方向为各种类型肝病及肝癌早筛。
目的 评估循环游离细胞DNA(circulating free DNA,cfDNA)检测联合肝脏核磁共振成像(magnetic resonance imaging,MRI)在肝细胞癌筛查中的应用价值。方法 选择126例高度疑似肝癌的患者为研究对象,根据病理学检查结果,其中82例为肝癌患者(肝癌组),44例为良性肿瘤患者(良性组),比较两组患者cfDNA、RNaseP基因(cfDNA池基因编码DNA的参考基因)拷贝、肝功能指标,包括丙氨酸转氨酶(alanine transaminase,ALT)、天冬氨酸转氨酶(aspartate transaminase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)及肿瘤标志物水平,包括甲胎蛋白(alpha-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖链抗原199(carbohydrate antigen,CA199)。比较cfDNA水平与肝细胞癌病理参数的关系,并评估RNaseP联合MRI在肝细胞癌中的诊断效能。结果 肝癌组的cfDNA、RNaseP基因拷贝、AFP、CEA、CA199、ALT、AST、ALP均明显高于良性组,差异均具有统计学意义( P<0.05)。肝癌患者的Child-Pugh评分、终末期肝病模型评分、肿瘤大小、转移、酒精性肝炎阳性在低cfDNA(<20 ng/mL)组和高cfDNA(≥20 ng/mL)组均具有统计学差异( P<0.05)。RNaseP基因检测联合MRI在HCC诊断的灵敏度明显高于RNaseP基因液体活检( χ2=9.043, P=0.003)和MRI( χ2=7.12, P=0.006)。结论 肝细胞癌患者的cfDNA明显升高,cfDNA水平高低与肝细胞癌病理参数相关,cfDNA的参考基因RNaseP检测联合MRI对肝细胞癌筛查具有更优的应用价值。
Objective To evaluate the application value of cfDNA detection combined with liver MRI in the screening of hepatocellular carcinoma.Methods 126 patients with highly suspected liver cancer were selected as the research objects. According to the results of pathological examination, 82 of them were hepatocellular cancer patients (hepatocellular cancer group) and 44 were benign tumor patients (benign group). The two groups of cfDNA, RNaseP (cfDNA reference gene) gene copy, liver function indexes [alanine transaminase (ALT), aspartate transaminase (AST), alkaline phosphatase (ALP)] and tumor marker levels (alpha-fetoprotein (AFP), carcinoembryonic antigen (CEA), carbohydrate antigen (CA199) were compared. The relationship between cfDNA levels and pathological parameters of hepatocellular carcinoma was studied. And the diagnostic efficacy of RNaseP gene copy combined with MRI in hepatocellular carcinoma was evaluated.Results The cfDNA, RNaseP gene copy, AFP, CEA, CA199, ALT, AST and ALP of the liver cancer group were significantly higher than those of the benign group, and the differences were statistically significant ( P<0.05). The Child-Pugh score, end-stage liver disease model score, tumor size, metastasis, and alcoholic hepatitis positive of liver cancer patients were statistically significant in the low cfDNA (<20 ng/mL) group and high cfDNA (≥20 ng/mL) group Difference ( P<0.05). The sensitivity of RNaseP gene copy combined with MRI in the diagnosis of hepatocellular cancer was significantly higher than that of RNaseP gene copy ( χ2=9.043, P=0.003) and MRI ( χ2=7.12, P=0.006).Conclusions The cfDNA of patients with hepatocellular carcinoma was significantly increased. The level of cfDNA was related to the pathological parameters of hepatocellular carcinoma. cfDNA reference gene RNaseP detection combined with MRI had better application value for screening of hepatocellular carcinoma.
肝细胞癌(hepatocellular carcinoma, HCC)是全球第三大与癌症相关的死亡原因, 其5年生存率低于10%[1, 2]。高死亡率主要归因于潜在的肝脏疾病, 尤其是在无法再提供治疗的晚期诊断中。对于早期肝癌, 目前几种治疗方法可供选择, 包括手术切除、移植和微介入治疗, 可将5年生存率提高至70%[3]。核磁共振成像(magnetic resonance imaging, MRI)是HCC诊断的金标准, 但是由于运营成本高昂, 其在临床实践中的使用主要保留给有可疑病变的患者。此外, MRI在检测直径小于10 mm的恶性病变方面存在局限性[4, 5], 并且具有公认的诊断HCC的影像学标准的特点是特异性高(接近100%), 但灵敏度低(约70%)。因此, 通过MRI这些标准筛查手段将会错过肝癌的前体或早期形式。因此, 迫切需要新颖的生物标志物来鉴定罹患HCC风险较高的肝硬化患者。由于细胞凋亡或坏死, 循环游离细胞DNA(circulating free DNA, cfDNA)在血液中释放。cfDNA作为一种新型的肿瘤生物标志物已引起广泛关注。目前研究提示在不同类型的恶性肿瘤中均具有预测和预后价值[6, 7], 而且, 在HCC患者中可检测到的cfDNA数量相当可观[8]。在尚无法通过标准成像识别出HCC的分期时, cfDNA的水平可能表明在某个阶段朝着恶性发展的异常改变。RNaseP基因是一种单拷贝基因, 编码核糖核酸酶P的RNA部分, 常作为cfDNA池中基因编码DNA水平的指标[7]。鉴于此, 本文研究cfDNA液体活检联合肝脏MRI在高度疑似HCC患者筛查中的应用价值。
选择2018年3月至2021年3月胜利油田中心医院收治的126例高度疑似HCC的患者为研究对象, 其中男性70例, 女性56例; 年龄33~78岁, 平均年龄(56± 10.41)岁。研究对象纳入标准:存在肝痛、上腹闷胀、腹痛、食欲减退、乏力、消瘦、黄疸、腹水、发热或下肢水肿等症状; 存在肝肿大或上腹部包块; 入院时均接受MRI检查和cfDNA、RNaseP检测, 且MRI检查提示肝内存在实质性占位; 无精神障碍和意识障碍。排除标准包括:存在其他癌症及已出现转移; 存在心、肾、肺等重要器官的功能障碍; 在造血系统异常; 进入研究时已进行免疫治疗、靶向治疗或放化疗; 存在MRI禁忌症。根据病理学检查结果, 126例高度疑似肝癌的患者中82例为肝癌患者(肝癌组); 44例为良性肿瘤患者(良性组)。两组患者的平均年龄、体质量指数(body mass index, BMI)、病史、性别构成比等一般资料差异均无统计学意义(P> 0.05)。
使用1.5 T MR扫描仪上进行MRI检查, 扫描参数:TR 2 000~6 000 ms, TE 70~80 ms, 视野350 mm× 350 mm, 矩阵252 mm× 180 mm, 层厚5 mm, 间距1 mm。检查前30 min口服温开水250 mL, 取患者仰卧位, 进行T1加权梯度回波序列成像; 未增强的T1-w同相和相对相位; 在晚期动脉(25 s), 门静脉期(70~80 s)和静脉期(180 s)阶段静脉内注射对比剂后, 进行T1-w 梯度回波序列成像, 轴向, 层厚5 mm; T2加权涡轮自旋回波序列成像, 扩散加权成像参数(b值50、400、800)。
使用EDTA-K2抗凝管采集5 mL静脉血, 在30 min内离心, 离心条件:3 000 rpm, 5 min, 4℃, 离心后收集血浆, 并储存在-80℃冰箱直到使用。提取血浆中的DNA, 质控合格后采用荧光定量聚合酶链反应进行cfDNA水平检测[9]。RNaseP基因编码DNA拷贝通过使用测量RNaseP检测试剂盒(Applied BiosystemsTM, 货号:4316831)。同时, 采用血清分离胶管采集3 mL静脉血, 分离血清后进行肝功能包括丙氨酸转氨酶(alanine transaminase, ALT)、天冬氨酸转氨酶(aspartate transaminase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)及肿瘤标志物水平, 包括甲胎蛋白(alpha-fetoprotein, AFP)、癌胚抗原(carcinoembryonic antigen, CEA)、糖链抗原199(carbohydrate antigen, CA199)检测。
采用IBM SPSS Statistics 21.0.0(IBM Corporation, 纽约, 美国)统计学软件进行统计分析, 计量资料以平均数± 标准差表示, 计数资料以百分比形式表示。两组见计量资料的比较采用t检验, 计数资料采用卡方检验, 采用受试者工作特征曲线(receiver operating characteristic curve, ROC)评价RNaseP基因、MRI、RNaseP基因联合MRI的诊断价值, 以P< 0.05为差异具有统计学意义。
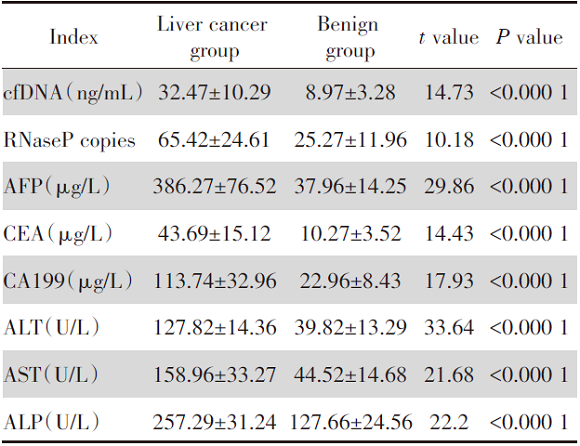
肝癌患者的cfDNA、RNaseP、AFP、CEA、CA199、ALT、AST、ALP均明显高于良性组, 差异均具有统计学意义(P< 0.05), 见表1。
| 表1 两组患者cfDNA、肝功能及肿瘤标志物水平的比较 Tab.1 Comparison of cfDNA, liver function and tumor marker levels between the two groups |
82例肝癌患者cfDNA的中位数为20 ng/mL, 其中cfDNA< 20 ng/mL(低cfDNA组)有33例, ≥ 20 ng/mL(高cfDNA组)有49例。患者的Child-Pugh评分、终末期肝病模型评分、肿瘤大小、转移、酒精性肝炎阳性在低cfDNA组和高cfDNA组具有统计学差异(P< 0.05), 而性别、年龄、BMI、大血管浸润、HBV病毒阳性、HCV病毒阳性在低cfDNA组和高cfDNA组之间均无明显差异(P> 0.05), 见表2。
| 表2 cfDNA与肝癌患者病理参数的关系 Tab.2 The relationship between cfDNA and pathological parameters of liver cancer patients [n(%)] |
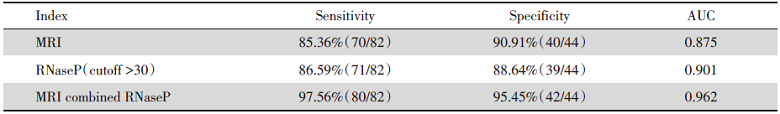
RNaseP和MRI在HCC诊断的灵敏度方面无明显差异(P> 0.05)。但RNaseP检测联合MRI在HCC诊断的灵敏度明显高于单独RNaseP(χ 2=9.043, P=0.003)和MRI(χ 2=7.12, P=0.006)。RNaseP、MRI、RNaseP检测联合MRI在HCC诊断的特异度方面均无明显差异, 见表3。
| 表3 RNaseP、MRI、RNaseP联合MRI的诊断效能的比较 Tab.3 Comparison of the diagnostic efficacy of RNaseP, MRI, RNaseP combined with MRI |
晚期HCC的5年生存率低于10%, 导致HCC的危险因素包括HBV和HCV感染、酗酒、肝硬化以及接触黄曲霉毒素B1[10]。早期发现HCC可将死亡率降低约37%, 而缺乏早期肝癌诊断标志物已对包括肝切除和肝移植在内的治愈性治疗提出了重大挑战[11]。AFP是HCC早期检测中使用最广泛的生物标志物, 但是, AFP对早期HCC检测的可靠性差且灵敏度较低[12]。目前美国国立综合肿瘤网络(National Comprehensive Cancer Network, NCCN)指南建议每6个月对高危人群进行腹部超声检查, 并进行AFP的监测, 但这种监测无法检测到将近40%的早期HCC病例[12, 13]。MRI是当前HCC诊断的影像学金标准, 如果符合包括病变大小(≥ 10 mm)和特定血液动力学特征(如动脉增强和静脉冲洗)在内的标准, 则可疑的结节性病变可通过MRI确诊。尽管随着新标准的引入, MRI对≥ 20 mm病变的敏感性从76%增至96%[14], 但是检测较小的病变, 例如在肿瘤的第一发展阶段发现的病变, 仍然是一个挑战, 在1~2 cm的病灶中, 即便存在典型的洗入和洗出标准, 其诊断的灵敏度仅为71%[3]。因此, 联合其他筛查技术来加强HCC的诊断效能具有重要的意义。
cfDNA主要由细胞死亡释放, cfDNA的水平被认为与炎症、细胞衰老以及一些恶性肿瘤有关, 特别是在肿瘤学中, cfDNA已被提示是用于预测包括癌症在内的不同病理风险的合适的非侵入性生物标志物, 并且还与诸如非酒精性脂肪肝或乙型肝炎等不同的肝脏疾病相关[15, 16]。据报道, 癌症患者的cfDNA水平明显升高, 从肿瘤细胞衍生的碎片化cfDNA及其变化被认为是肿瘤学早期检测、风险分层和反应监测的潜在替代标志物[6, 7]。本研究结果发现, 肝癌患者cfDNA水平明显高于肝良性肿瘤患者, 这与既往研究报道相符[8]。同时, 也发现基因编码cfDNA的内参基因RNaseP在肝癌患者和肝良性肿瘤患者之间具有显著差异性。阎其均等研究发现, 肝癌不同分期之间cfDNA水平具有明显差异[9]。Alunni-Fabbroni等研究表明, cfDNA水平与HCC的AFP水平具有显著的相关性, 但与其他病理参数无明显相关性[17]。而Papatheodoridi等研究表明, cfDNA水平与HCC患者是否存在糖尿病、ALT水平、是否肝硬化、血清HBV DNA具有明显的相关性[18]。本研究结果显示, 患者的Child-Pugh评分、终末期肝病模型评分、肿瘤大小、转移、酒精性肝炎阳性在低cfDNA组和高cfDNA组具有明显差异, 提示cfDNA水平与HCC患者的这些病理参数具有一定的相关性, cfDNA水平可能为HCC患者的早期诊断及严重程度评估提供参考价值。在Papatheodoridi等研究表明, RNaseP编码DNA的水平能很好的预测HCC的发展[18]。进一步, 本研究评估了MRI联合RNaseP在HCC早期诊断中的诊断效能, 结果显示, MRI联合RNaseP对于早期HCC诊断的灵敏度明显优于单纯MRI或单纯RNaseP的灵敏度, 而单纯MRI和单纯RNaseP对于早期HCC诊断的灵敏度则无明显差异, 提示MRI联合RNaseP对于早期HCC的诊断具有更高的价值。有研究指出, 从HCC患者血浆中分离出的cfDNA具有一组独特的遗传变异[19], 未来仍需要进一步研究在早期筛查中cfDNA独特的遗传变异与MRI对于HCC早期筛查的应用价值。
综上所述, cfDNA水平与Child-Pugh评分、终末期肝病模型评分、肿瘤大小、转移、酒精性肝炎具有明显的相关性, 对肝细胞癌早期筛查, 基因编码cfDNA的内参基因RNaseP与MRI的联合诊断相较于单纯MRI具有更高的诊断效能。由于本研究样本量较小, 且为单中心研究, 本研究的结果仍需要进行大样本、多中心的研究进一步论证。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|